背景
晚期胸腺肿瘤会侵犯上腔静脉(SVC),当能彻底清除时,可在多模式治疗途径内采用上腔静脉(SVC)置换手术治疗。本文介绍接受SVC切除和SVC重建治疗Ⅲ或Ⅳ期胸腺恶性肿瘤患者的结果。
方法
1989-2015年,27例胸腺肿瘤(21例胸腺瘤,6例胸腺癌)累及SVC的患者行根治性切除及SVC置换术,其中牛心包导管置换12例,聚四氟乙烯导管13例,猪心包导管1例,隐静脉导管1例。所有患者均接受血管重建。
结果
6例患者合并肌无力。所有患者均为完整切除(R0)。12例患者术前接受诱导治疗。16例患者进行肺切除术(11例楔形,5例全肺切除术)。22例患者为Masaoka III期,5例为IVa期。死亡率7.4%,没有死亡与血管重建相关。主要并发症发生率为11.1%。中位随访时间为58个月(范围4~134个月),复发9例(36%)。3年和5年总生存率分别为80%和58.1%。3年和5年肿瘤特异性生存率分别为90.5%和75.4%。胸腺瘤特定5年生存率为93.8%。所有Ⅲ期患者特定5年生存率为77.1%。组织学病理为胸腺癌与患者的预后无关。心包导管的长期通畅率为100%。
结论
肿瘤切除和SVC重建是根治性切除局部晚期胸腺肿瘤的治疗选择。异种心包导管是该研究中心的首选治疗方案。
晚期胸腺恶性肿瘤是一组成分混杂的纵隔肿瘤,包括胸腺瘤和浸润周围胸部结构的胸腺癌。手术在特定的III期,有时是局限的IV期病例多模式治疗方案的一部分。当肿瘤浸润上腔静脉(SVC)时,可以有选择地通过SVC彻底切除和导管置换术来实现根治性切除。自最初的经验以来,各种自体或异源(合成或生物)血管重建材料被引入。生物材料如牛心包提供了比合成材料更好的生物相容性,无需抗凝治疗,不僵硬。
在以前较少的有限的出版的经验中,这种情况下,有安全的可切除性和良好的长期结果(表1)。这些文献通常报道侵袭性前纵隔肿瘤、侵犯大血管和其他邻近结构肿瘤的扩大根治术的结果。此外,其中一些研究提供了有关治疗不同组织学肿瘤和异质性肿瘤多模式治疗方案的结果的综合数据。
我们报告了胸腺瘤和胸腺癌根治术后SVC置换的结果。据我们所知,这是有史以来最大的系列胸腺恶性肿瘤的SVC导管替换术。
表1. 报道胸腺瘤和胸腺癌上腔静脉导管置换术的文献经验
材料和方法
1989年至2015年间,连续27例浸润SVC的胸腺肿瘤(21例胸腺瘤,6例胸腺癌)接受了根治性切除及SVC置换。其中4例,肿瘤在腔静脉汇合处侵犯左头臂静脉。同期里接受SVC直接修补或补片修补的患者不包括在内。在本研究期间,6例患者在胸腺瘤或胸腺癌切除后发生边缘血管浸润(罕见),需要SVC补片重建(N=2)或SVC I期修复(N=4)。
这项研究得到当地伦理委员会的批准,并根据“Helsinki宣言”进行。所有患者都提供了书面知情同意,以进行外科手术,并将其个人资料纳入科学数据库。
根据Masaoka-Koga胸腺瘤的临床和病理分期系统对患者进行了分类。术前检查和分期包括全身CT造影和骨扫描。只有在CT造影扫描出现禁忌症的患者才进行脑部磁共振检查。
自2004年以来,在手术前仅对CT扫描发现可疑转移灶的病人进行了氟脱氧葡萄糖正电子发射断层扫描。术前临床评估肺部受累患者的肺功能,如果功能可切除性存在疑问的话,可进行肺灌注显像相关的呼吸功能测试。常规做心电图进行心脏评估。所有心电图异常或有心脏病病史的患者均行超声心动图检查。
术前组织学诊断采用CT引导下细针穿刺活检、纵隔切开术或胸腔镜活检。进行了术前活检(18例),以获得诊断用于指导治疗,或当对肿块性质存疑时进行活检(即非外科疾病)。所有出现支气管树受压或潜在受累的患者均行纤维支气管镜检查。选择的患者在手术中出现胸膜或心包完全可切除疾病者也包括在内。所有切除均采用胸骨正中切开术。
当肿瘤浸润到30%以上的血管时,可确定为环形腔静脉切除和导管重建的适应证。SVC置换中,牛心包导管置换12例,聚四氟乙烯(PTFE)导管13例,猪心包导管1例,隐静脉导管1例。在我们的一开始的时候,最佳的选择是环形PTFE导管,但生物材料的导管,比如隐静脉导管也在应用。自2003年以来,我们的首选是牛心包,这被认为是一种最佳的替代选择,因为它的生物相容性,因为它更薄,因此更容易缝合到血管壁去。猪心包是最近被用作这个系列研究的首选替代物。自2003年以来,所有的腔静脉重建都是用异种心包导管进行的。
在切除浸润的SVC部分后,导管被插入并与近端和远端的腔静脉端按照我们先前所描述的技术用5-0聚丙烯固定缝合。
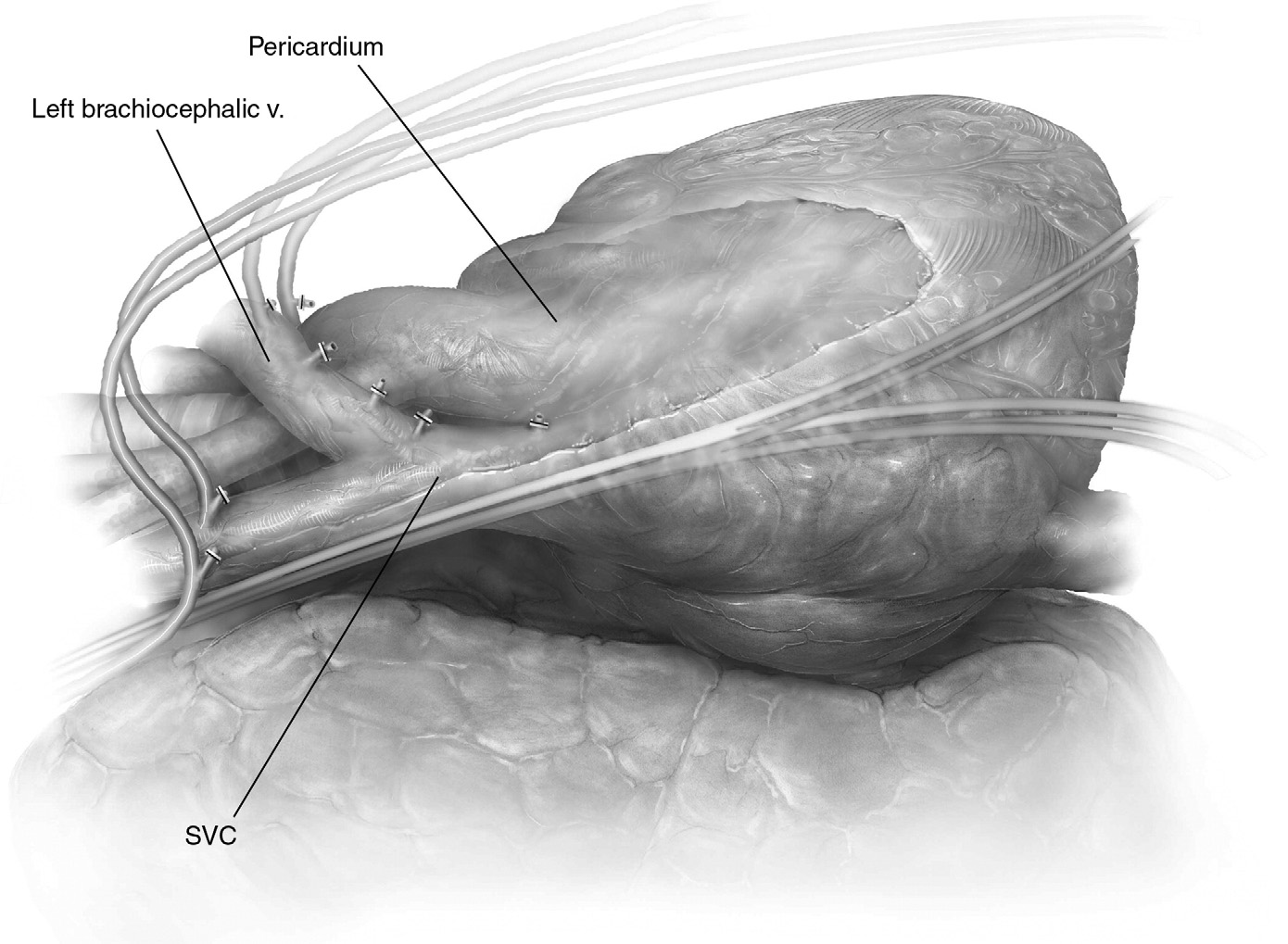
在确定切除血管段的大小后,根据我们先前描述的原始技术(图1),在手术中实现了异种牛心包导管吻合。所有患者均采用无体外循环的交叉夹闭固定技术重建血管。
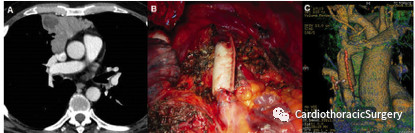
图1. 牛心包假体重建上腔静脉治疗胸腺癌 (A)术前CT扫描图像。 (B)完成重建(术中视野)。(C)在1年内进行CT容积研究显示重建血管完全通畅。
夹闭前静脉注射肝素钠(0.5mg/kg),这样,松开后不会被鱼精蛋白逆转。术后给予低剂量肝素,出院时转为口服抗凝,聚四氟乙烯(PTFE)重建患者持续终生,生物重建患者继续使用抗聚集剂(噻氯匹定)6个月。
利用CT容积成像和造影剂结合的肿瘤检查对重建血管的通畅情况进行评估。自2003年以来,所有接受牛心包置换术的SVC患者均接受了磁共振成像研究,计算静态和动态地第一年末血管的口径和流量水平。
肿瘤随访采用全身CT扫描,前2年每3个月重复一次,后3年每6个月复查一次。如果存活,所有患者都可以在前5年进行随访。最后一次随访日期是2016年10月。
数据是用Excel数据库收集和存储的(Microsoft公司,Redmond,WA)。定量变量被表示为平均值±SD,而名义变量被表示二进制,事件存在(1),不存在(0)。总生存期是指手术日期与死亡日期或最后一次病人随访之间的间隔。癌症特异性存活(CSS)是指手术日期与因癌症死亡日期之间的间隔。因癌症以外的原因而死亡的病人被认为是除外的。除整体生存外,所有的存活都与癌症的特异性存活有关,目的是减少偏倚。无疾病生存被定义为从手术到肿瘤复发的时间,无论是局部的还是远处的。用Kaplan-Meier曲线计算CSS和无病生存期。分类变量的比较,用卡方检验的Fisher精确检验或Yates修正(适当时)。采用逐步向后Cox回归模型识别影响CSS的变量。采用p值小于0.1的变量进行多因素分析。P值小于0.05认为有意义。所有统计分析均采用SPSS Mac17.0版(SPSSInc,芝加哥,IL)。
结果
患者中,男性13例(48.2%),女性14例(51.8%)。平均年龄56~14岁(29~76岁)。6例患者(22.2%)为肌无力。所有手术切除均完成(R0)。新辅助化疗方案对12例表现为大肿瘤的患者进行了新辅助化疗,这些肿瘤可能涉及到比SVC更多的其他胸内周围结构。在12例新辅助患者中,7例反应率超过50%,5例在手术时出现,反应率在30%至50%之间。肺切除16例,楔形切除11例,全肺切除术5例。6例需要局部心包假体重建。
按世界卫生组织分类:AB型胸腺瘤9例,B1型胸腺瘤3例,B2型胸腺瘤3例,B3型胸腺瘤6例,胸腺癌6例。MasaokaⅢ期22例,IVa期5例。IVa期3例为胸膜病变,2例为心包病变(最大病灶数:2)。术后死亡2例(7.4%),其中1例死于心力衰竭和肺水肿,1例死于大面积肺栓塞。这些患者在CT血管造影扫描中没有显示有腔静脉血栓形成的迹象,并且在血管阻断期间或之后没有出现术中心脏问题。无死亡与血管重建有关。
主要并发症发生率为11.1%(3例),轻微并发症(无生命危险)6例(22.2%)。主要并发症有肺水肿1例,肺栓塞1例,术后呼吸功能不全1例,需要临时气管切开。其他并发症包括心房颤动(3例)、持续实质漏气(2例)和乳糜胸(经肠外营养10天后解决)(1例)。20例接受辅助化疗或放化疗(N =15),5例单独进行辅助放疗。
中位随访58个月(4~134个月),复发9例(36%)(局部6例,远处3例)。依据死亡竞争风险计算出的复发率在3年和5年时分别为5.1%和8.3%。3年和5年总生存率分别为80%和58.1%(95%可信区间[CI],70.2%~11.8%)。3年和5年CSS分别为90.5%和75.4%(95%CI,92.4%~128.4%)(图2)。3年和5年无病生存率分别为90.5%和67.0%(95%CI,67.9%~108.9%)(图3)。Ⅲ期患者3年和5年生存率分别为88.9%和77.1%,IVa期3年和5年生存率分别为100%和66.7%(95%CI,78.7%~118.1%;p=0.8)。胸腺瘤患者3年和5年生存率分别为100%和93.8%,胸腺癌3年和5年生存率分别为50%和0%(95%CI,10.6%~70.2%,P<0.008)。在多因素分析中,胸腺癌是唯一的阴性预后因素(危险比7.04;CI,3.41~71.61;p=0.002)(表2)。
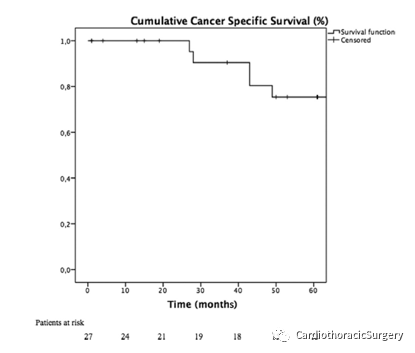
图2.癌症特异性生存曲线(Kaplan-Meier)
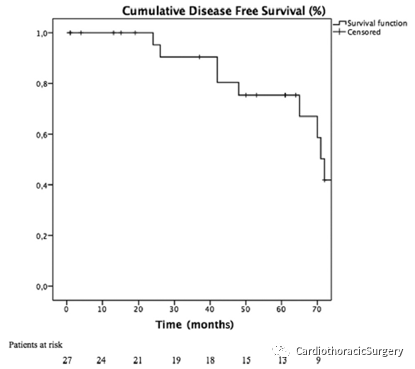
图3.无疾病生存曲线(Kaplan-Meier)
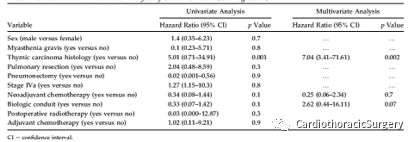
表2.整体生存的单因素和多因素分析(COX回归)
心包导管的长期通畅率为100%,而接受聚四氟乙烯导管重建的3例患者出现部分或完全阻塞(p=0.2)。随访3个月,发现1例完全性阻塞和1例部分阻塞。6个月时发现其他部分梗阻。未观察到与部分闭塞相关的临床征象,完全闭塞的患者在躯干上区出现水肿。使用聚四氟乙烯导管的患者平均随访69个月。重建血管阻塞的患者中没有局部复发。
评论
SVC可能被纵隔肿瘤浸润,在这些肿瘤中,胸腺瘤和胸腺癌是最常见的直接涉及血管的组织学类型。当只考虑侵袭性胸腺肿瘤时,手术切除的完整性通常是影响预后的最重要因素之一。切除不完整或减瘤手术通常不会改变长期存活率。不幸的是,由于周围解剖组织结构的涉及过于广泛,在30%至40%的侵入性胸腺肿瘤病例中,根治术是不可行的。
SVC的浸润不仅影响疾病的肿瘤学严重程度,而且增加了手术的技术复杂性,为了在选定患者中实现根治性肿瘤切除,需要扩大切除范围和进行重建。切除的完整性是影响患者长期结局的主要因素之一。在过去几年中,越来越多的经验有助于改善这种复杂操作的结果。然而,由于担心围术期并发症和死亡率较高,这些治疗在胸外科医师中的扩散仍然有限。
导管替换SVC通常适用于浸润超过30%的血管周长的情况。一些作者报告了浸润超过50%的导管重建的指征。根据我们的经验,切除30%以上的SVC周长后进行补片重建可能会导致更高的扭结、血栓形成和闭塞风险。
所有患者均采用交叉夹闭技术进行导管重建。在我们看来,这种方法可以提供一个显著的优势,降低与体外循环相关的发病率和死亡率。然而,应尽一切努力尽量减少闭合时间,特别是SVC系统不完全阻塞的患者。当给予适当的药物支持时,完全的血管闭合通常能耐受45到60分钟。我们的术中管理(药物神经保护)包括在夹闭前给予类固醇,并通过给液和血管收缩剂来优化循环参数,以提高平均动脉压。在夹闭前给予静脉肝素钠抗凝,考虑到用于重建的移植物材料的特点,在术后继续使用肝素钠抗凝。这一术中方针与我们的术后抗凝或抗血小板聚集治疗相结合,已被证明有助于降低血栓形成的风险。然而,由于在这一情况下发表的文章数量非常有限,文献中没有有力的证据和标准的指征。
尤其是2例因肺栓塞或心力衰竭死亡的患者,在CT血管造影检查中未见有腔静脉血栓形成的迹象,术中或血管阻段后即刻无心脏问题,提示与血管重建无关。
重建策略可能因肿瘤部位和范围不同而有所变化。如果两个无名静脉的汇合无病变,则可通过SVC干置换进行血管重建。血管夹闭和切除后,首先行上腔静脉残端与假体导管的吻合。为避免导管扭结,应调整导管长度,使远端吻合口处于张力状态。在无名静脉汇合处有SVC肿瘤浸润的情况下,左无名静脉与SVC残端下方(或右心房)之间的血管重建,通常伴随右无名静脉的关闭,或右无名静脉与SVC残端下方(或右心房)之间进行血管重建,伴随左无名静脉的关闭,具体以局部侵犯情况为依据。在本研究中,最后一项技术应用于4例左侧无名静脉在腔静脉汇合处被肿瘤浸润的病人。
部分文献经验包括无名静脉-右心房双旁路SVC部分切除。我们认为,这种重建应该避免,因为通过旁路的血流太低,并有血栓形成的高风险。
然而,SVC置换的最佳策略仍然存在争议。在SVC导管重建所用的合成材料中,PTFE是大多数外科手术中的首选材料。环状 PTFE移植物已被报道能保持了几年的通畅,一些作者认为PTFE具有成环的优点,当中心静脉压变为负值时,可以防止移植物塌陷。据其他作者说,重建物的硬度不允许周围结构在胸骨闭合时造成的压迫,而且当纵隔纤维化和瘢痕组织发生时,它不会改变。此外,与Dacron移植相比,它不久后因人上皮细胞发生再上皮化,具有较低的感染风险,较少的血小板聚集,和较弱的促凝性。其他管道选择包括管状牛心包,螺旋隐静脉移植物,以及最近的猪心包。PTFE的主要问题是需要长期抗凝治疗和血栓形成的风险。生物材料已经在低压胸大血管的重建过程中获得了广泛的接受,正如我们以前的经验所报道的那样。根据仍然有限的发表的数据,相比于合成材料,心包导管有一个较低的感染和血栓形成的风险,而且不需要长期抗凝。包括生物(第二个研究期)和合成PTFE (第一个研究期)在内的本系列所产生的结果支持了这一观点。在这一经验中,生物材料的选择,特别是牛心包,可能在降低血栓形成性和增加通畅方面显示出优势。由于这些主要原因,即使作者们的选择随着时间的推移而改变,他们的首选是生物材料,尤其是牛心包。
最大和最重要的出版的SVC切除经验通常包括部分和补丁SVC重建,有时肺癌和纵隔肿瘤患者也在相同的研究中。这项研究仅包括接受胸腺恶性肿瘤导管重建的患者,提供了一个足够均质的统计样本,但受研究时间较长和使用不同材料的限制。侵袭性胸腺恶性肿瘤的SVC导管置换一般作为少数病例报道为,其中也包括对其他侵袭性纵隔肿瘤进行同样手术的患者。然而,大多数文献既没有显示接受这种侵袭性胸腺恶性肿瘤血管重建手术的患者的确切数量,也没有显示这组患者的结局,只是报告了不同纵隔组织学的累积数据。
此外,多模式治疗策略通常会随着时间和不同的经验而改变。其他更近的报告表明,如果与辅助治疗相比较,诱导治疗对III期胸腺瘤具有生存优势。在本系列中,12例(44%)有无法切除 SVC风险的患者接受了新辅助化疗,患者的肿块可能累及其他胸内结构;其他完全可切除的涉及SVC和肺的肿瘤的患者接受了前期手术。包括在本研究中的患者的长期生存结果可能受到少数选择的Via期(n=5)的病例和胸腺癌(n=6)患者的影响,它们的预后较差,对辅助治疗的反应减少。无论如何,特别是胸腺肿瘤患者,包括接受SVC置换的Ⅲ期和Iva期胸腺瘤和胸腺癌的患者,一起统计在生存状况中。
我们意识到本研究有一些局限性:首先,少数患者在很长一段时间内使用不同的材料进行重建。二是回顾性。主要优势是由同一手术团队进行的同质系列手术,其适应症和长期的肿瘤学治疗均未改变。
结论
SVC整块切除及导管重建是一种可行的手术方法。由于患者数量有限,我们的经验表明,即使在新辅助化疗之后,这种手术方法也是安全的,在肿瘤学上是可靠的,可以根治性切除局部晚期胸腺肿瘤。在我们的经验中,异种心包导管是首选。
原文题目:Superior Vena Cava Replacement for
Thymic Malignancies. Ann Thorac Surg. 2019 Feb;107(2):386-392.
原文链接:http://www.xxwk.net/archives/1189