编译:傅睿 唐文芳
肺癌是世界上发病率和死亡率最高的恶性肿瘤之一,晚期肺癌因涉及其他部位转移,五年生存率十分有限。
转移通常被描述为一个涉及多个环节的过程,包括肿瘤细胞从原发部位进入血液或淋巴循环,在血液或淋巴系统中存活,定植于远处器官,在远处器官中存活并生长为转移瘤。大多数肿瘤细胞并不能最终实现远处转移,它们要么在循环过程中死亡,要么阻塞在毛细血管中,亦或在24小时内于血液循环中凋亡;而即使定植在远处器官,也只有一小部分癌细胞最终会发展成为转移瘤[1]。因此,这一多步骤过程被认为是低效的。然而,一旦转移瘤定植并开始生长,其生长规律可能遵循“大爆炸”模式(Big bang)[2],并且当前的手段常常无法提供持久的疗效。
每一个转移癌细胞都代表了原发肿瘤的一个进化分支,并可能与原发灶共享关键的驱动基因改变。这些细胞并不是经过阳性选择而转移,相反,一系列具有关键的适应性特征被选择出来以获得转移的潜能。
因此,广东省人民医院钟文昭教授团队及中山市人民医院梁毅教授团队合作联合在线发表题为“Genomic Evolution of Lung Cancer Metastasis: Current Status andPerspectives”的社论[3],目的从基因组的角度出发探讨了自然进程下肺癌转移灶和原发灶的基因组事件差异、肺癌转移的进化模式和转移时机,以及不同转移器官间的进化轨迹是否存在差异等问题。肺癌原发灶和转移灶的基因组异质性
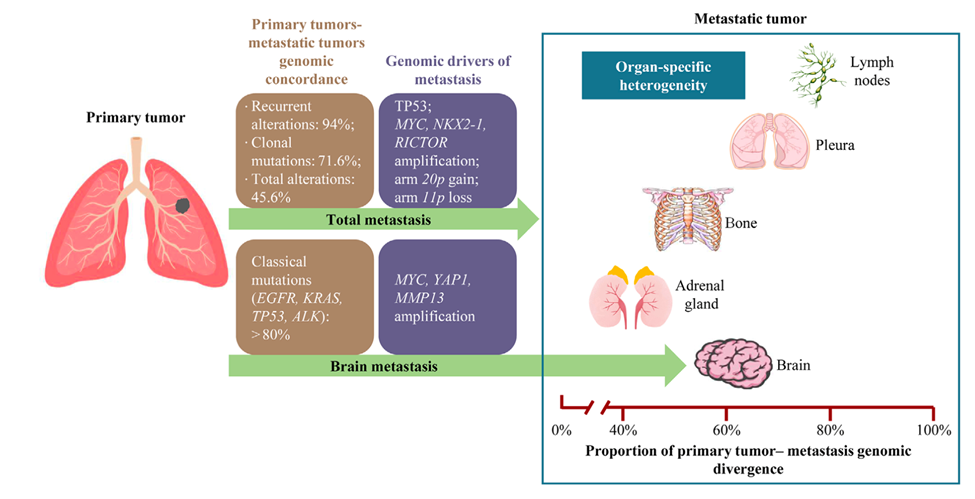
在转移过程中每一环节的关键都离不开肿瘤细胞的特定表型及其与宿主微环境和免疫系统的相互作用。从原发灶和转移灶的癌细胞中获得的基因突变的信息可以部分解释这些表型和宿主的相互作用。 此前一项研究对15名患者的30个肿瘤样本进行panel测序,结果表明原发灶和匹配的转移灶之间的重复出现的基因组变异的一致性为94%,而基因组乘客突变的一致性为 63%。6名患者的原发肺癌病灶和转移性淋巴结之间的体细胞突变一致率为71.6%。在61名脑转移患者中,主要的驱动突变(包括EGFR、KRAS、TP53、ALK)在原发的肺癌病灶和匹配的脑转移病灶之间高度一致(>80%)[4](图1)。这些结果提示经典的驱动基因改变如EGFR和ALK,可能是肺腺癌发生过程中基因组的早期克隆事件。而对于总体的基因改变,有学者报道了[5]肺癌原发灶和转移灶之间的总体一致性为45.5%,每个患者的一致性范围在7.3%-80.6%。此外,还观察到转移部位的特异性差异。在淋巴结、骨、脑和肾上腺转移的肺癌患者中,淋巴结转移灶与原发灶的肿瘤共享突变比例最低,而肾上腺转移灶与原发灶的肿瘤共享突变的比例最高。因此,瘤间的基因组异质性反映出全面了解肺癌基因突变在临床实践中的重要性,并可以部分解释抗肿瘤治疗的疗效异质性。 肺癌转移的基因组驱动因素
有研究将GENIE队列中未匹配的1897个原发灶和1133个转移灶样本进行了比较,结果显示常见的突变基因的频率有很大程度的重叠,调整了FDR(false discovery rate)之后,仅显示TP53是潜在有意义的驱动分子[6]。美国斯坦福大学Shih团队对73个脑转移样本进行全外显子测序并与TCGA数据库中503个肺腺癌原发灶样本进行比较,通过GISTIC评分的筛选和动物模型的验证,研究者发现MYC、YAP1和MMP13扩增是肺腺癌脑转移的代表性潜在驱动因素。值得一提的是,上述研究的均基于未配对的原发-转移样本[7]。 在匹配的原发-转移灶之间进行配对分析可以揭示特定的事件是否在某一个体肿瘤的转移部位富集,并区分该事件是发生在转移之前还是转移之后。Tang等人[5]对54对原发-转移样本进行单一区域或多区域全外显子测序,发现MYC扩增、NKX2-1扩增、RICTOR扩增、arm 20p-gain和 arm 11p-loss是肺癌转移潜在的驱动因素。上述体细胞突变和分子事件可以突破肿瘤进化瓶颈,并在转移灶癌细胞中继续存在,因此,它们在转移灶中可表现出升高的突变频率。
肺癌转移的进化模型和时机
目前,描述肿瘤转移的进化模型主要有两种[1]:线性进化模型和平行进化模型。两者都假设原发肿瘤及其转移是克隆相关的,而差别是基于转移细胞开始在原发肿瘤扩散的时间和原发-转移灶基因组异质性(在共同的始祖克隆之后,原发灶和转移灶之间的独立SNV的数量)。线性进化模型:具有转移潜力的癌细胞克隆出现在肿瘤发生的晚期,而扩散发生在临床可检测到原发灶时。由于转移是由最晚的主克隆或亚克隆播散的,所以原发-转移灶的基因组异质性相对小。平行进化模型:转移性克隆或亚克隆出现在肿瘤原发灶发生发展的早期,原发灶的癌细胞和转移灶的癌细胞的克隆在不同的压力下继续平行进化,导致原发灶与转移灶之间存在显着的基因组学差异(图2)。
不同肿瘤类型可能表现出不同的进化模式。乳腺癌细胞的转移在原发肿瘤发生的后期,而结直肠癌的转移性癌细胞可出现在肿瘤发生的早期。为了定量分析肺癌转移发生的时间,Tang等人使用一个已发表的开源计算工具SCIMET进行估算:发生转移时原发肿瘤的直径大小(Nd)和基因突变速率(u),结果表明大多数肺癌倾向于晚期转移(33/54;61.1%)。但肺癌的转移时间也具有部位特异性,淋巴结倾向于早期播散,而胸膜、骨、肾上腺和脑的转移往往是晚期播散。此外,在原发灶被诊断之前,肿瘤细胞转移到淋巴结所需的时间平均为4.26±0.74年。然而,对于胸膜转移和远处转移,在检测到原发灶之前,平均转移时间仅约为2.11±0.33年。这一结果与之前一项包括乳腺癌、结直肠癌和肺癌在内的泛瘤种研究的结果一致,该研究表明总体肺癌的转移时间为3.6年(IQR=2.8-3.7)[8]。
总而言之,上述结果反映出肺癌早筛的重要性。

肺癌转移的播散轨迹
在结直肠癌中,有学者发现淋巴转移和远处转移在17例病例中只有35%具有共同的亚克隆起源,大多数病例来自原发灶中的独立亚克隆。通过描绘结直肠癌中淋巴转移的播散轨迹,Zhang等人[9]确定了三种播散模式:interlayer sequential spread,interlayer skip spread,intralayer spread。其中,44.3%的结直肠癌淋巴结转移案例表现为interlayer sequentialspread。对于转移性肺癌,尽管目前可获得的相关数据有限,但了解淋巴结转移与远处转移的进化关系对于预防远处转移具有重要的临床意义。对来自136名乳腺癌、结直肠癌和肺癌患者的 457 对原发-转移样本进行分析发现,多克隆转移在未经治疗的淋巴结转移和远处转移中很常见,但在治疗后的远处转移中不太常见,这表明治疗干预在肿瘤进化过程中施加了巨大的选择压力。最近,通过重建肿瘤的进化起源过程,Tang等人发现大多数转移灶(7/8)可能是由原发灶直接转移,而不会经淋巴结转移。肿瘤的转移可以经由多种途径朝着不同方向进行。需要更大样本量的淋巴结-多部位远处转移队列来探索肺癌转移的进化轨迹。展望
据我们所知,肺癌基因组进化大多数局限于早期或局部晚期肺癌[10, 11],而对肺癌远处转移的进化轨迹知之甚少。肿瘤的转移是一个高度非随机的过程,而肺癌也表现出一定的器官特异性发病率和总生存率。然而,肺癌转移的器官特异性模式背后的机制仍不清楚。以前的研究发现了一些潜在的转移驱动因素,但潜在的机制需要进一步探索。一项泛癌种的进化研究表明克隆转移播散也表现出器官特异性。然而,由于肺癌样本数量小且转移部位仅限于淋巴结和脑,肺癌转移的克隆播散模型尚未明确。因此,今后人们应着力发展肺癌原发-转移灶综合性、多组学分析,以更好地了解肺癌转移的生物学行为和特征,以达到预防肺癌转移、提高这些患者的总体生存的目的。结论
总的来说,肺癌转移大多呈现晚期播散,并具有中度的基因组异质性和潜在的驱动分子。治疗的选择性压力可以改变淋巴结转移和远处转移的克隆播散模式。最后,肺癌转移在基因组异质性和转移时间上表现出器官特异性模式。

原文链接:http://www.xxwk.net/archives/2221