北京时间2022年4月22日,国际医学顶级期刊之一柳叶刀杂志(Lancet,IF=79.321)在线刊登了由西日本肿瘤学组和日本临床肿瘤学组(West Japan Oncology Group and Japan Clinical Oncology Group)开展完成的一项大型多中心随机对照研究JCOG0802/WJOG4607L(以下简称0802)的最终结果。《柳叶刀》同期配发的评述“When less is more in thoracic surgery”对该结果的评价是“remarkable”。作为日本学者探索早期NSCLC最佳手术方式的研究“三部曲”之一,不同于JCOG0804和JCOG1211,0802重点研究周围型放射学侵袭性腺癌,针对该类型腺癌不同切除范围的选择可能会给患者的远期预后带来深刻的影响,而这正是近10年来0802备受瞩目的关键所在。从2021年5月JCOG研究主席,现任世界国际肺癌研究联盟肺癌分期委员会主任浅村尚生教授(Hisao Asamura)在美国胸外科协会年会上第一次介绍0802的研究结果至今已有将近一年,现在我们终于可以直接、详尽、系统地学习体会这项关于肺段切除对比肺叶切除的经典研究。相比于先前公布的预印本文章,最终版本延续了结论中对肺段切除适应证的表述——肺段切除术应该作为小周围型非小细胞肺癌的标准术式,但进一步充实了研究设计细节和方案施行情况,并且在per-protocal分析的基础上,补充了对主要终点的as-treated分析。
在最终版本发布的这个重要节点,再次研读回味0802研究精彩的设计、非凡的结果以及研究者不偏不倚的讨论,十分有意义,甚至带有一些浪漫色彩。
0802凭什么可以将肺段切除术作为一种标准术式?
在研究设计伊始,JCOG团队围绕总生存和术后呼吸功能设想了四种可能的结局。浅村教授拿日本柔道来举例,一旦有选手在场上获得“一本”(一种得分形式),即获得该比赛的胜利,“一本”就相当于研究的优效性设计。但0802采取了另外一种设计,指在没有获得“一本”的情况下,获得两个“技有”等于取得了“一本”,也就是说,如果肺段切除的肿瘤学疗效非劣,且6个月或12个月时FEV1相对于肺叶组的差值超过了10%,相当于取得了两个“技有”,也是“一本”,我们就可以认为肺段切除术优于肺叶切除术。
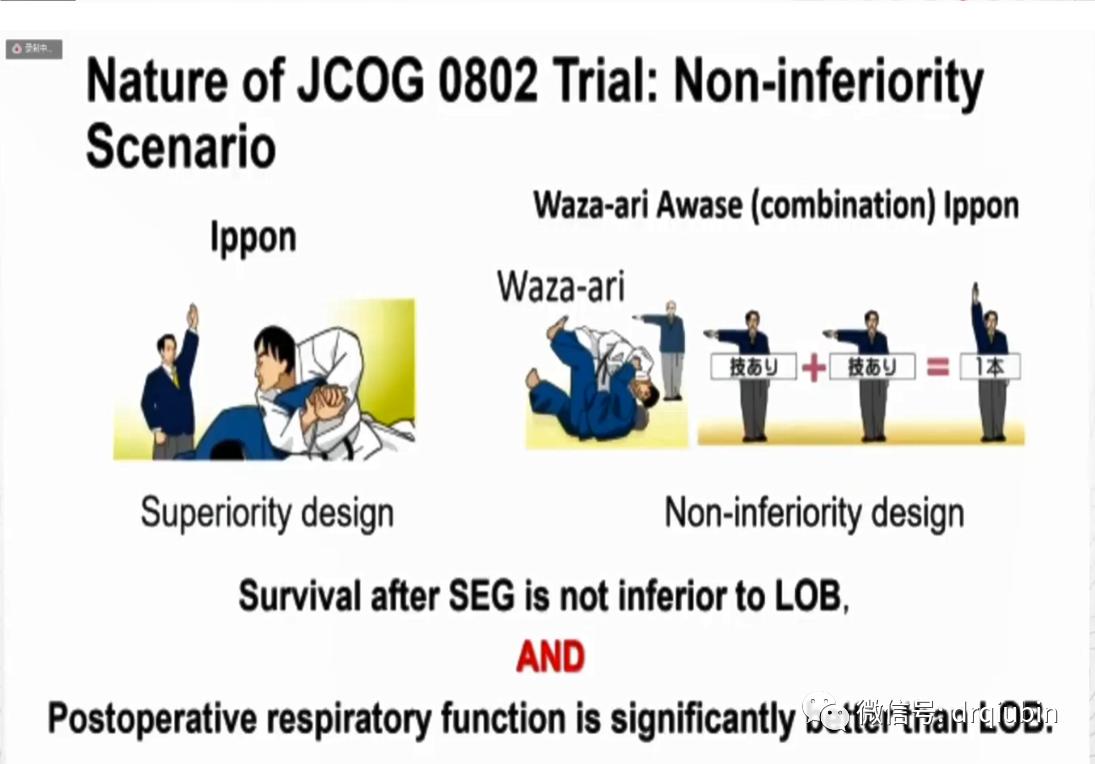
而肺段切除最终出乎绝大多数人的意料,在一项非劣效研究中取得了主要终点的优效性,取得了“一本”,直接胜出。换成大家更熟悉的足球来说,相当于欧冠决赛,教练和球迷希望自己的队伍在客场0:0逼平对手,下一场取得主场优势后1:0小胜,总比分1:0获得最终的胜利,但0802就偏偏讲述了一个客场主场都获胜的夺冠故事。
0802还带来了哪些重要启发?
首先在局部复发上,肺段组的复发率差不多是肺叶的两倍,但并没有对OS带来显著的影响。这个结果,值得我们反复慎重地思考。肺段切除的切缘控制目前可以通过术前三维重建的规划进一步完善,那么,淋巴结清扫呢?0802没有给出段间淋巴结的数据,但是随访中出现淋巴结转移的患者占局部复发中很大的一部分,说明淋巴结清扫的策略也要再加以定夺。2cm以内的肺结节,有相当一部分可以不做系统彻底的清扫,这样节省时间,也符合微创理念,但也不能过于乐观。术中淋巴结的冰冻病理,有些情况是必要的。同时,因为肺段组针对复发进行了积极的再治疗,带来了OS的实际获益,体现了对早期肺癌进行全程的个体化管理的价值。
然后是亚组分析结果,纯实性肿瘤在肺段组的结果很惊喜。纯实性结节往往比部分实性结节的分化情况更差,不少医生倾向于只在GGO中进行亚肺叶切除,0802的结果有助于肺段切除术的适应证在实性结节中的扩大。但话说回来,出现局部复发的,有多少是实性结节?如果绝大多数是实性结节,GGO几乎不复发,那是否说明亚肺叶切除的适应证可以朝更大尺寸的GGO扩展?JCOG1211的初步结果表明,对于3cm以内,CTR<0.5的GGO,肺段切除的5年RFS和5年OS都达到了98%以上。那么,会不会对3cm以内的周围型肺结节,只要含有GGO成分,不是纯实性,肺段切除都可以作为标准手术方案呢?
展望肺段切除术的未来
JCOG0802的开展间接推动了中国胸外科医生对包括肺段切除术在内的解剖性部分肺叶切除术的技术精进。基于JCOG0802和JCOG1211研究,中国医学科学院肿瘤医院胸外科邱斌教授团队已经启动一项专注于复杂肺段切除术对大小在2~3cm的GGO疗效的多中心随机对照试验,通过三维重建技术贯彻解剖性部分肺叶切除的先进理念,进一步确定亚肺叶切除在手术治疗早期非小细胞肺癌领域中的地位。有兴趣了解的读者可以从本公众号之前发布的文章了解该研究方案详细的设计思路。
在本文的最后,笔者提供了JCOG0802这篇文章的中文翻译以及期刊原文,欢迎各位同道参考、收藏、转发!
- 中文翻译 -
比较肺段切除术和肺叶切除术治疗小周围型非小细胞肺癌(JCOG0802/WJOG4607L):一项多中心、开放标签、3期、随机、对照、非劣效性试验
概述
背景
肺叶切除术是早期非小细胞肺癌(NSCLC)的标准治疗方法,而尚无研究肺段切除术在生存和临床的获益的随机试验。我们的目标是研究在小周围型NSCLC患者中,肺段切除术是否不劣于肺叶切除术。
方法
我们在日本的70家中心开展了这项随机、对照、非劣试验。临床IA期NSCLC(肿瘤直径≤2cm;实性成分占比>0.5)患者随机1:1分配到肺叶切除组或肺段切除组。通过最小化法进行随机分配,平衡了机构、病理类型、性别、年龄和薄层CT表现等各个因素。治疗方案分配不对研究者及患者隐藏。主要终点是所有接受随机患者的总生存率。次要终点包括术后呼吸功能(6月和12月)、无复发生存率、局部复发率、不良事件、肺段切除比例、住院时间、引流时间、手术时长、出血量、切割吻合器使用数。在意向治疗基础上分析总生存率,危险比(HR)的95%置信区间上限的非劣效界值为1.54,使用分层Cox回归模型进行估算。本研究在UMIN临床试验注册处注册,UMIN00002317。
发现
在2009年8月10日至2014年10月21日期间,共有1106名患者(意向治疗人群)接受肺叶切除术(n=554)或肺段切除术(n=552)。两组患者的基线临床病理因素平衡良好。在肺段切除组,22名患者转为肺叶切除术,1名患者接受宽楔形切除术。平均随访7.3年(范围0.0-10.9),5年总生存率,肺段切除组为94.3%(95%CI,92.1%-96.0%),肺叶切除组91.1%(95%CI,88.4%−93.2%); 采用分层Cox回归模型证实了(肺段切除组)总生存率的优效性和非劣效性(HR0.663;95%CI,0.474–0.927;非劣性单侧p<0.0001;优效性p=0.0082)。在所有预定义的肺段切除组的亚组中,观察到总体生存率一致提高。在术后1年的随访中,两组患者FEV1下降的显著性差异为3.5%(p<0.0001),未达到具有临床意义的10%预定阈值。5年无复发生存率,肺段切除组为88.0%(95%CI,85.0%-90.4%),肺叶切除组为87.9% (95%CI,84.8−90.3)(HR0.998;95%CI 0.753-1.323;p=0.9889)。肺段切除组和肺叶切除组局部复发的患者比例分别为10.5%和5.4%(p=0.0018)。83例患者中52例(63%)和58例患者中27例(47%)分别死于肺叶切除术和肺段切除术后的其他疾病。未观察到30天或90天的死亡。两组术后出现一种或多种2级或更严重并发症的频率相似(142[26%]例接受肺叶切除术,148[27%]例接受肺段切除术)。
解读
据我们了解,这项研究是第一个显示了肺段切除术相较于肺叶切除术在小周围型非小细胞肺癌患者总生存中优势的3期试验。研究结果表明,肺段切除术应该成为这类患者的标准手术术式。
【研究背景】
研究前的证据
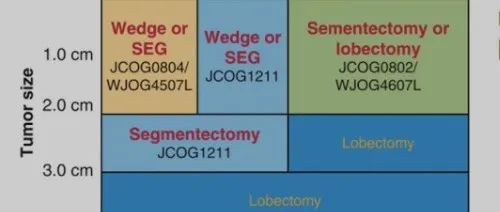
我们在PubMed上对1995年1月1日至2021年7月31日发表的关于早期非小细胞肺癌(NSCLC)亚肺叶切除术的随机对照试验的英文文献进行了检索。我们使用了“randomized controlled trial(随机对照试验)”,“early stage(早期)”,“sublobar resection(亚肺叶切除术)”,和“lung cancer(肺癌)”这些检索词。另外,我们还搜索了American Society of Clinical Oncology(美国临床肿瘤学会),World Conference on Lung Cancer(世界肺癌会议)以及European Society of Medical Oncology(欧洲肿瘤医学学会)的会议摘要。确认两项已发表的针对早期NSCLC患者亚肺叶切除比较肺叶切除的研究(一项发表于1995年,另一项CALGB140503: NCT 00499330刚刚完成,将于2024年结束)和另外两项囊括了老年患者和有较弱呼吸功能患者的试验。迄今为止,只有一项随机对照试验(LCSG821)比较了肺叶切除和亚肺叶切除对IA期肺癌(最大肿瘤直径≤3cm,无淋巴结转移)患者的总生存率,该研究由肺癌研究组(Lung Cancer Study Group)(1995)报道。基于肺段切除较高的死亡率和3倍的局部复发率,肺叶切除术已成为标准手术模式,即使是早期NSCLC。亚肺叶切除术在早期肺癌病例中的应用仅限于肺储备不足或患有严重合并症而禁忌做肺叶切除术的患者。随着90年代末日本计算机断层扫描筛查的增加,小尺寸早期肺肿瘤的早期检出率也有所提升。 日本临床肿瘤小组,特别是日本临床肿瘤小组和西部日本肿瘤小组,进行了三项前瞻性多中心研究,以探讨早期NSCLC的最佳手术方式。JCOG0802/WJOG4607L是一项随机、对照、非劣效性试验,比较肺段切除术和肺叶切除术对放射学侵袭性肺癌的疗效,而JCOG0804/WJOG4507L和JCOG1211是两项非随机验证试验,研究亚肺叶切除术治疗放射学非侵袭性肺癌的临床疗效。
本研究的附加价值
据我们所知,JCOG0802/WJOG4607L是第一个显示早期肺癌肺段切除术在总生存率上优于肺叶切除术的随机试验。 本研究结果提示,对于临床分期为IA、小尺寸(≤2cm,实性成分占比>0.5)的周围型非小细胞肺癌,应采用肺段切除术而非肺叶切除术作为标准手术方式。
现有证据的提示
虽然肺癌是一种高度恶性的疾病,但根据我们的结果,临床分期为IA、小尺寸周围型NSCLC的患者,接受根治性手术,包括肺叶或肺段切除术,可以期望90%或更高的5年总生存率。本研究两组间生存结局及死亡原因的差异与原发NSCLC无关,是由于第二原发癌或其他疾病,包括呼吸系统疾病或脑血管疾病。与肺段切除术相比,肺叶切除术对小尺寸周围型早期NSCLC患者的伤害性(从长期生存情况判断)似乎比以前认为的更强。CALGB140503是一项与我们的研究类似的大型多中心随机试验,其最终结果将于2024年公布。CALGB140503的目的是验证周围型NSCLC(≤2cm)的亚肺叶切除(楔形切除或肺段切除)的无病生存期与肺叶切除相当。本试验将提供有效的信息,佐证我们的结论。
引言
肺癌是全球癌症相关死亡的主要原因,并且在过去的二十年中其发病率有所增加。1自1960年以来,手术切除一直是早期肺癌治疗的金标准,肺叶切除术则是标准手术模式。2至今仅有一项随机对照试验比较了IA期肺癌患者接受肺叶切除和亚肺叶切除的总生存(1995年)。3鉴于其较高死亡率和三倍的局部复发风险,早期肺癌的亚肺叶切除仅适用于肺储备较差或其他禁忌肺叶切除术的严重合并症患者。随着 CT 筛查频率的增加和包括薄层 CT 在内的诊断方式的进步,小尺寸或磨玻璃密度肺肿瘤的早期检出率有所提高。因此,亚肺叶切除术的实际适应症已扩展到早期肺癌。4如果发现小尺寸周围型肿瘤且未检测到淋巴结受累,则亚肺叶切除术可以用于符合肺叶切除术条件的患者。5然而,据我们所知,与肺叶切除术相比,亚肺叶切除术的获益尚未在随机对照试验中得到证实。
据报道,术前磨玻璃密度的放射学表现可以较好地提示预后。6为选择放射学上非侵袭性,且病理学上无淋巴结侵犯或淋巴血管侵犯的肺癌,日本临床肿瘤学组(JCOG)进行了一项观察性研究(JCOG0201),探究早期非小细胞肺癌的放射学发现与预后之间的关系。7该研究将放射学非侵袭性肺癌定义为最大肿瘤直径2厘米,实变成分比例为0.25或更小,但由于发现磨玻璃成分与良好的预后密切相关,该比例随后改为0.5或更小。8亚肺叶切除术包括肺段切除术和楔形切除术,这两种手术的手术强度差别很大。肺段切除是一种有足够切缘和淋巴结评估的解剖性切除,术中可以评估切缘阳性和淋巴结转移。因此肺段切除术,从肿瘤学的根治性强度来看可考虑作为肺叶切除术的替代方案;而在术后呼吸功能保存方面则与楔形切除术相当。9,10
鉴于JCOG0201的结果和亚肺叶切除术的具体特点,JCOG和WJOG进行了三项前瞻性多机构研究(附录p1),以探讨早期NSCLC的最佳手术方式(JCOG0802/WJOG4607L、11 JCOG1211、12和JCOG0804/WJOG4507L13)。JCOG0802/WJOG4607L是一项随机、对照、非劣效性研究,比较了肺段切除术和肺叶切除术对放射学侵袭性肺癌的疗效,而JCOG0804/WJOG4507L和JCOG1211是放射非侵袭性肺癌的非随机验证试验。证实这三项研究的假设,可以确立早期NSCLC的标准手术模式。
本研究(JCOG0802/WJOG4607L)是三项研究的重要组成部分,旨在确认肺段切除术(实验组)与肺叶切除术(标准组)在小周围型NSCLC(≤2 cm;实性成分占比>0.5)患者中具有总生存率的非劣效性。
方法
研究设计与研究人群
JCOG0802/WJOG4607L 是一项多中心和组间随机、开放标签、3 期、随机对照试验,在日本70家机构开展(附录17-18),旨在支持肺段切除术相比标准治疗,即肺叶切除术在临床IA期小尺寸(≤2cm;实性成分占比>0.5)周围型NSCLC患者总生存上的非劣效性。这项研究是根据赫尔辛基宣言和日本临床研究伦理指南进行的。该研究方案得到了JCOG和WJOG方案审查委员会以及所有参与医院的机构审查委员会的批准。所有患者在入组前都提供了书面知情同意书。试验的全部细节之前已发表,11试验方案见附录 (p2)。
研究人群包括年龄在20-85岁之间、东部肿瘤协作组表现评分为0或1、原发、小尺寸、浸润性周围型非小细胞肺癌(直径≤2 cm;实性成分占比>0.5;位于外三分之一的肺实质),经薄层CT证实为临床IA期的符合条件的患者。入组时,根据第7版TNM恶性肿瘤分类确定分期。 14 采用两步登记,因为需在术中通过肿瘤的复杂组织学诊断以确定符合放射学标准。
首次登记时的纳入标准包括年龄为20-85岁、东部肿瘤协作组的表现评分为0或1,以及肿瘤被认为是临床可切除的N0期NSCLC可疑病变。患者在首次登记前的56天内接受过胸部增强CT检查。胸部增强CT需满足以下条件:单发肿瘤,疑似非小细胞肺癌,肿瘤中心位于肺野外三分之一,肿瘤不位于中叶无明显的淋巴结转移。薄层CT是强制性的,且必须满足两个条件:最大肿瘤直径为2 cm,肿瘤的实变与肿瘤比为0.5或更高。根据之前 JCOG0201的结果,在入组开始4年后对该方案进行了修订,将标准从0.25或更高的实性成分占比更改为0.5或更高,因为JCOG0201中最大肿瘤直径为3 cm且实性成分占比为0.5 或更小的这部分患者的无复发生存率已被证明足够好(5年无复发生存率为95.9%)。15,16 符合条件的患者必须没有同侧开胸史,既往无任何恶性疾病的化疗或放疗,预期术后1秒用力呼气量(FEV1)为800 mL或更多,以及动脉氧分压达到65。入组需要足够的器官功能和书面知情同意书。术前首次登记时符合以下任一标准的患者被排除:(1)活动性细菌或真菌感染;(2)当前或过去5年内罹患两种癌症;(3)妊娠或哺乳期的妇女;(4)间质性肺炎、肺纤维化或严重肺气肿;(5)精神病;(6)全身性甾体药物;(7)无法控制的糖尿病;(8)无法控制的高血压;(9)有严重心脏病史。术中第二次登记的要求是在初次登记后28天内进行手术,组织学证实为NSCLC,无恶性胸腔积液或胸膜播散,无淋巴结受累,以及进行肺叶切除术、肺段切除术或淋巴结清扫术的技术可行性。
随机化与隐藏
在确认资格标准后,首次登记通过JCOG内机构向JCOG数据中心电联或传真,或通过WJOG内机构向WJOG数据中心发送传真进行。在确认第二次登记的资格标准后,从JCOG中的机构电联JCOG数据中心,或从WJOG中的机构电联WJOG数据中心。JCOG和WJOG使用最小化随机,将符合条件的患者随机分到肺段切除组和肺叶切除组(1:1)。根据机构、组织学类型(腺癌或其他)、性别、年龄(<70岁或以下)以及薄层CT表现(实性成分占比=1或否)进行组间平衡。没有对研究人员或患者进行治疗分配的隐藏。
程序
按先前描述的程序进行手术。11,17 在肺叶切除组,进行了肺叶切除术及肺门和纵隔淋巴结清扫。不允许切除一个以上的肺叶。如果手术切缘小于最大肿瘤直径或小于20mm,则必须进行冷冻病理诊断或细胞学检查,以确认切缘没有肿瘤细胞,然后再关闭胸腔。如果切缘呈阳性,则必须进行额外的切除。在肺段切除组,肺段切除术,定义为一个肺段切除或双肺段切除(一个节段加上相邻节段),并进行肺门和纵隔淋巴结清扫。因此,左肺三肺段切除术(S1+S2加S3)被认为是双肺段切除术,但由于保留的肺实质较少,本试验不允许进行基底段切除术,即切除下叶除S6以外的所有肺段。根据外科医生的习惯,通过缝合、能量装置或两者的组合来进行段间平面的解剖。肺段组以同样的方式评价手术切缘。
在两组中,系统性或选择性淋巴结清扫术18、19 是强制性的,并且不允许淋巴结取样。建议对纵隔淋巴结进行系统性解剖,但也接受选择性解剖。每当在手术过程中肉眼发现淋巴结转移时,必须对这些淋巴结进行冰冻切片诊断,如果发现肿瘤细胞,则需要改变手术方式才能完全切除。
如果证实有淋巴结转移或手术切缘阳性,则手术程序从肺段切除术转变为肺叶切除术。方案的完成定义为R0切除。视频辅助程序的定义取决于机构。我们对视频辅助手术的定义是灵活的,因此视频辅助小切口开胸术被归类为视频辅助胸外科手术。所有手术均由日本胸外科协会或同等资质认证的普胸外科医生主刀或担任第一助手。
对病理分期IB和病理分期II或IIIA的患者分别推荐使用替加氟尿嘧啶和顺铂+长春瑞滨进行术后辅助化疗。所有患者至少随访5年。前2年至少每6个月进行一次肿瘤标志物、胸部X线和增强胸部CT的检查,以后的随访期间至少每12个月进行一次。
结局
主要终点为总生存率,次要终点为术后呼吸功能(6个月和12个月)、无复发生存率、局部复发率、不良事件、肺段切除完成比例、住院时间、胸腔引流时间、手术时长、失血量和使用的切割闭合器的数量。总生存期定义为从随机化到因任何原因死亡的天数。无复发生存期定义为从随机分组到复发或因任何原因死亡的天数,该结果在患者存活的最后一天进行审查。局部复发定义为同侧胸部肿瘤复发,包括肺或支气管切除边缘、肺门淋巴结、纵隔淋巴结和恶性胸腔积液。评估基线与术后6个月和12个月时呼吸功能的差异。在该试验中,临床预计肺段切除组取得组间中位FEV1降低的差异界值为10%。术后早期并发症定义为术后30天内发生的并发症。使用不良事件通用术语标准3.0版评估并发症。疗效分析基于意向性治疗。仅在接受肺部手术的患者中进行安全性分析,例如不良事件。关于不良事件、肺段切除术完成比例、住院时间、引流时间、手术时长、失血量和使用的切割闭合器的数量等结果已经在之前报道。17
统计分析
为了计算样本量,假设两组的5年总生存率为90%,肺段切除组5年总生存率的非劣效性界值为85%(对应HR=1.54)。确认非劣效性所需的样本量为1030(预期总死亡人数为131),功效为80%,单边显著性水平为0.05,入组时间为3年,随后延长为5年。考虑到失访,计划的总样本量设定为1100名患者。在计划的一半患者入组后和入组完成后进行了两项预先计划的中期分析。为了将研究保留在5%单边显著性水平,我们使用了基于O’Brien-Fleming 方法的LanDeMets alpha-spending功能。
该试验旨在表明肺段切除术在总生存率方面并不逊于肺叶切除术。因此,我们希望在方案预先指定的四个判定标准中得出其中一个,这些标准涉及到总生存率、主要终点和呼吸功能的相关性,以及在侵袭性方面的关键次要终点。(附录第38页)。
首先,如果肺段切除术不劣于肺叶切除术并且在主要终点具有统计学意义,我们可以得出结论,肺段切除术应该是新的标准治疗。如果通过分层Cox比例风险模型估计的HR多重调整的CI上限小于1,则确认其优越性。其次,如果肺段切除术在主要终点方面不劣于肺叶切除术但不优于肺叶切除术,并且在术后1年肺段切除术在术后呼吸功能方面优于肺叶切除术,即组间FEV1降低的中位数差异超过10%,我们可以得出结论,肺段切除术应该是新的标准治疗。然而,在对其他终点进行全面审查的基础上,我们将确定肺叶切除术是否可以继续作为标准治疗之一。第三,如果肺段切除术在主要终点方面不劣于但不优于肺叶切除术且有统计学意义,并且在术后1年肺段切除术在术后呼吸功能方面不优于肺叶切除术,我们会得出结论,肺叶切除术仍应作为标准治疗。然而,在对其他终点进行全面审查的基础上,我们将确定是否可以将肺段切除术视为标准治疗之一。第四,如果肺段切除术在主要终点和其他终点方面不劣于肺叶切除术,也不优于肺叶切除术,我们会得出结论,肺叶切除术仍应是标准治疗。
根据研究者的评估,使用Cox比例风险模型对总生存率进行预先指定的亚组分析,该模型包括试验方案、亚组和按亚组治疗的交互项。死亡人数少于20人的亚组类别被排除在分析之外。
使用Kaplan-Meier方法估计总生存率和无复发生存期。对于主要分析,由于事件数量少,在总体生存率方面随机化(组织学类型[腺癌或其他]和性别)使用了具有两个分层因素的分层Cox回归模型。使用Fisher精确检验比较率。Wilcoxon 秩和检验用于比较术后6个月和12个月的呼吸功能。为主要分析计算单侧p值,而所有其他分析都是双侧的。所有统计分析均使用SAS(9.4版)进行。
结果
在2009年8月10日至2014年10月21日期间,来自日本70个机构的1319名患者(JCOG,n=44;WJOG,n=26;图1)注册了该研究。在这些患者中,1106名患者在第二次登记时被随机分配接受肺叶切除术(n=554)或肺段切除术(n=552)。213名患者在第二次登记时被排除,主要原因是术中冰冻切片诊断为非恶性疾病,其次是组织学无法明确,开胸后发现肺门或纵隔淋巴结受累,以及严重的胸膜粘连或不完整的分叶。两组的基线特征平衡良好(表1)。在1106名入组患者中,男性583例(52.7%),70岁以上患者422例(38.2%),腺癌968例(87.5%),923例(83.5%)患者患有病理IA期疾病(第七版TNM分期)。中位肿瘤直径为1.6 cm(范围0.6-2.0),553名(50.0%)患者的实性成分占比为1.0。在淋巴结病理方面,1038例(93.9%)患者的癌症为病理淋巴结(pN)0期,33例(3.0%)为pN1,32例(3.0%)为pN2。完全切除评分,1099例(99.4%)患者为R0,3例患者为R1(0.3%),2例患者为R2(0.2%)。R2 患者因肉眼无法切除的肿瘤而被排除在外,因为在显微镜下无法切除的肿瘤并不总是导致手术后复发,所以R1患者被纳入本试验。在肺段切除组中,22例患者转为肺叶切除术,原因是16例患者在随机分组后发现肺门或纵隔淋巴结转移,4例患者手术切缘不足,1例患者在术中发现同一肺叶肺内转移,以及1例患者在技术上难以进行肺段切除术。此外,1例患者因严重粘连和肺纤维化而接受了宽楔形切除术。3例患者因手术切缘阳性或不足、病理性切除不全而再次手术;1例患者由于肿瘤的微乳头扩张而手术切缘阳性,还有2例患者根据永久性病理诊断手术切缘阴性但距离不足(<2cm)。
在辅助治疗方面,肺叶切除组39例患者接受替加氟-尿嘧啶,11例患者接受顺铂+长春瑞滨,17例患者接受其他辅助治疗。在肺段切除组中,22例患者接受了替加氟-尿嘧啶,13例患者接受了顺铂联合+长春瑞滨,12例患者接受了其他辅助治疗。
即刻的不良事件——手术后30天内发生的并发症——先前已经报道。17发生在6例 (1%) 接受肺叶切除术的患者和9例 (2%)肺段切除术的患者。17未观察到30天或90天死亡。两组中发生2级或更严重的一种或多种术后并发症的发生率相似:肺叶切除组142例(26%)患者,肺段切除组148例(27%)患者。17我们之前报道了复杂肺段切除术的定义17。多变量分析表明,肺部并发症,包括漏气和脓胸(≥2级)的预测因素,为复杂的肺段切除术(vs 肺叶切除术;OR 2.07, 95 % CI 1.11–3.88;p=0.023)和20年及以上的吸烟史(2.61, 1.14–5.97;p=0.023)。17两个或更多的段间平面使肺段切除术在技术上比肺叶切除术更困难,即使对于经过认证的胸外科医生也是如此。
图2显示了所有随机分配患者的总生存率和无复发生存率。中位随访7.3年(范围 0.0-10.9)。5年总生存率,肺叶切除组91.1%(95%CI,88.4%−93.2%),肺段切除组为94.3%(95%CI,92.1%-96.0%)(HR0.663;95%CI,0.474–0.927;非劣性单侧p<0.0001;优效性p=0.0082)。肺叶切除术的5年无复发生存率为87.9% (95% CI 84.8−90.3),肺段切除术的5 年无复发生存率为88.0% (95% CI 85.0−90.4) (HR 0.998, 95% CI 0.753−1.323)。在所有预定义的亚组中始终观察到肺叶切除的总生存率得到改善,特别是在男性患者、年龄在70岁及以上、实性肿瘤和非腺癌(图三)。我们使用符合方案和治疗后敏感性分析证实了总生存率和无复发生存期的结果(附录3-6)。
第一次复发的局部和远处位置列于附录(7-8)。接受肺段切除术的患者(n=58.11%)的局部复发率明显高于接受肺叶切除术的患者(n=30.5%;p=0.0018);然而,在肺段切除术和肺叶切除术组中,总体复发模式,包括远处复发的患者以及远处和局部同时复发的患者,是相似的。
表2总结了入组患者的死因。与肺段切除组相比,肺叶切除组死于其他疾病的患者略多。此外,接受肺叶切除术的患者(n=31.6%)比接受肺段切除术的患者(n=12. 2%)更常出现其他癌症相关死亡,包括第二原发性肺癌。此外,肺叶切除组死于呼吸或脑血管原因的患者人数略高于肺段切除组。但出现二次癌症的几率在两组中是相似的(肺叶切除组88例 [15.9%] vs 肺段切除组84例[15.2%])。在二次癌症中,肺叶切除组和肺段切除组第二原发性肺癌的发病率分别为36比43,其他癌症为70比69。原位癌的发生率也相似(附录9-10页)。
在复发患者中,肺叶切除组37例患者中有18例(49%)在5年的随访中存活(范围0.3-9.0;然而,在肺段切除组中,51例中有35例(68%)患者在同一时间点存活(中位复发时间分别为2.5年和2.7年(范围0.0-9.2)。肺叶切除组复发的80%(44例中的35例)接受了彻底治疗,而在肺段切除组,93%(67例中的62例)复发的患者接受了彻底治疗,包括13例再次手术,13例接受放疗,32例接受化疗,以及4例接受放化疗。关于第二原发性肺癌,肺段切除组36例中的32例(89%)进行了额外的切除,而肺叶切除组30例中有19名(63%)进行了切除(附录11 –12页)。
FEV1的中位降低在6个月时为10.4%(范围为4.7-16.6),在12个月时为8.5%(3.5-14.8)(p<0.0001),肺叶切除术在6个月时为13.1% (7.0–20.5),在12个月时为12.0% (5.6–18.8)(p<0.0001;附录13–14页)。
肺段切除术组相比肺叶切除术组的中位FEV1降低比例差值在6个月和12个月时分别为2.7%和3.5%,在1年的随访中未达到设定的10%具有临床意义的阈值。
讨论
我们的研究显示,就总生存而言,肺段切除术非劣且优于肺叶切除术。因此,根据我们预先设定的判定标准,我们认为对于小尺寸(≤2cm,实性成分占比>0.5)周围型NSCLC,应采用肺段切除术而不是肺叶切除术, 尽管我们没有发现肺段切除术组在术后呼吸功能方面有预期的优势。在所有预先确定的亚组中,肺段切除术与肺叶切除术在总生存方面的优势是一致的。 然而,局部复发在肺段切除术组中发生的频率更高,但在总体无复发生存率方面没有显著差异。这个结果有些出人意料。 其他癌症(包括第二原发性肺癌)、呼吸系统疾病和脑血管疾病的死亡,在肺叶切除术组比在肺段切除术组发生得更多。相比之下,两组中二次癌症和第二原发肺癌的发病率相似,原位癌的发病率也相似。 我们还评估了合并症的类型。入组时,两组患者的合并症,包括呼吸系统、脑血管和心血管疾病,均无显著差异。 在肺叶切除术组中,其他器官的癌症和呼吸、脑血管疾病导致了更多的死亡人数。
局部复发增加了两倍,可能是由于肺段切除术组切除范围较小,但在5年随访中,该组患者比肺叶切除术组生存率更高。 我们发现,与肺叶切除术相比,肺段切除术后患者更频繁地进行了额外的强化切除以及对复发或第二原发性肺癌的治疗。 我们推测,比肺叶切除术保留了更多肺实质的肺段切除术可能不仅有助于进一步治疗原发性肺癌的复发和第二原发肺癌,而且或许有助于进一步治疗可能存在的其他癌症和致命疾病。这些数据不能直接说明肺叶切除术组死亡人数的增加是出于非恶性原因,包括呼吸系统疾病和脑血管疾病。
如果胸外科医生选择亚肺叶切除术,术中淋巴结评估和确定合适的手术切缘都是至关重要的,即使在早期肺癌中也是如此。虽然因淋巴结转移、手术切缘不足等原因有22例肺段切除术转为肺叶切除术,但在肺段切除术组内仍有11例手术切缘、2例支气管残端出现局部复发。此外,在第一次复发时,同侧或对侧纵隔淋巴结复发在肺段切除术组比在肺叶切除术组更常见。因此,对每个病例的放射学和病理学结果以及手术程序需要进行更详细的分析,以把握如何明智地选择患者和理解如何改进肺段切除术。
本研究存在一定的局限性。对混杂的第二原发癌的治疗强度进行详细评估是不可行的; 这样的评估十分复杂。 由于本研究为非盲法试验,可能存在不可避免的偏倚; 然而,所使用的结果可以得到客观的评估。此外,肺段切除术与肺叶切除术相比,生存率提高的原因仍然需要进一步澄清。虽然肺癌是一种高度恶性的疾病,但根据我们的结果,临床IA期的小尺寸周围型NSCLC患者,如果接受根治性手术,包括肺叶或肺段切除术,其5年总生存率可达90%或更高。本研究中两组患者的生存结局和死亡原因的差异与原发性NSCLC无关,而是由于第二原发癌或其他疾病。与肺段切除术相比,肺叶切除术对小尺寸周围期早期NSCLC患者的损伤(从长期生存情况判断)似乎比以前认为的更强。胸外科医生不仅要追求根治性的治疗目的,而且要寻求损伤最小的手术方式,并为未来可能发生的危及生命的疾病,如第二原发癌、呼吸系统疾病或脑血管疾病,保留进一步治疗的可能性。我们相信,关注治疗方法的这些方面将为所有早期肺癌患者带来长期生存益处。
据我们所知,JCOG0802/WJOG4607L是第一个也是唯一一个显示早期肺癌的肺段切除术在总生存率上优于肺叶切除术的随机试验。 这些结果表明,对于小尺寸周围型非小细胞肺癌患者,肺段切除术应该作为标准的手术术式。

Fig.1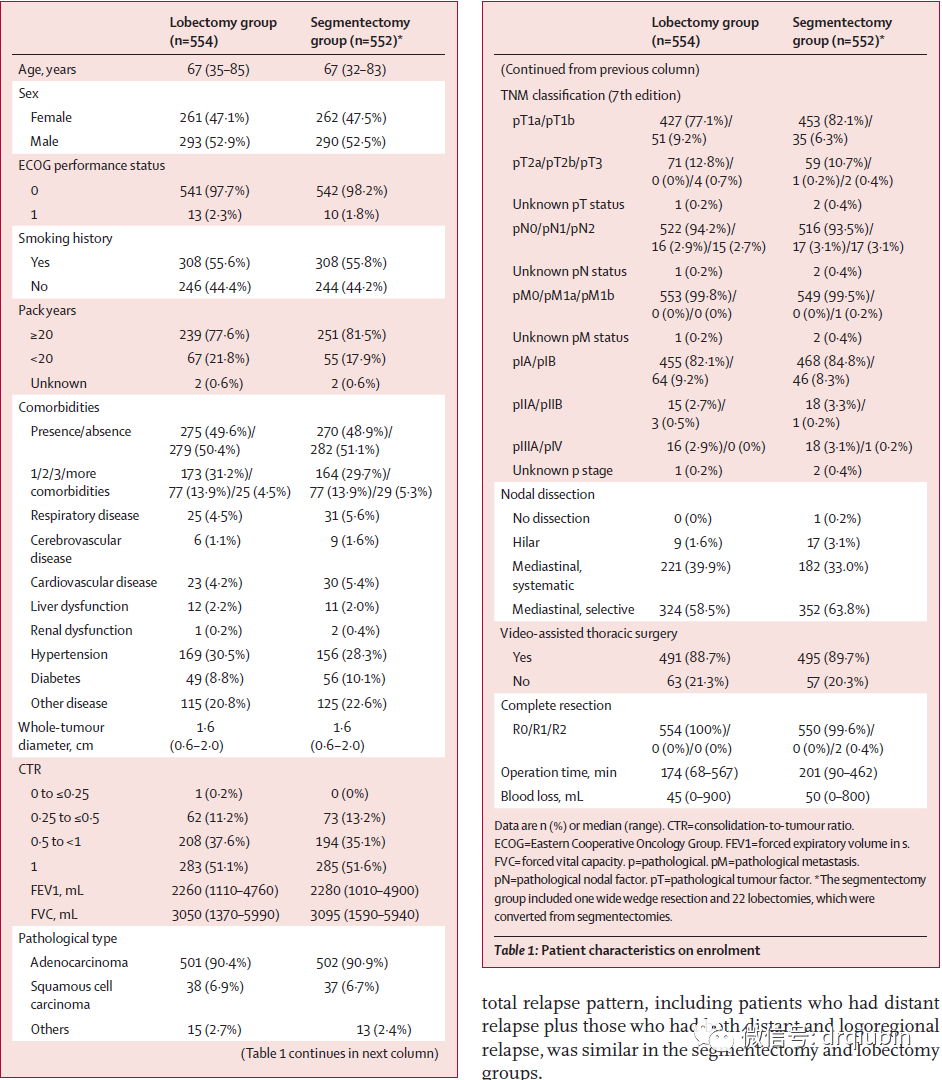
Table.1
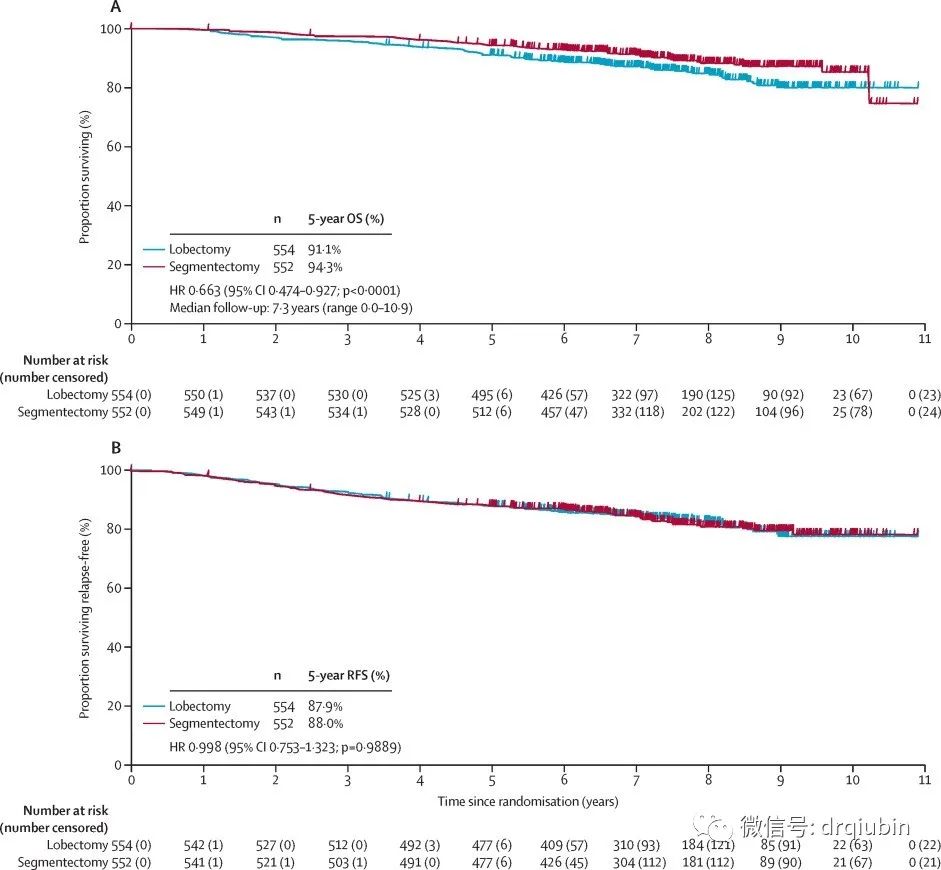
Fig.2

Fig.3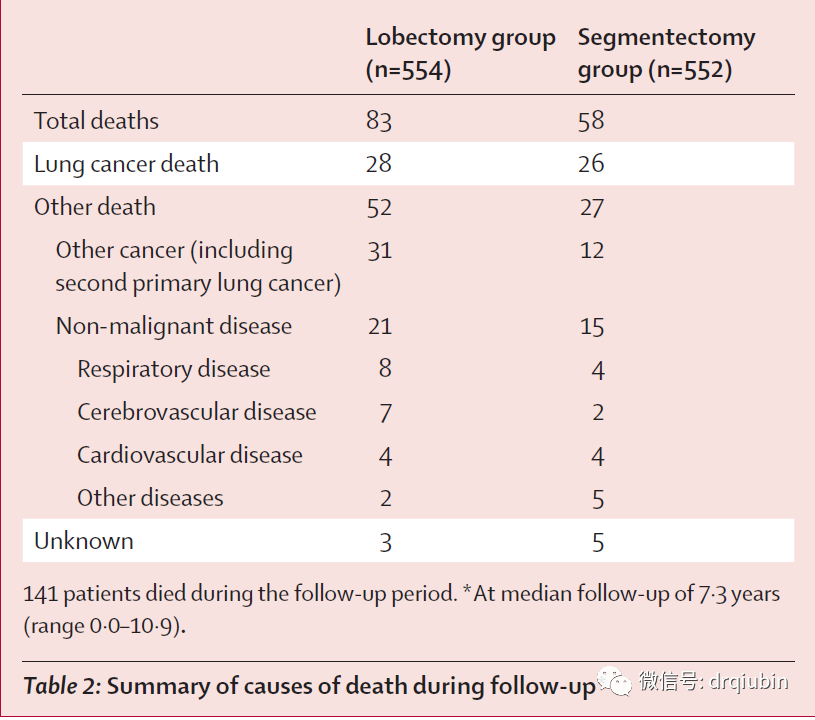
Table.2
原文链接:http://www.xxwk.net/archives/2309