文献来源:Dammeijer, Floris, et al. "The PD-1/PD-L1-checkpoint restrains T cell immunity in tumor-draining lymph nodes." Cancer cell (2020): 685-700. PMID: 33007259.


摘要 本研究中,Joachim G. Aerts教授团队中首先发现肿瘤引流淋巴结(TDLNs)富含与PD-L1+ cDC紧密相关的肿瘤特异性PD-1+ T细胞。靶向TDLN阻断PD-L1可在肿瘤部位播种祖细胞耗竭的T细胞(progenitor-exausted T cells),以增强抗肿瘤的T细胞免疫。进一步纳入临床非转移性黑色素瘤患者验证发现,仅TDLNs存在大量PD-1/PD-L1相互作用,而其对应的原发肿瘤则无此现象,且PD-1/PD-L1相互作用密度与早期远处疾病复发相关。这项研究揭示了TDLNs中PD-L1的表达在控制全身抗肿瘤免疫中的关键作用,并挑战了当前的PD-1/PD-L1检查点免疫治疗的传统认识,即PD-1/PD-L1免疫抑制剂主要在效应物(肿瘤)部位起作用;该项研究有望为生物标志物筛选和联合免疫疗法提供其他途径。
本研究中,Joachim G. Aerts教授团队中首先发现肿瘤引流淋巴结(TDLNs)富含与PD-L1+ cDC紧密相关的肿瘤特异性PD-1+ T细胞。靶向TDLN阻断PD-L1可在肿瘤部位播种祖细胞耗竭的T细胞(progenitor-exausted T cells),以增强抗肿瘤的T细胞免疫。进一步纳入临床非转移性黑色素瘤患者验证发现,仅TDLNs存在大量PD-1/PD-L1相互作用,而其对应的原发肿瘤则无此现象,且PD-1/PD-L1相互作用密度与早期远处疾病复发相关。这项研究揭示了TDLNs中PD-L1的表达在控制全身抗肿瘤免疫中的关键作用,并挑战了当前的PD-1/PD-L1检查点免疫治疗的传统认识,即PD-1/PD-L1免疫抑制剂主要在效应物(肿瘤)部位起作用;该项研究有望为生物标志物筛选和联合免疫疗法提供其他途径。 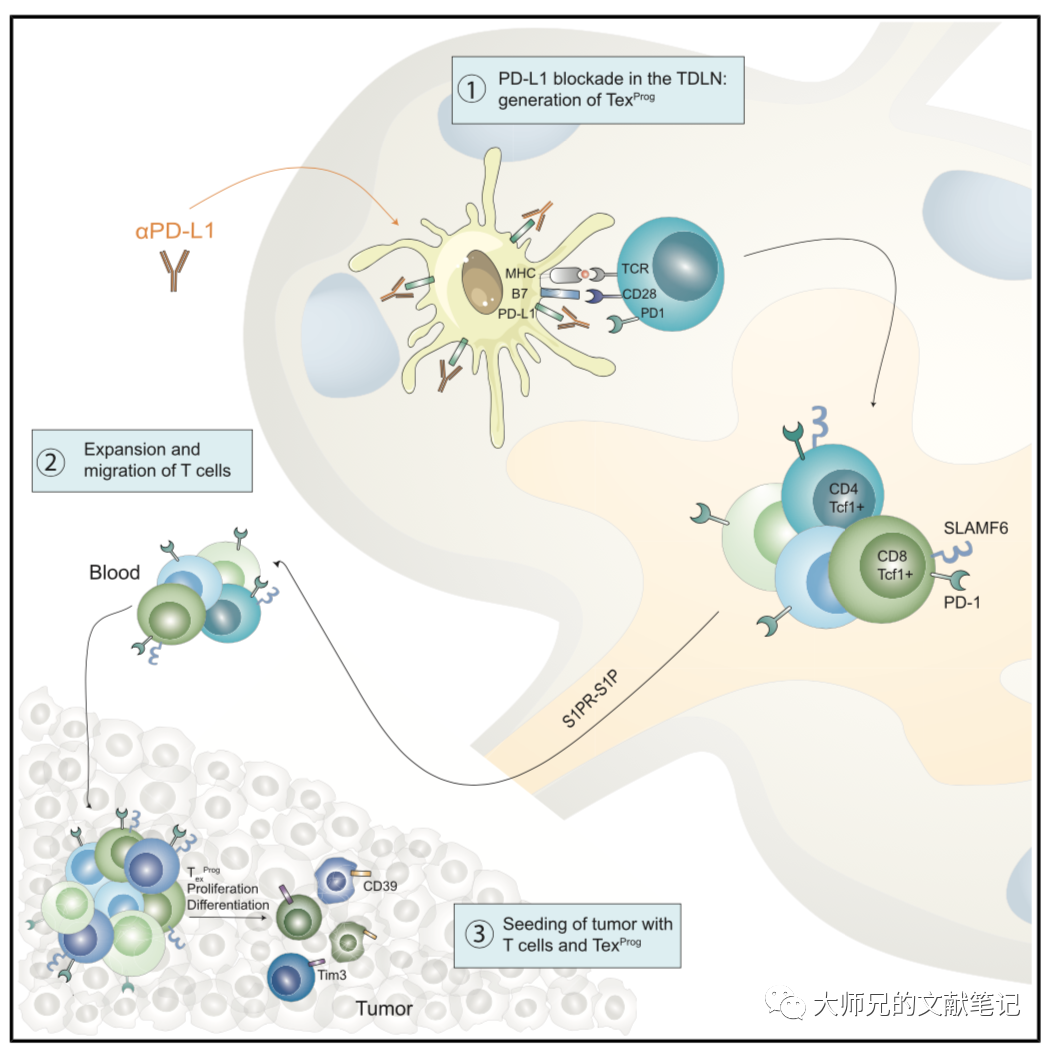

研究背景 科学问题:PD-1/PD-L1免疫阻断剂能重新激活耗竭的T细胞发挥肿瘤免疫,但仍有多数患者或肿瘤类型对其不反应或短暂反应,因此,全面探索抗PD-1/PD-L1治疗的时空机制(不同时间、不同效应器官的治疗效果)具有重要研究意义。 逻辑基础:(1)PD-1通过抑制髓样细胞CD28共刺激受体下游的B7段发挥作用;(2)免疫检查点抑制剂(ICB)治疗的肿瘤中出现了新的、以往不存在的T细胞受体克隆型,且肿瘤驻留T细胞在治疗后增殖能力有限;(3)新发现一种表达T细胞因子1(TCF-1)的祖细胞耗竭的T细胞能够产生效应T细胞后代,但其确切来源仍未知。
科学问题:PD-1/PD-L1免疫阻断剂能重新激活耗竭的T细胞发挥肿瘤免疫,但仍有多数患者或肿瘤类型对其不反应或短暂反应,因此,全面探索抗PD-1/PD-L1治疗的时空机制(不同时间、不同效应器官的治疗效果)具有重要研究意义。 逻辑基础:(1)PD-1通过抑制髓样细胞CD28共刺激受体下游的B7段发挥作用;(2)免疫检查点抑制剂(ICB)治疗的肿瘤中出现了新的、以往不存在的T细胞受体克隆型,且肿瘤驻留T细胞在治疗后增殖能力有限;(3)新发现一种表达T细胞因子1(TCF-1)的祖细胞耗竭的T细胞能够产生效应T细胞后代,但其确切来源仍未知。
科学假说:髓样细胞同样表达PD-L1,且大量的B7表达抗原呈递细胞暴露于引流性肿瘤抗原,促使作者进一步研究肿瘤引流淋巴结(TDLN)在多种临床前肿瘤小鼠模型中抗PD-L1治疗中的作用。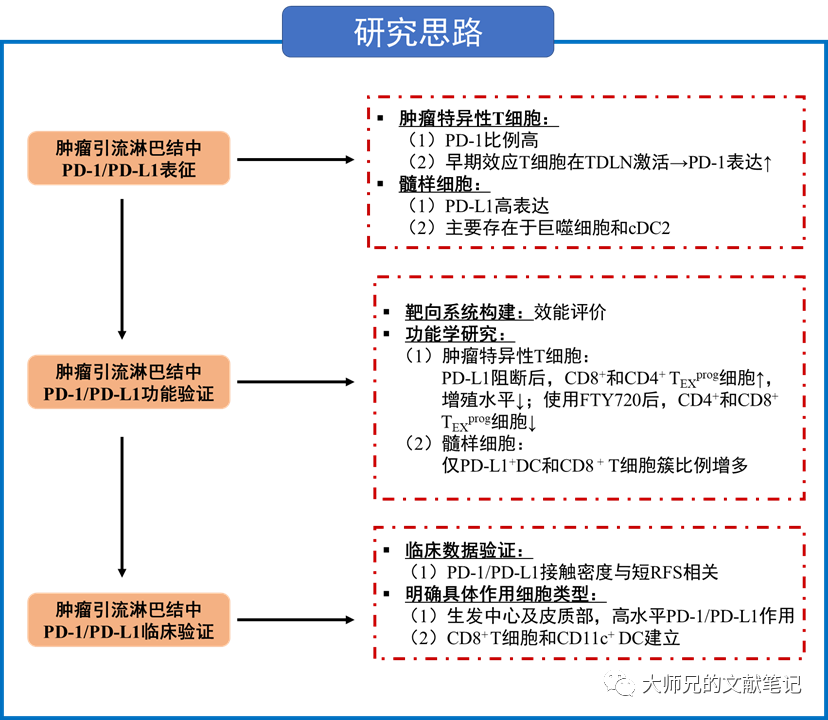

结果解读 1. TDLN富含PD-1+肿瘤特异T细胞和PD-L1高表达的髓样细胞
1. TDLN富含PD-1+肿瘤特异T细胞和PD-L1高表达的髓样细胞
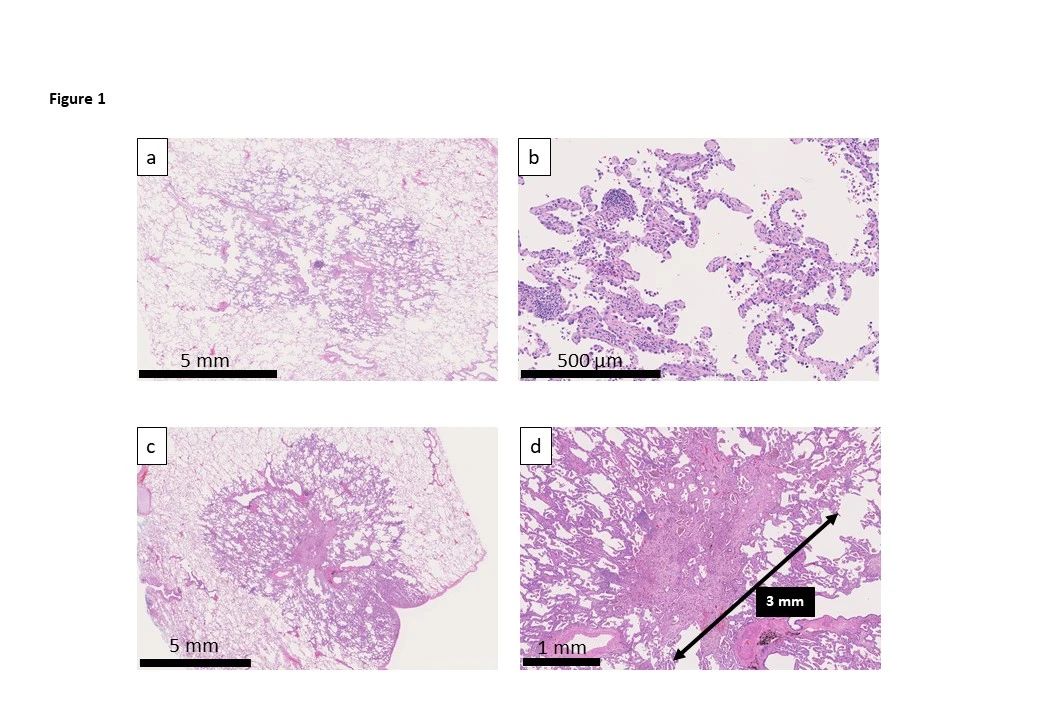
作者首先在肿瘤引流淋巴结中发现高水平的肿瘤特异性CD8+ T细胞以及PD-1+ CD8+ T细胞,这主要是由于T细胞最早先归巢到肿瘤引流淋巴结,随之上调PD-1。而肿瘤引流淋巴结的髓样细胞,如CD169+被膜下窦巨噬细胞(SSM)和常规树突状细胞(cDC),高表达PD-L1。 2. TDLN特异的PD-L1抗体引发抗肿瘤T细胞免疫(anti-tumor T-cell immunity)和肿瘤控制(tumor control)
2. TDLN特异的PD-L1抗体引发抗肿瘤T细胞免疫(anti-tumor T-cell immunity)和肿瘤控制(tumor control)
作者建立了能选择性PD-L1抗体靶向肿瘤引流淋巴结的系统,并对AC29间皮瘤和MC38结肠癌进行靶向肿瘤引流淋巴结和全身的PD-L1治疗,两者均可降低肿瘤负担(tumor burden)并增加生存率。更关键的是,作者随后鉴定出具有干细胞样表型的肿瘤浸润T细胞(tumor-infiltrating T cell,TIL),称TEXprog(特征:SLAMF6+)。FTY720(阻止外周T细胞流入)干预后CD4+ 辅助性T细胞(T helper cell,Th)和CD8+ TIL减少(包括TEXprog细胞),而PD-1表达的T细胞增多。表明阻断PD-L1能增强肿瘤引流淋巴结对T细胞(包括TEXprog)的启动和激活作用。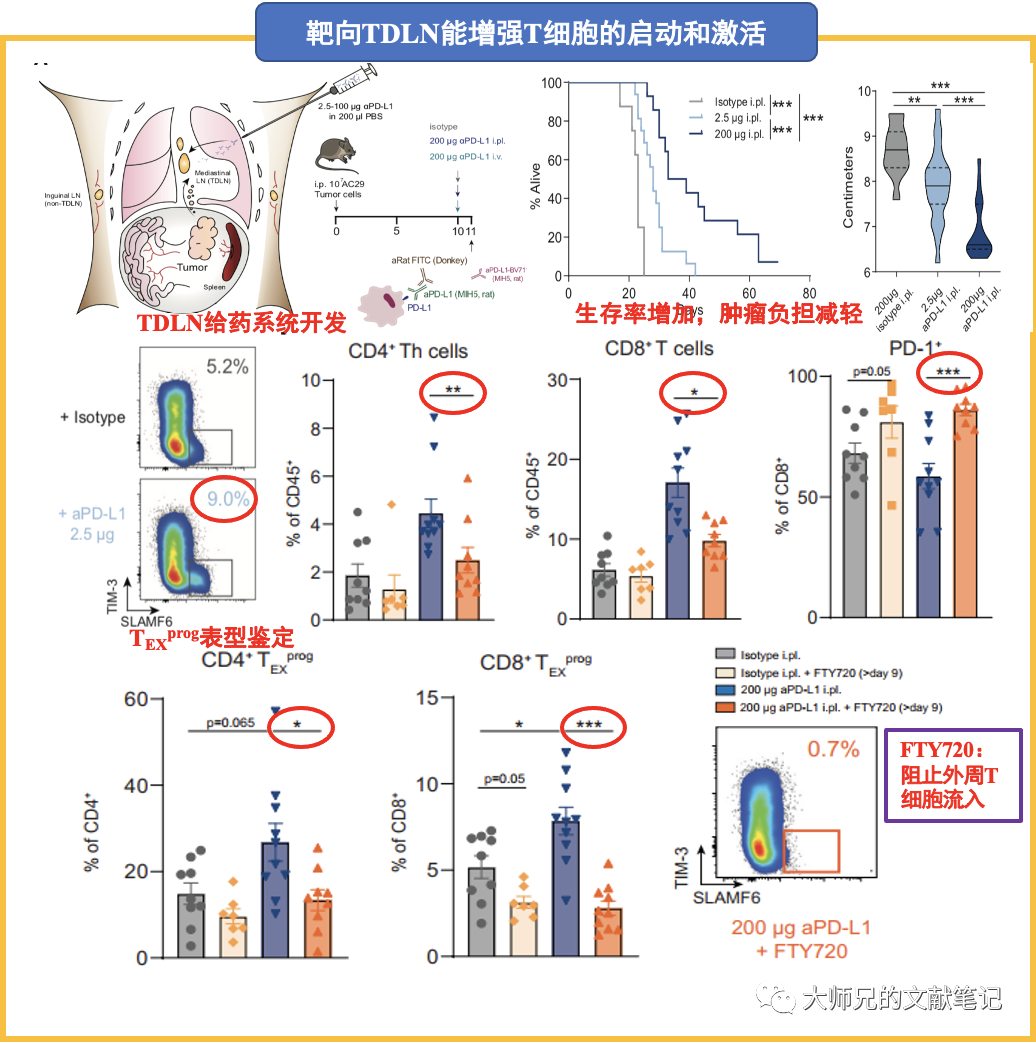
3. 对PD-L1抑制剂的反应独立于TDLN巨噬细胞
作者使用了低剂量腹腔内注射氯膦酸盐包被的脂质体(CELs,特异性地消耗淋巴结中的巨噬细胞),发现肿瘤引流淋巴结中cDC2不变,而巨噬细胞耗竭。再次对肿瘤引流淋巴结局部CEL给药亦未能消除抗PD-L1的疗效,表明该模型中巨噬细胞对抗PD-L1治疗的作用可忽略不计。多色共聚焦显微镜下CD8+ T细胞未与肿瘤引流淋巴结中的SSM和MSM共定位,而PD-L1+DC和CD8+ T细胞簇比例增多。说明靶向肿瘤引流淋巴结的抗肿瘤免疫可能是通过阻断表达PD-L1的cDC2的功能。 4. PD-1/PD-L1在TDLN中的相互作用与黑色素瘤患者的预后相关
4. PD-1/PD-L1在TDLN中的相互作用与黑色素瘤患者的预后相关
作者纳入黑色素瘤患者来研究在不存在淋巴结转移的情况下,黑色素瘤肿瘤引流淋巴结是否具有PD-1/PD-L1轴活性,发现短期复发生存(RFS)小于48个月与无病生存大于96个月的患者相比,PD-1/PD-L1相互作用密度更高,且与PD-1/PD-L1接触密度相关。随后,作者在肿瘤引流淋巴结生发中心及皮质观察到高水平的PD-1/PD-L1相互作用,且这种相互作用主要是由CD8+T细胞和CD11c+ DC建立的。

结论
肿瘤引流淋巴结(TDLN)是抗肿瘤T细胞免疫反应的关键因素,通过对肿瘤引流淋巴结局部进行PD-L1阻断能产生抗肿瘤T细胞免疫。这项研究挑战了当前的教条,即PD-1/PD-L1检查点主要在效应物(肿瘤)部位起作用,并为发现生物标志物和联合免疫疗法提供了其他途径。 
点评 小编认为,该论文详细勾画了肿瘤引流淋巴结在PD-L1免疫治疗后产生抗肿瘤免疫应答中的作用蓝图,并为其作为一些转移性肿瘤的一线治疗方案提供理论依据。同时,这项研究也清晰地揭示了PD-L1对肿瘤引流淋巴结中传统树突状细胞的关键作用和机制。然而, PD-1/PD-L1免疫治疗期间,肿瘤引流淋巴结的抗肿瘤免疫与原发肿瘤微环境(如免疫微环境、间质微环境等)的相互关系及具体时空关系仍有待进一步研究与阐明。
小编认为,该论文详细勾画了肿瘤引流淋巴结在PD-L1免疫治疗后产生抗肿瘤免疫应答中的作用蓝图,并为其作为一些转移性肿瘤的一线治疗方案提供理论依据。同时,这项研究也清晰地揭示了PD-L1对肿瘤引流淋巴结中传统树突状细胞的关键作用和机制。然而, PD-1/PD-L1免疫治疗期间,肿瘤引流淋巴结的抗肿瘤免疫与原发肿瘤微环境(如免疫微环境、间质微环境等)的相互关系及具体时空关系仍有待进一步研究与阐明。 
思维发散
1. 靶向肿瘤引流淋巴结的PD-1/PD-L1免疫治疗对于原发肿瘤、转移前微环境以及转移灶有什么样的影响和作用? 2. 有淋巴结转移的黑色素瘤以及其他类型的实体瘤患者是否能够从该治疗中获益? 
文献参考 1. Hui, Enfu, et al. "T cell costimulatory receptor CD28 is a primary target for PD-1–mediated inhibition." Science (2017): 1428-1433. PMID: 28280247. 2. Herbst, Roy S., et al. "Predictive correlates of response to the anti-PD-L1 antibody MPDL3280A in cancer patients." Nature (2014): 563-567. PMID: 25428504. 3. Havel, Jonathan J., Diego Chowell, and Timothy A. Chan. "The evolving landscape of biomarkers for checkpoint inhibitor immunotherapy." Nature Reviews Cancer (2019): 133-150. PMID: 30755690. 注:详细信息参见原文,此推文未经许可禁止转载!
1. Hui, Enfu, et al. "T cell costimulatory receptor CD28 is a primary target for PD-1–mediated inhibition." Science (2017): 1428-1433. PMID: 28280247. 2. Herbst, Roy S., et al. "Predictive correlates of response to the anti-PD-L1 antibody MPDL3280A in cancer patients." Nature (2014): 563-567. PMID: 25428504. 3. Havel, Jonathan J., Diego Chowell, and Timothy A. Chan. "The evolving landscape of biomarkers for checkpoint inhibitor immunotherapy." Nature Reviews Cancer (2019): 133-150. PMID: 30755690. 注:详细信息参见原文,此推文未经许可禁止转载!
原文链接:http://www.xxwk.net/archives/2680