放射学表现为亚实性结节(SSN)的肺腺癌(LUAD)比实性LUAD表现出更多的惰性生物学行为。SSN的转录特征和肿瘤微环境(TME)仍然知之甚少。在这里,我们对16例SSN标本、6例邻近正常肺组织(nLung)和9例有淋巴结转移的原发性LUAD(mLUAD)进行了单细胞RNA测序分析。从118,293个细胞中获得了大约6亿个独特的转录本。我们发现SSN的TME中以细胞毒的NK/T细胞为主,并且SSN中的恶性细胞经历了强烈的代谢重排和免疫应激。SSN内皮细胞亚型组成与mLUAD相似,成纤维细胞亚型分布更接近nLung。我们的研究提供了SSN及其TME的单细胞转录图谱。这一资源提供了对SSN惰性本质的更深层次的洞察,并将有助于推进肺癌免疫治疗。
引言
低剂量计算机断层扫描(LDCT)筛查的应用大大提高了表现为放射学亚实性结节(SSN)的早期肺腺癌(LUAD)的检出率(1)。在上海的一项筛查研究中,在基线LDCT筛查中发现的84.87%的肺癌病例是SSN(2)。众所周知,LUAD的影像学表现为SSN,是一种相对惰性的静态肿瘤,存活率高(3-7)。在最近一项对LUAD术后I期患者的大规模回顾性研究中,部分实性结节的5年总存活率为94.9%(3)。由于肿瘤生长缓慢且预后良好,人们已达成共识,认为具有亚实体特征的肿瘤应该少一些“侵袭性”治疗,并建议进行长期随访(8-10)。
为了破译SSN的惰性本质,人们付出了很大的努力。我们的团队发现SSN的基因组具有相对较低的突变负担和很少的拷贝数改变(11)。肿瘤病变是由恶性肿瘤细胞、各种免疫细胞和基质细胞组成的复杂生态系统(12)。肿瘤细胞和不同类型肿瘤微环境(TME)的异质性对肿瘤行为的形成起着至关重要的作用(13-17)。因此,破解SSN中肿瘤细胞与肿瘤微环境TME之间的复杂相互作用至关重要。
在本研究中,我们对16例表现为SSN的LUAD样本进行了单细胞RNA测序(ScRNAseq)。通过对9例原发LUAD伴淋巴结转移(MLUAD)标本和6例邻近正常肺组织的SSN进行比较,对SSN的恶性细胞、免疫细胞和间质细胞的转录组特征进行了全面的表征,揭示了SSN细胞百分比的动态变化、细胞亚型的异质性和细胞间的相互作用,为SSN和LUAD的发生发展提供了新的生物学基础。
结果
SSN多细胞生态系统的单细胞转录图谱研究
基于液滴的scRNA-seq(10X基因组学)对来自16个初治患者的总共16个SSN样本进行了检测(图S1a和表S1)。同时,下载了9个mLUAD和6个nLung(17)样本的scRNA-seq数据进行综合分析(图1A)。从118,293个细胞中获得了大约6亿个独特的转录本。其中70,461个细胞(59.56%)来自SSN,26,344个细胞(22.27%)来自mLUAD,21,488个细胞(18.17%)来自nLung。所有高质量的细胞都被整合到一个未批处理和可比较的数据集,并在对读取深度和线粒体读取计数进行校正后进行主成分分析(PCA)(图S1、B到D)。通过基于图表的一致流形逼近和投影(UMAP),26个高置信度细胞簇(图S1b),可将其归入已知的细胞谱系(图S1b,S1b,S1b, S1E)。根据典型基因标记的表达(图1C和图1C)我们确定了10种主要的细胞类型(图S1F):T细胞、自然杀伤(NK)细胞、髓样细胞、B细胞、浆细胞、肥大细胞、成纤维细胞、内皮细胞(ECs)、EPCAM+上皮细胞和红细胞。T细胞的相对丰度从非肺脏到SSN和mLUAD依次递增(图1,D和E;图8)。S1、G和H;以及表S3)。SSN中NK细胞的相对丰度与非肺脏相当,但高于mLUAD。此外,肥大细胞也明显富含SSN。SSN和mLUAD的单核巨噬细胞相对丰度均低于正常肺,而B细胞和浆细胞的相对丰度高于正常肺。我们进一步进行了七重免疫组织化学染色,以提供nLung、SSN和mLUAD的多细胞生态系统的概况(图1F和图1F)。S1I)。这些结果表明,SSN代表了一个有别于nLung和mLUAD的多细胞生态系统。
图1。正常肺和肺肿瘤的TME概况。(A)显示scRNA-seq实验设计和初步数据探索的工作流程。(B)确定的细胞种群。来自nLung (n=6)、SSN(n=16)和mLUAD(n=9)样本的118,293个单细胞的UMAP投影显示形成了10个带有标记名的主要簇。每个点对应一个单元格,根据单元格类型着色。(C)如UMAP图所示,使用规范细胞标记根据细胞特性标记群集。(D)6种主要CD45+免疫细胞在nLung、SSN和mLUAD样本中的平均比例。(E)6种CD45+免疫细胞在3组中的百分比。Y轴:三组样本的平均百分比。组以不同的颜色显示。每个条形图代表一个细胞簇。误差条代表正常和肿瘤样本的±SEM。彩色圆点代表不同的样本。统计学分析采用双侧非配对Wilcoxon秩和检验。(F)显示非肺、SSN和mLUAD组织的细胞成分的七丛染色板。
SSN恶性细胞的标志性征象与代谢紊乱
接下来,我们将重点放在每种主要细胞类型的转录特征上。根据规范标记(图2B,图2A),共获得1997个正常气道上皮细胞,分别为肺泡Ⅰ型细胞(AT1;AGE+)、肺泡Ⅱ型细胞(AT2;SFTPA1+)、分泌俱乐部细胞(Club;SCGB1A1+)、基底气道上皮细胞(Basal;KRT17+)和纤毛气道上皮细胞(纤毛上皮细胞;TPPP3+)(图S2A和表S2),与患者来源(图2C)和其他特征(图2C)无关(图S2B)。
以免疫细胞和基质细胞为参照,通过推断大规模拷贝数变异(CNV)来鉴定恶性细胞(13-15)。在恶性细胞中推断的CNV模式与从配对的整体外显子测序(WES)数据计算的CNV一致(图2D和图S2C)。我们发现恶性细胞根据患者来源形成簇,表明肿瘤间高度异质性(图2E和图S2D)(13-15)。
癌变被描述为恶性细胞获得有利的生物学能力(19,20)。比较mLUAD和SSN的基因集变异分析(GSVA)(17,21)显示,在mLUAD的恶性肿瘤细胞中,E2F靶点、MYC靶点、干扰素-(IFN-)和干扰素-反应、PI3K-AKT和缺氧途径上调(图2F,TOP和FIG)。S2E)(19、20、22)。接下来,将SSN与非肺癌进行比较,发现SSN的许多代谢途径在SSN的恶性肿瘤细胞中显著上调-包括糖酵解;氧化磷酸化;以及脂肪酸、异物和血红素代谢(图2F,下图)。进一步全面剖析代谢谱(23)表明SSN中的恶性细胞有不同的代谢模式(图2G和图S2F)。特别是一些代谢途径在SSN恶性细胞中高表达,包括氧化磷酸化;精氨酸和脯氨酸代谢;组氨酸代谢;丙氨酸、天冬氨酸和谷氨酸的代谢。
最后,我们利用非负矩阵分解方法研究了SSN和mLUAD样本在恶性细胞中表达程序的差异(15)。层级聚类确定了mLUAD内五种常见的表达程序(图2H,TOP),包括细胞周期、线粒体信号、上皮-间充质转化(EMT)、上皮分化和缺氧。在SSN中,包括Jun、FOS、IER2和即刻早期基因的表达程序的鉴定表明细胞激活和胁迫反应(图2H,底部)。综上所述,在单细胞分辨率下,我们发现SSN中的恶性细胞表现出强烈的代谢重排和免疫应激。
SSN患者TME中的细胞毒优势T细胞和NK细胞
亚群57,301个T和NK细胞揭示了12个亚型(图3,A到D和图3)。CD_4+T细胞亚型(CD_4-C_1~C_5;CD_3d+CD_4+),包括1个调节性CD_4+T细胞亚型(CD_4-C_4;FoxP3+),5个CD_8+T细胞亚型(CD_8-C_1~C_5;CD_3d+CD_8A+),2个NK细胞亚型(NK-C1和C2,CD_3d−CD56+TYROBP+)。具体地说,从SSN获得了35,185个T/NK细胞(图3B)。
对于CD4+T细胞,我们确定了记忆(CD4-C1;ANXA1+)、效应记忆(CD4-C2;ANXA1+GZMA+)、幼稚(CD4-C3;CCR7+Sell+LEF1+)、调节因子(CD4-C4;FOXP3+IL2RA+)和衰竭(CD4-C5;CXCL13+PDCD1+BTLA+TOX+)CD4+T细胞(图3、C和D以及表S2)(图3、C和D以及表S2)。此外,我们发现幼稚的CD4+T细胞群(CD4-C3)也包含很少比例的幼稚的CD8+T细胞(图3)。S3F)。推测的常规CD4+T细胞的发育轨迹呈分枝结构,以最高的幼稚状态CD4-C3(图3e)为根,以效应器CD4-C2和耗尽的CD4-C5为结束簇(图3e)。S3G)。SSN中效应CD4+T细胞(CD4-C2)的相对百分比低于nLung,但高于mLUAD,而抑制调节因子(CD4-C4)和耗竭CD4+T细胞(CD4-C5)的相对百分比与nLung相似,但明显低于mLUAD(图3,F和G,图S3H和表S3)。
对于CD8+T细胞,高表达GZMK而低表达其他细胞毒效应的CD8-C1代表前效应CD8+T细胞(图3,C和D,以及表S2)。CD8-C1低表达Tcf7(也有TCF-1)、PDCD1和Eome,但缺乏GZMB和HAVCR2(也有Tim-3)的表达,这与先前研究定义的“前体耗竭”T细胞一致(26)。根据ZNF683的表达,CD8-C2被鉴定为记忆性CD8+T细胞。CD8-C4由于NKG7、PRF1、CX3CR1等细胞毒标志物的高表达,与效应性T细胞相对应。CD8-C3和CD8-C5被归类为终末耗竭的CD8+细胞毒性T细胞,其特征是表达细胞毒效应因子(IFNG、RPF1、NKG7、GZMA、GZMB和GNLY)、抑制标记(PDCD1、HAVCR2、LAG3、TIGIT和CTLA4)以及T细胞耗竭相关的转录因子TOX和EBIMS(图3,C到E和表S2)。与CD8-C3细胞相比,CD8-C5细胞表现出更高的增殖基因表达水平,如MKI67(图3,C和D,以及表S2)。根据癌症基因组图谱(TCGA),CD8-C3和CD8-C5细胞的签名基因的高表达水平都与LUAD患者的低生存率显著相关(图3H和图3H)。S3I)。CD8+T细胞的发育轨迹也显示为二元分支结构(图3I),这与以前的研究(24,25)一致:幼稚T细胞为根部,CD8-C3/C5为耗竭T细胞的终态,CD8-C4为细胞毒性T细胞的终态,CD8-C1和CD8-C2细胞位于这两个终态之间。SSN中CD8+T细胞亚型组成与非肺脏相似,但与mLUAD相反(图3,F和G,图S3H和表S3)。在SSN中,细胞毒作用最强的CD8+T细胞(CD8-C4)的百分比(图3E)高于mLUAD。但SSN中耗竭CD8+T细胞(CD8-C3和CD8-C5)的百分比明显低于mLUAD。此外,SSN的“细胞毒性/耗竭分数”曲线介于nLung和mLUAD之间(图3J)。
NK-C1(CD3CD56dimCD16+)细胞以FCGR3A(CD16)表达为特征,与NK-C2(CD3CD56brightCD16−)细胞相比,具有最强的细胞毒作用(图3E和表S2)。SSN中NK细胞的百分比与非肺中NK细胞的百分比相当(图3F),与mLUAD相比,SSN中NK-C1细胞的含量较高(图3g,图3f)。S3H和表S3)。与mLUAD相比,多重免疫组化染色也显示SSN中NK细胞丰富(图S3J)。
SSN中恶性细胞的特征。(A)1997例肺上皮细胞聚集(n=6)。每个点对应一个单元格,根据单元格类型着色。(B)典型细胞标记用于标记UMAP图中所示的上皮亚型。(C)每组中的样本分布。每个条形对应于一个细胞类型簇,根据样本着色。(D)带有WES配对数据的热图,显示来自一个SSN样本(SSN27)的单个细胞(行)的大规模CNV。以非恶性细胞为参照物(上),在恶性细胞中观察到较大的CNV(中)。样品的CNV由WES分析验证(下图)。该颜色显示log2 CNV比率。红色:扩增;蓝色:缺失。(E)UMAP投射来自SSN(n=16)和mLUAD(n=9)的9281个恶性细胞。每个点对应于一个单元格,根据样本进行着色。(F)恶性细胞中前15个上调的标志性信号通路。上图:mLUAD与SSN。下图:SSN和NLUNG。(G)热图显示GSVA在正常肺上皮细胞与SSN和mLUAD恶性上皮细胞之间每细胞代谢途径的差异。(H)描述来自mLUAD(上)和SSN(下)的肿瘤内程序成对相关性的热图。识别并标记连贯的表达程序。
图3.SSN中以细胞毒为主的T细胞和NK细胞。(A)UMAP投影57,301个T细胞和NK细胞,显示12个主要亚型的组成。(B)SSN来源的35,185个T细胞和NK细胞的UMAP投射。(C)用规范细胞标记物鉴定T/NK细胞亚群。(D)T和NK簇中功能基因集的热图。特雷格,调节性T细胞。(E)累积分布函数,显示每种T/NK亚型的幼稚(左)、细胞毒性(中)和衰竭(右)状态得分的分布。曲线向右移动表示状态分数增加。(F)nLung、SSN和mLUAD各亚型的平均比例。(G)各T/NK细胞亚型在nLung、SSN和mLUAD中的百分比。Y轴:三组样本的平均百分比。组以不同的颜色显示。每个条形图代表一个细胞簇。误差条代表正常和肿瘤样本的±SEM。彩色圆点代表不同的样本。统计学分析采用双侧非配对Wilcoxon秩和检验。(H)Kaplan-Meier图显示,在TCGA数据集中CD8-C5簇标记物高表达的LUAD患者总生存期较短。高分组和低分组由上述基因集平均表达的75%分位值来划分。(I)通过扩散图推测CD8+T细胞的发育轨迹,通过细胞亚型和示例基因的表达进行染色。(J)与(E)相同,但“细胞毒性/耗竭分数”的定义为细胞毒性基因的平均表达水平除以耗竭基因的平均表达水平,以衡量nLung、SSN和mLUAD中CD8+T细胞的功能状态。P值采用双侧非配对Kruskal-Wallis秩和检验。
SSN富含DC,缺少TAM的一个子类型
18,380个髓样细胞的亚群显示出17个亚群(图4,A到D;图3)。S4,A至E;表S2):9种巨噬细胞亚型(Macro-C1-C9;APOE+),2种单核细胞亚型(Mono-C1/C2;FCN1+),1种单核细胞来源的树突状细胞亚型(Mono-DC;MRC1+CD14+),3种常规DC亚型(DCs-C1;CLEC9A+,DCs-C2;CD207+和DCs-C3;LAMPs详细地说,对于9个巨噬细胞和2个单核细胞亚群,我们鉴定了肺泡常驻巨噬细胞(Macro-C1到C3;PPARG+)、血管周围驻留巨噬细胞(Macro-C4;LYVE1+)、抗炎巨噬细胞(Macro-C5;CHI3L1+,Macro-C6;TNF+Axl+)、肿瘤相关巨噬细胞(TAM)(Macro-C7;VEGFA+)、增殖巨噬细胞(Macro-C5;CHI3L1+,Macro-C6;TNF+Axl+)、肿瘤相关巨噬细胞(Macro-C7;VEGFA+)、肿瘤相关巨噬细胞(Macro-C7;VEGFA+)。具体地说,从SSN(图4B)获得6655个(36.21%)髓系细胞。
DC是专业的抗原提呈细胞,在CD8+T细胞活化中起关键作用(28-30)。所有三种亚型的CDC都显著富含SSN(图4,E和F,图3)。S4F和表S3)。DC-C1对应于CDC类型1(cDC1;CLEC9A+)和DC-C2至CDC类型2(cDC2;CD1C+CD207+),而DC-C3代表迁移性CDC(CCR7+CCL19+)(图4G和表S2)。DC-C3亚型-也有BIRC3、CCL22、CD80、CD86、CD40和FSCN1的高表达(图4G和图4G)。S4G)-表示处于激活状态的CDC(图4)。S4H)。特别是,SSN中的DC具有低水平的吲哚胺2,3-双加氧酶1(IDO1),这是一种抑制T细胞激活并诱导T细胞分化为抑制性调节性T细胞的基因(图4H)(12)。
巨噬细胞通常被分为典型的促炎M1类和抗炎M2类(31,32)。我们发现Macro-C4和Macro-C6表现出M2显性的基因特征,但没有一个巨噬细胞亚型只表现出类似M1的表型(图3)。S4i)(27)。传统的M1(CD86和TLR2)和M2(MSR1和MRC1)基因没有亚型特异性(图4I),表明TME中的巨噬细胞激活不遵循极化模型(16)。特别是,Macro-C7表达TAM标记和与糖酵解和血管生成有关的基因(图4,I和J)(33),在SSN中缺失,但在mLUAD中富集(图4F,图4)。S4F和表S3)。来自Macro-7的特征基因与TCGA LUAD患者总体存活率低显著相关(图4K)。
SSNs的内皮细胞亚型分布与mLUAD相似
3381个ECs的亚聚类揭示了6个亚型(图5,A和B;图5)。S5,A至E;表S2):肺泡外毛细血管内皮细胞(CECs)(Endo-C1;EDN1+SLC6A4+,Endo-C5;EDN1+CCL2+),肺泡CECs(Endo-C2;EDNRB+IL1RL1+),肿瘤ECs(Endo-C3;IGFBP7+PLVAP+),动脉ECs(Endo-C4;GJA5+FBLN5+)。此外,肿瘤内皮细胞(Endo-C3)还含有TIP ECs(ESM1和NID2)、高内皮微静脉(HEV)和静脉ECs(ACKR1和SELP),这与以往的观察结果一致,即TIP ECs和HEV主要存在于恶性组织中(25例)。具体来说,从SSN获得了911个ECs(26.94%)。S5D)。SSN和mLUAD具有相似的内皮亚型分布,以Endo-C3扩张和Endo-C5缺失为特征(图5,C和D,图S5F和表S3)。直接比较SSN/mLUAD和SSN/mLUAD的ECs,发现Myc靶点和炎症反应分别是SSN/mLUAD和nLung的ECs中最丰富的基因集(图S5、G和H)。
Endo-C5细胞高表达与免疫激活和淋巴细胞归巢相关的基因,如BIRC3、CCL2、CD44和ICAM1,而Endo-C3细胞高表达与血管生成相关的基因,如HSPG2和POSTN(图3)。S5、E和I)。HARMARK通路分析显示,Endo-C5细胞富含免疫激活相关途径[炎症反应、肿瘤坏死因子-信号通路和干扰素-反应],而Endo-C3细胞富含与血管生成和细胞外重构相关的生物合成和代谢途径(图5e)。与mLUAD相反,SSN中有丰富的Endo-C2细胞(图5,C和D)。Endo-C2细胞也有免疫激活相关基因的高表达,包括ICAM1/2、IL32和主要组织相容性复合物(MHC)II分子。S5I)。
SSN中具有免疫调节功能的成纤维细胞非常丰富
通过对2257个成纤维细胞进行重新聚类,我们发现了五种不同的亚型(图5,F和G;S6,A至E;以及表S2):正常成纤维细胞(fio-C1;RGCC+MACF1+)、肌成纤维细胞(fio-C2;ACTA2+PTN+)、癌相关成纤维细胞(CAFs)(fio-C3;FAP+TGFB1+)、免疫调节成纤维细胞(fio-C4;CFD+CXCL14+)和周细胞(fio-C5;RGS5+PDS。具体地说,从SSN获得1196个(52.99%)成纤维细胞。S6D)。SSN中成纤维细胞亚型的分布与正常肺相似;与mLUAD相比,两组均具有丰富的fio-C1/C2/C4细胞和枯竭的fio-C3/C5细胞的特征(图5,H和I,图3)。S6F和表S3)。直接比较mLUAD和SSN/nLung成纤维细胞,发现sLUAD/nLung成纤维细胞富含免疫调节途径,包括通过NFκB和IL 6-JAK-STAT3(白细胞介素-6-Janus激酶信号转导和转录激活因子3)信号途径传递的TNFA信号,而mLUAD的成纤维细胞富含肿瘤支持标志,包括氧化磷酸化、血管生成、EMT和活性转录途径(FIG)。(图S6、G和H)。
值得注意的是,纤维C4细胞,SSN中含量最丰富的亚型(图5I),表达高水平的细胞因子/趋化因子,如CXCL14和CXCL12,表明具有免疫调节功能(图5J)。有趣的是,进一步的分析显示,纤维C4细胞也表达MHC II和CD74,这与最近定义的“抗原呈递CAFs”是一致的(34)。Ffio-C3细胞特异性地富含mLUAD,并表达指示CAF的基因,包括FAP、PDPN和TGFB1(图5J和图5J)。S6E)。CAF充当合成机器,产生促进癌变的各种胞外成分(12,35)。除了胶原蛋白广泛表达在所有的簇,纤维-C3细胞独特地表达胶原V,VIII和XII(图。S6I),提示肿瘤支持胶原的功能特化。HARMARK通路分析进一步证实,干扰素-反应和IL-2-STAT5信号在纤维C4簇中高度激活。然而,纤维C3细胞富含支持肿瘤进展的途径,包括EMT、TGFb信号和血管生成(图5K)。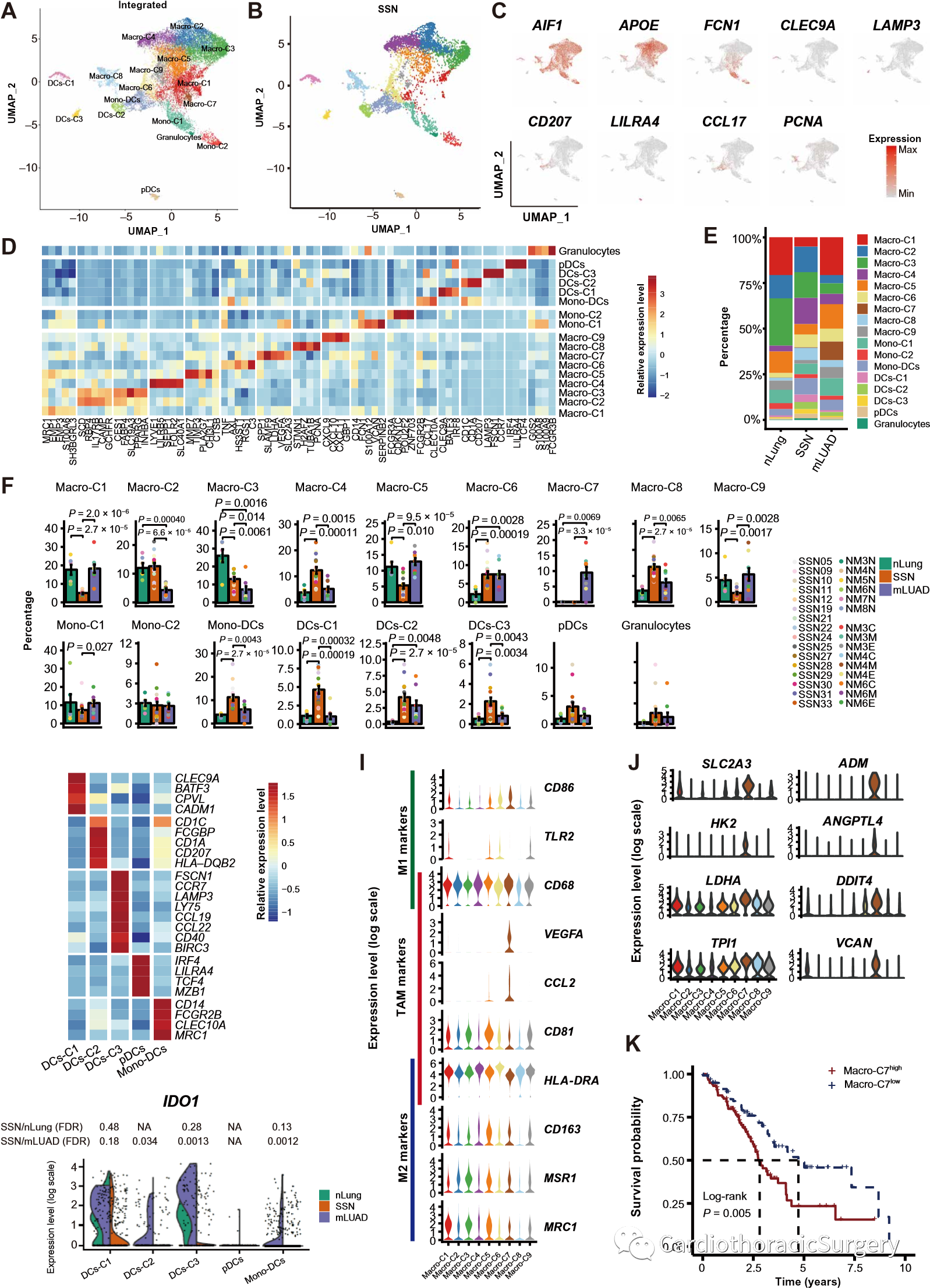

图4.髓系细胞的详细特征。(A)UMAP投影显示18,380个髓系细胞,显示17个主要亚型的组成。(B)SSN来源的6655个髓样细胞的UMAP投射。(C)用规范细胞标记物鉴定髓系细胞亚型。(D)标记基因在髓系簇中表达的热图。(E)各髓系亚型在nLung、SSN和mLUAD中的平均比例。(F)每种髓样细胞亚型在nLung、SSN和mLUAD中的百分比。Y轴:三组样本的平均百分比。组以不同的颜色显示。每个条形图代表一个细胞簇。误差条代表正常和肿瘤样本的±SEM。彩色圆点代表不同的样本。统计学分析采用双侧非配对Wilcoxon秩和检验。(G)显示不同DC亚型标记的热图。(H)显示IDO1在DC亚型中表达的小提琴曲线图,按样品来源划分。采用Benjamini-Hochberg校正值的伪整体法进行差异表达检验(DE检验),计算P值。NA:P值无法计算,因为表达式较低。FDR,错误发现率;NA,不适用。(I)显示巨噬细胞亚型M1、M2和TAM标记表达的小提琴曲线图。(J)显示参与糖酵解和血管生成的示例Macro-C7标记表达的小提琴曲线图。(K)Kaplan-Meier图显示,在TCGA数据集中Macro-C7簇标记物高表达的LUAD患者总生存期较短。根据Macro-C7基因集平均表达水平的75%分位值划分高、低两组。
B细胞和浆细胞在肺TME中高度富集。
有明显的证据支持B细胞在抗肿瘤免疫学中的关键作用(36)。总共分析了10,903个B细胞,并鉴定出7个亚型(图3)。S7,A-D和表S2):两种滤泡B细胞亚型[滤泡B-C1:记忆细胞(CD20+CD27+IgHD−);滤泡B-C2:幼稚细胞(CD20+CD27IgHD+)]、粘膜相关淋巴组织衍生B细胞(IGHA+)、生发中心B细胞(NEIL1+)、两种血浆B细胞亚型[血浆B-C1:免疫球蛋白G成熟(IGHG+)]、粘膜相关淋巴组织衍生B细胞(IGHA+)、生发中心B细胞(NEIL1+)、两种血浆B细胞亚型[血浆B-C1:免疫球蛋白G成熟(IGHG+)]、粘膜相关淋巴组织衍生B细胞(IGHA+)、生发中心B细胞。特别地,从SSN获得7839个(71.90%)B/浆细胞。S7B)。
与mLUAD相比,SSN组卵泡B-C2细胞丰度增加,而B-C1细胞丰度降低(图S7、E至G)。通过对SSN和mLUAD滤泡B细胞的直接比较,发现SSN中B细胞的KRAS(V-Ki-RAS2Kirsten病毒癌基因同源物)信号、肿瘤坏死因子-诱导的增殖和炎症反应被强烈激活,表明其处于炎症状态;而干扰素应答(I型和II型)、能量供应(氧化磷酸化和糖酵解)和生物量产生[mTOR(哺乳动物雷帕霉素靶点)和脂肪酸代谢]途径在SsN的B细胞中高度激活,表明Ssn和mLUAD的滤泡B细胞处于炎症状态。S7、H和I)。与这些结果一致的是,mLUAD中B细胞的整体转录丰度显著高于SSN中的B细胞(图S7J)。
血浆B-C2细胞富含SSN,而血浆B-C1细胞富含mLUAD(图3)。S7、E和F)。值得注意的是,XBP1在血浆B-C1簇中高表达,在血浆B细胞分泌表型的诱导中起核心作用,也检测到IGHGs的高表达(图4)。S7K)。这些结果表明,SSN中的B细胞表现为炎症主导的基因表达模式,而mLUAD中的B细胞转录更活跃,具有更强的分泌样表型。
SSN中细胞间相互作用的特征
为了描述SSN中细胞间的相互作用,我们根据我们的高分辨率scRNA-seq数据中的配体-受体信号推断了可能的细胞间相互作用。如果一个细胞表达受体或配体,则这种“配体-受体”相互作用对于该细胞分别被定义为传入或传出(15)。成纤维细胞和内皮细胞在这三组中相互作用最强。与非肺相比,SSN和mLUAD的ECs和巨噬细胞有更多的传出相互作用,而CD8+T细胞有更多的传入相互作用。值得注意的是,SSN中的NK细胞、CD8+T细胞和CD4+T细胞比nLung和mLUAD中的NK细胞、CD8+T细胞和CD4+T细胞有更多的传入相互作用,这些传入连接主要来自成纤维细胞、单核细胞、内皮细胞和巨噬细胞(图6A)。
与mLUAD和nLung中的NK细胞相比,SSN中的NK细胞有更多的相互作用(图6A)。为了研究NK细胞是如何被招募的,我们筛选了NK细胞上表达的所有受体。S8A),产生两种高表达的受体:CXCR4和CX3CR1。CXCR4的配体是CXCL12,由成纤维细胞和内皮细胞表达(图6B)。详细地说,CXCL12是由SSN中的Endo-C4细胞独占表达的(图6C和图6C)。S8B)。此外,CX3CR1的唯一配体CX3CL1主要在SSN的Endo-C2和Endo-C5细胞中高表达(图6C)。因此,我们认为内皮细胞可能参与了SSN中NK细胞的募集。
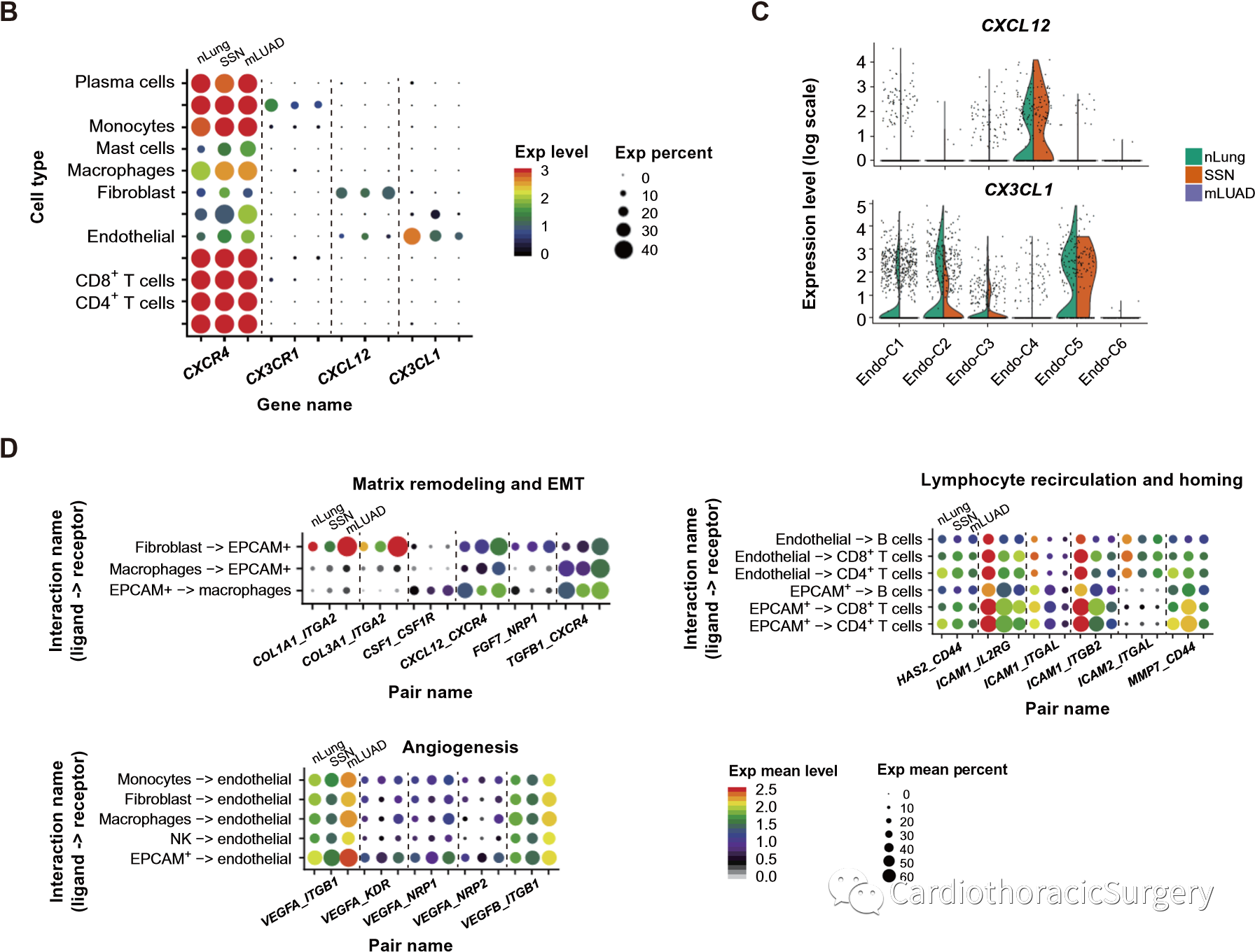
图6。正常肺和肺肿瘤中的细胞间相互作用。(A)Circos图显示了nLung、SSN和mLUAD中不同细胞类型之间的细胞间相互作用。这些字符串是定向的,并且表示基于一种细胞类型的配体的表达和另一种细胞类型的相应受体的表达而确定的相互作用。每根线的厚度对应于根据细胞类型着色的不同相互作用对的量。(B)点阵图,显示所选基因在不同细胞类型中的表达水平和百分比,这些细胞类型包括nLung、SSN和mLUAD。(C)显示CXCL12和CX3CL1在不同EC亚型中表达的小提琴曲线图,按样本来源划分。(D)点图,显示参与EMT、淋巴细胞归巢和血管生成的选定相互作用对的平均表达水平和百分比。对于每个样本来源,分别考虑每个基因的表达。
材料及方法
病人和样本采集
在匹克大学人民医院胸外科接受手术治疗的肺部SSN患者按以下标准入选:(1)CT表现为肺SSN;(2)病理诊断为LUAD、原位腺癌和不典型腺瘤性增生;(3)无其他恶性肿瘤病史;(4)无抗癌治疗(化疗、放疗、靶向治疗等)。在手术前。入选患者的胸部CT图像由两名有经验的胸外科医生独立检查。切除SSN标本后,沿长轴方向将肿瘤组织切成两块,一半用于scRNA-seq,另一半用于病理诊断和WES。术前采集血样,分离白细胞,在−80°C保存至WES。表S1总结了这些患者的临床信息。本研究由北京大学人民医院伦理委员会批准,并征得所有参与者的书面知情同意。
单细胞悬液的准备
手术切除后立即用冰冷的H1640(Gibco,Life Technologies)运送原发肿瘤组织样本。原发肿瘤组织用磷酸盐缓冲盐水(PBS;Thermo Fisher Science)冲洗,切成约1 mm的立方块,用UTTD(Ultra-TURRAX®Tube Drive)分散器(德国IKA)研磨。研磨的肿瘤组织标本用0.25%胰蛋白酶(Gibco,Life Technologies)消化,H1640加10%胎牛血清(Gibco,Life Technologies)终止,然后转移到含有胶原酶IV(100U/ml;Gibco,Life Technologies)和消解酶(0.6U/ml;Gibco,Life Technologies)的10ml消化培养基中。消化后的样品通过70-m尼龙网过滤。离心后,用冰冷红细胞裂解缓冲液(Solarbio)悬浮成粒细胞,用40-m尼龙网过滤。最后,用1ml的Dulbecco‘s PBS(Solarbio)悬浮制粒细胞,用自动细胞计数器(Countstar)测定活细胞和块状细胞的浓度。
基于液滴的单细胞测序
使用Single Cell 3‘Library and Gel Bead Kit V2(10倍基因组学)和铬单细胞A芯片试剂盒(10倍基因组学),将细胞悬液加载到铬单细胞控制器(10倍基因组学)上,根据制造商的方案在乳剂(GEMS)中产生单细胞凝胶珠。将单个细胞悬浮在含0.04%牛血清白蛋白的PBS中。将大约10,000个细胞添加到每个通道,并回收了大约6000个细胞。捕获的细胞被裂解,释放的RNA在单个宝石中通过反转录进行条形码编码。反转录在53°C下进行45分钟,然后在85°C下进行5分钟,然后将温度保持在4°C,产生并扩增互补DNA,然后根据制造商的说明使用Agilent 4200(由北京CapitalBio Technology进行)对其质量进行评估。使用Single Cell 3‘Library Gel Bead Kit V2构建scRNA-seq文库。最后使用Illumina NovaSeq 6000测序,采用成对端150碱基对(PE150)阅读策略(由CapitalBio Technology,Beijing执行)。
多重免疫组织化学
福尔马林固定/石蜡包埋标本来自北京大学人民医院。样本按前面描述的那样处理(49)。所用抗体为抗CD3型(ZM0417)、抗CD20型(TA800385)、抗CD68型(ZM0060)、抗CD56型(ZM0057型)、抗CD16型(16559-1AP)、抗CD31型(ZM0044)、抗FAP型(AB53066)。根据制造商的方案,使用Opal 7色手册IHC试剂盒(PerkinElmer,NEL811001KT)显示抗原结合位点。使用Mantra定量病理工作站(PerkinElmer,CLS140089)收集多色免疫组织化学数据,并用INFORM(版本2.2.1)进行分析。
scRNA-seq数据处理
使用Cell Ranger(版本2.2.0)管道和人类参考版本GRCh38为每个样本生成原始基因表达矩阵。使用DropletUtils(50)程序包(1.2.2版)去除空滴后,用R软件(3.5.3版)和Seurat(51)程序包(3.0.0版)分析输出过滤的基因表达矩阵。简而言之,选择数据中表达比例>0.1%的基因和检测到>200个基因的细胞进行进一步分析。如果低质量细胞满足以下标准:(I)<500UMI(唯一分子标识符),(Ii)>6000或<200个基因,或(Iii)>10%来自线粒体基因组的UMI。在去除低质量细胞后,使用NormalizeData函数对基因表达矩阵进行归一化,并使用FindVariableFeature函数计算具有较高细胞间变异的2000个特征。为了降低数据集的维数,对ScaleData函数生成的线性变换缩放数据使用默认参数执行RunPCA函数。接下来,按照Seurat开发人员的建议,使用ElBowPlot、DimHeatmap和JackStrawPlot函数来识别每个数据集的真实维度。最后,我们使用FindNeighbors和FindClusters函数对单元进行聚类,并使用默认设置的RunUMAP函数执行非线性降维。有关本工作中执行的SEURAT分析的所有详细信息,可在网站教程(https://satijalab.org/seurat/v3.0/pbmc3k_tutorial.html).中找到
多数据整合
为了比较三种情况下的细胞类型和比例,我们使用了https://satijalab.org/seurat/v3.0/integration.html(52)中描述的集成方法。Seurat包(版本3.0.0)用于将多个不同的scRNA-seq数据集组合成一个集成的、未批处理的数据集。简而言之,如上所述,我们确定了2000个细胞间差异较大的特征。接下来,我们使用FindIntegrationAnchors函数识别各个数据集之间的“锚”,并将这些锚输入到IntegrateData函数中,以创建所有单元格的“批量校正”表达式矩阵,从而允许将来自不同数据集的单元格集成在一起并进行分析。
细胞类型标注和聚类标记识别
通过UMAP对所有细胞进行非线性降维并将其投影到二维空间后,细胞按照共同的特征聚集在一起。Seurat中的FindAllMarkers函数用于查找每个已识别群集的标记。然后根据特定细胞类型的规范标记的表达对群集进行分类和注释。表达两个或更多规范细胞类型标记的群集被归类为二重细胞,而不表达规范细胞类型标记的群集被归类为低质量细胞。双重细胞团和低质量细胞团都被排除在进一步的分析之外。
主要细胞类型的亚聚类
对于每种主要细胞类型,首先从概述集成数据集中提取细胞。接下来,将这些主要细胞类型进行整合,以进行进一步的亚聚类。整合后,基因被缩放到单位方差。如上所述执行缩放、PCA和聚类。
定义单元格状态分数
我们使用细胞评分来评估单个细胞表达特定预定义表达基因集的程度。细胞分数最初基于来自相应细胞(15)中的预定义基因集合的基因的平均表达。使用Seurat中的AddModuleScore函数以默认设置实现该方法。我们使用了4个定义明确的天真标记(CCR7、Tcf7、LEF1和SEL),12个细胞毒性相关基因(PRF1、IFNG、GNLY、NKG7、GZMB、GZMA、GZMH、KLRK1、KLRB1、KLRD1、CTSW和CST7)和5个穷尽标记(LAG3、TIGIT、PDCD1、CTLA4和HAVCR2)来定义天真。根据“LM22”前30个基因(53个)测定DC的静息和活动评分。
WES和分析
使用带有默认参数的Burrow-Wheeler比对程序(0.7.17版)(54)将成对的末端读取序列与人类基因组hg19[加州大学圣克鲁斯分校]进行比对,并使用Picard(http://Picard.)中嵌入的SortSam功能进行排序。SourceForge.net;版本2.18.7)。MarkDuplates函数用于标记和丢弃重复项。使用基因组分析工具包(GATK版本3.8.0)(55)进行基础质量再校准。为了基于WES数据描述整个基因组的拷贝数状态,使用带有默认参数的Sequenza(R包,版本2.1.2)(56)来将拷贝数建模为整数,同时考虑倍性和细胞性。最后,按拷贝数显示结果(R包,版本1.22.0)。
恶性细胞的CNV评估与鉴定
为了从scRNA-seq数据推断CNV,我们使用了前面描述的方法,该方法使用了https://github.com/BroadInstitute/INFERCNV中提供的带有默认参数的R代码。免疫细胞和基质细胞被认为是假定的非恶性细胞,它们的CNV估计被用来定义基线(13)。计算的CNV信号(x轴)定义为所有基因组位置的CNV估计值的均方。计算的CNV R积分(y轴)定义为每个细胞的CNV模式与同一肿瘤前5%的细胞的平均CNV模式相对于CNV信号的Pearson相关系数。所有肺肿瘤标本中的上皮细胞均为EPCAM+,CNVR评分为≥0.3时定义为恶性细胞。
瘤内异质性的表达程序
来自每个肺癌样本的恶性细胞(低于100个恶性细胞的样本被排除在分析之外)首先如上所述被归一化,然后对每个基因进行中心定标。将所有负值转换为零后,使用NMF R软件包(版本0.21.0)中的NMF函数进行非负矩阵因式分解,并计算每个样本的前10位。基因按其平均得分排序,每个簇的前30个基因被定义为元签名,并用于计算变异系数(CV)。每个节目的CV被定义为SD除以节目签名值的平均值,然后乘以100以得到百分比值(%)。为了去掉重复项,在每个样本中计算了10个程序中任意2个的皮尔逊相关性。我们在相应的样品中只保留了CV大于25%、皮尔逊相关性小于0.4的项目。
细胞类型之间的相互作用
如前所述,我们根据一种细胞类型对受体的表达和另一种细胞类型对相互作用配体的表达,确定了不同细胞类型之间可能的相互作用。潜在的受体-配体相互作用的集合是从Ramilowski等人那里获得的。(57)。如果配体或受体转录本在某一细胞类型中的平均表达量高于log2标准中0.5的阈值,则该转录本被定义为由该细胞类型“表达”,并且在该类型的细胞中至少有10%的细胞中有该配体或受体转录本的表达。如果一种细胞类型表达受体或配体,那么对于该细胞类型,相应的相互作用分别被定义为传入或传出。最大配体-受体对数量的第三分位数以上的细胞类型对之间的边缘被显示。
基因组变异差异
对分子签名数据库(58)中描述的50条标记通路进行通路分析。我们还使用先前描述的包含85条代谢途径的精选数据集评估了代谢途径的活动(23)。为了给单个细胞分配通路活性估计值,我们使用标准设置应用了GSVA,如前所述在GSVA(21)R包(1.30.0版)中实现了GSVA(17)。使用LIMMA(59)R程序包(版本3.38.3)计算簇间或条件间通路的差异活性。经本杰米尼-霍奇伯格校正的P值为≤0.01时,可识别出明显受扰的通路。
差异丰度和表达试验
差异丰度检验(DA检验)用于检测不同条件下细胞类型丰度的变化,总结见表S3。采用伪整合法进行差异表达试验(DE检验),比较差异表达基因的表达情况。使用EDGER(60)R软件包(版本3.24.3)中的方法和代码的分析都改编自生物导体教程(https://osca.bioconductor.org/multi-sample-comparisons.html).。经本杰米尼-霍奇伯格校正的P值为≤0.05时,差异有统计学意义。
扩散图和拟时分析
对CD8+T细胞和CD4+T细胞簇的单个细胞进行扩散图和拟时分析(拟时分析,又称细胞轨迹分析,通过拟时分析可以推断出发育过程细胞的分化轨迹或细胞亚型的演化过程,在发育相关研究中使用频率较高。主要基于关键基因的表达模式,在拟时间中对单个细胞进行排序,模拟出时间发育过程的动态变化)。首先,确定每个簇的差异表达基因。然后,将数据从Destination R程序包(版本2.12.0)导入到DiffusionMap函数,用于使用默认设置进行扩散图和拟时分析。一个幼稚的T细胞被用作扩散拟时计算的根细胞,使用前两个扩散分量来表示结果。
TCGA 数据关联
我们从UCSC Xena(http://xena.ucsc.edu/).)下载了预处理后的基因表达数据[log2(x+1)转化的RSEM(RNASeq by Expect-Maximization)-归一化计数]和TCGA LUAD(TCGA-LUAD)RNAseq基因表达数据集的临床数据。采用Kaplan-Meier分析和对数秩检验来研究前30个特异性基因签名对患者生存的影响。所有分析均使用R软件包Survive(版本2.43.3)和Survminer(版本0.4.4)进行。
数据统计
每项分析的统计工具、方法和阈值均与结果一起明确描述,或在附图图例或材料和方法中详细说明。
原文链接:http://www.xxwk.net/archives/2711