日本食管癌的发病率趋势是男性发病率逐渐上升,女性发病率持平。男性死亡率趋于平稳,女性死亡率下降。从性别上看,大部分是男性,而且大多是60多岁、70多岁的人。占据部位最常见于胸中段食管。组织学类型为鳞状细胞癌,占病例的90%。此外,已知同步和异时双重癌症经常发生。鳞状细胞癌的危险因素包括吸烟和饮酒。作为腺癌的危险因素,由胃食管反流病(GERD)引起的食管下段持续性炎症引起的巴雷特上皮在日本被认为是腺癌的起源,数量较少且不清楚。
一般说明
1 发病率和死亡率
根据国家癌症中心癌症控制信息中心根据地区癌症登记处癌症发病率数据编制的统计数据,2011 年食管癌患病率(粗发病率)估计为 31.7 男性(每 10 万人)和 5.2妇女(每 100,000 人)。男性的年龄调整发病率呈逐渐上升的趋势,而女性的年龄调整发病率近年来没有上升或下降(图1)。
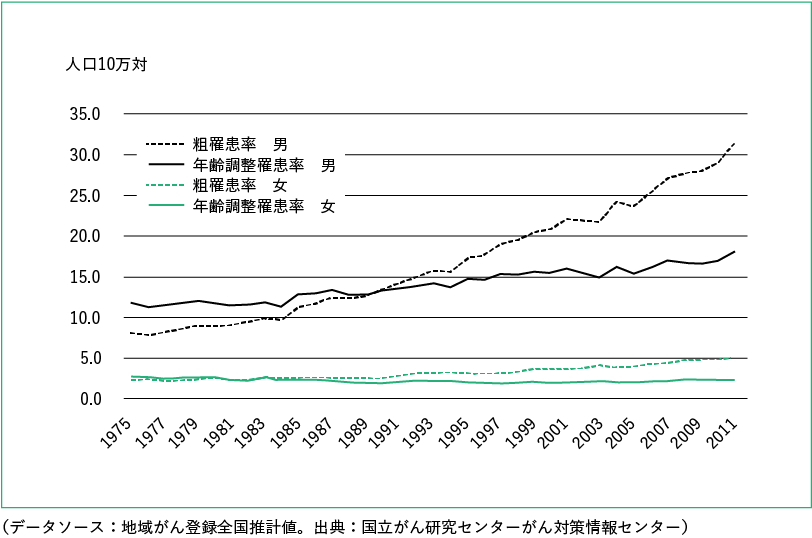
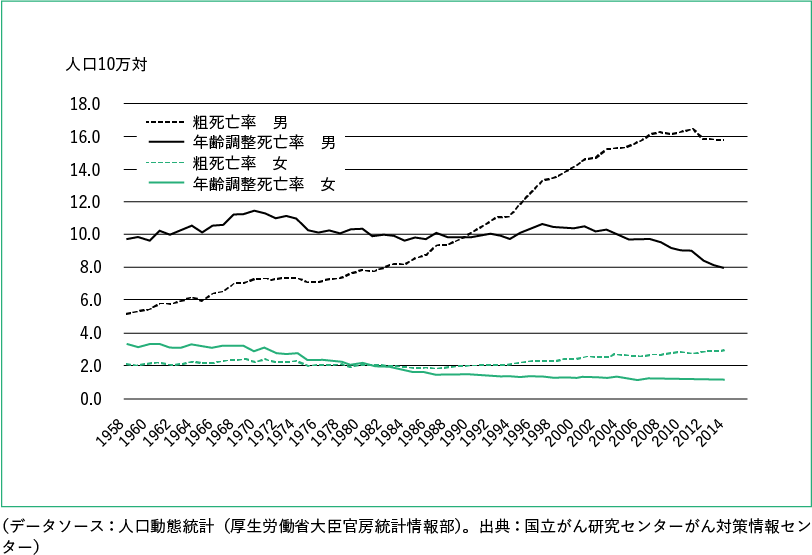
根据厚生劳动省的人口统计调查,2013年食道癌死亡人数为11,543人(粗死亡率:每10万人中有9.2人),相当于所有恶性肿瘤死亡人数的3.2%。男性为 15.8(每 10 万人),仅次于肺、胃、大肠、肝脏和胰腺,女性为 2.9(每 10 万人),在女性中排名第 101 )。食管癌的年龄调整死亡率在男性中保持不变,在女性中下降(图 2)。基于生命统计的癌症死亡率数据和使用这些数据的各种图表可从国家癌症中心的癌症控制信息中心获得 ( http://ganjoho.jp/reg_stat/index.html ) 1)。
术语表
[流行率]定义了一组人群,并用该人群在一定时期内发生的病例数除以该人群的人数。所提供的数据由国家癌症中心的癌症控制信息中心根据区域癌症登记处国家估计的癌症发病率数据(1975-2011 年)汇编而成。
[年龄调整发病率]如果人口构成与参考人口相同,本应达到的发病率。
[粗死亡率]用给定时期的死亡人数除以该时期的人口得出的死亡率。
[年龄调整死亡率]如果人口构成与参考人口相同,将实现的死亡率。由于癌症的死亡率随着年龄的增长而增加,因此老年人多的人群的癌症粗死亡率高于老年人少的人群,需要以与组成(标准人群)相匹配的形式。在日本,一般采用 1985 年模型人口(基于 1985 年人口的虚拟人口模型)作为参考人口。
2 日本食管癌现状
根据日本食道学会的全国性调查(2008)2),男女比例约为6:1,多见于男性,多发于60~70岁人群,约占年龄组的 69%。约 50% 的占位部位为中胸段食管,其次为下胸段食管(约 25%)、上胸段食管(约 12%)、腹段食管(约 6%)和颈段食管(约 5%)。 %)。)遇见了。组织学类型为鳞状细胞癌(90%)和腺癌(4%)。大约 23% 的食管癌患者,包括同步癌和异时癌,在其他器官中存在重叠癌,其中胃癌最常见,其次是咽癌。
3 风险因素
日本食道癌的危险因素是饮酒和吸烟。饮酒和吸烟是鳞状细胞癌的重要危险因素,在日本其发病率高达 90% 以上,众所周知,两者联合使用会增加风险3-6)。2009 年 10 月,世界卫生组织下属组织国际癌症研究机构 (IARC) 的一个工作组将与酒精饮料相关的乙醛列为第 1 类致癌物6)。此外,由于营养状况下降和水果和蔬菜摄入不足导致的维生素缺乏也被认为是危险因素,绿色和黄色蔬菜和水果被认为是预防因素7、8)。
腺癌在日本发生在百分之几的病例中,但在欧洲和美国呈上升趋势,占病例的一半以上。巴雷特上皮是由胃食管反流病引起的下食道持续炎症引起的,已知是胃食管反流病的起源。9-12 )。在日本,由于案件数量少,没有提供明确的证据。
参考
1)国家癌症中心癌症控制信息中心,癌症信息服务。
http://ganjoho.jp/reg_stat/index.html2)Tachimori Y 等人:日本食管癌综合登记处,2008. Esophagus. 2015;12:130-57。3)Stevens J 等人:饮酒、吸烟和食管癌和胃癌亚型风险:一项前瞻性队列研究。Gut. 2010;59(1):39-48。四)Sakata K 等人;JACC 研究组:吸烟、饮酒和食道癌:JACC 研究的结果:J Epidemiol. 2005;15 Suppl 2:S212-9。五)Ishiguro S 等人;JPHC 研究组:饮酒、吸烟和潮红反应对食道癌风险的影响:基于人群的队列研究 (JPHC 研究). Cancer Lett. 2009; 275(2): 240-6。6)Secretan B, et al; WHO International Agency for Research on Cancer Monograph Working Group: A review of human carcinogens - Part E: 烟草、槟榔、酒精、煤烟和咸鱼. Lancet Oncol. 2009; 10(11): 1033-4。7)Freedman ND 等人:大型前瞻性队列研究中的水果和蔬菜摄入与食道癌。Int J Cancer. 2007;121(12):2753-60。8)Lagiou P 等人:欧洲的饮食和上呼吸消化道癌症:ARCAGE 研究。Int J Cancer. 2009;124(11):2671-6。9)Yousef F 等人:Barrett 食管中食管癌和高度不典型增生的发病率:系统评价和荟萃分析。Am J Epidemiol. 2008;168(3):237-49。十)Abnet CC 等:BMI 与食管和胃腺癌风险的前瞻性研究。Eur J Cancer. 2008;44(3):465-71。11)Lagergen J 等人:症状性胃食管反流作为食管腺癌的危险因素。N Engl J Med. 1999;340(11):825-31。12)Kubo A 等人:体重指数和食道或胃贲门腺癌:系统评价和荟萃分析. Cancer Epidemiol Biomarkers Prev. 2006;15(5):872-8。
临床问题
CQ1–1您是否从预防食管癌发展的角度建议健康人戒烟?
证据强度B.从预防食道癌发展的角度来看,强烈建议健康个体戒烟。(同意率95% [19/20])
评论
作为该CQ的文献检索结果,提取了PubMed:147篇、Cochrane:32篇、Ichushi:26篇,并进行了定量系统评价。
有 35 篇关于吸烟的论文有可以对这个 CQ 进行 meta 分析的信息,包括 2 篇关于降低食管癌死亡率的队列研究和 3 篇关于降低食管癌发病率的队列研究,对这两项研究都进行了分析。有一项队列研究与 有 29 项食管癌发病率降低的病例对照研究。对鳞状细胞癌进行了 19 次分析,对腺癌进行了 18 次分析,对日本受试者进行了 3 次分析。
在对 35 项关于吸烟的观察性研究的荟萃分析中,结果是降低了食道癌的发病率或死亡率,从而降低了风险。尽管这是一项观察性研究而非随机对照试验,但它被认为足以作为向当前吸烟者推荐戒烟的依据。在亚组分析中,日本人(综合值:0.65 (0.51-0.83) p-value <0.0004),鳞状细胞癌(综合值:0.60 (0.50-0.72) p-value <0.00001),死亡率(综合值:0.73 戒烟在两项分析中显着降低了食管癌的风险。至于腺癌,积分值为0.93(0.84-1.03),p值=0.18,食管癌风险没有统计学上降低。这些结果表明,戒烟可能会降低患食道癌的风险。
考虑到利弊的平衡、证据的水平和受试者的意愿,建议是“从预防食道癌发展的角度,我们强烈建议健康人戒烟。”
CQ1-2从预防食道癌发展的角度,您是否建议健康人戒酒?
证据强度C。从预防食道癌发展的角度来看,建议健康人戒酒,但不能确定推荐的程度。(我投了两次,但无法决定推荐程度)
评论
文献检索和筛选以与CQ1-1相同的方式进行。
有 18 篇关于饮酒的论文,其中包含可以对此 CQ 进行元分析的信息。关于通过禁欲降低食管癌风险,有两项关于食管癌死亡率的队列研究,均为日本受试者。有 16 项可分析的病例对照研究。五项研究针对日本受试者。分别有 10 项和 5 项研究只能分析鳞状细胞癌和腺癌。
对 18 项关于禁欲的观察性研究进行了荟萃分析,其结果是降低了食道癌的发病率或死亡率。日本(综合值:1.25 (0.87-1.80) p-value = 0.23),鳞状细胞癌(综合值:1.14 (0.97-1.34) p-value = 0.11),死亡率(综合值:0.57 (0.28 -1.16) p 值 = 0.12)和发病率(积分值:1.13 (0.98-1.30) p 值 = 0.10),但没有一项分析表明禁欲会降低患食管癌的风险。至于腺癌,风险因禁欲而增加,综合值为 1.45 (1.08-1.94) p 值 = 0.01。
我们从报告中提取了禁欲期≥5年组和禁欲期≥10年组中可分析的内容,并进行了再分析。我们能够比较6个病例对照研究, 7 项禁欲期为 10 年或更长时间的病例对照研究。对每个结局进行荟萃分析,作为食管癌发病率或死亡率的降低,5 年禁欲期患者的风险比为 0.78,95% CI 0.66-0.93,p 值 = 0.007, 10.每年禁酒期的风险比为0.65,95%CI为0.57-0.74,p值=0.00001,说明一定时期禁酒对食管癌有预防作用。
虽然关于饮酒量与食道癌发病率的报道很多,但一般不知道停止饮酒能预防食道癌的发病,因为乙醇代谢中乙醛的代谢能力等多种因素都与此有关。 . 认为没有明确的证据。但是,有很多报道1-4 )饮酒量在很大程度上参与了食道癌的发展1-4) 。也有报道4 )。
考虑到利弊之间的平衡、证据水平和受试者的意愿,建议是“从预防食道癌的角度,我们弱建议健康人禁欲。”结果,70第一轮投票未获得%同意率。我们又讨论了又投票,但是因为没有得到70%的同意率,所以无法确定推荐率。
参考
1)Sakata K 等人;JACC 研究组:吸烟、饮酒和食道癌:JACC 研究的结果:J Epidemiol. 2005;15 Suppl 2:S212-9。2)Ishiguro S 等人;JPHC 研究组:饮酒、吸烟和潮红反应对食道癌风险的影响:基于人群的队列研究 (JPHC 研究). Cancer Lett. 2009; 275(2): 240-6。3)Ozasa K;日本癌症评估协作队列研究:日本癌症评估协作队列研究 (JACC) 中的酒精使用和死亡率。Asian Pac J Cancer Prev. 2007;8 增刊:81-8。四)Jarl J 等人:戒酒后食道癌风险降低的时间模式——一项荟萃分析。成瘾。2012;107(7):1234-43。
CQ2我们是否应该建议食管癌治愈的患者继续戒烟和戒酒?
证据强度C。强烈建议已治愈的食管癌患者戒烟和戒酒。(同意率95% [19/20])
评论
文献检索和筛选以与CQ1-1相同的方式进行。
我们将初步筛选的文章缩小到 57 篇,二次筛选的文章缩小到 3 篇。与此CQ相关的论文是三项关于食管癌治疗后戒烟的队列研究1-3 )。一项针对 29,796 名接受初始治疗的癌症患者的研究,其中包括 1,027 名日本(大阪)食管癌患者。这项研究表明,戒烟可减少食管癌治疗幸存者的继发性癌症 (IRR 0.49 (95% CI 0.28-0.86)) 1)。Katada 等人还研究了接受内镜切除术并完全治愈的食管癌患者,结果表明戒酒可降低异时性多发癌的风险2)。在这项研究中,短期戒烟并未降低风险。在包括其他癌症在内的报告中,吸烟者和酗酒者患上与饮酒和吸烟相关的继发性癌症的风险更高,并且它们的协同作用。有增加3,4 )。
基于这些发现,预计戒酒和吸烟将降低治疗后食管癌患者发生异时继发性癌症和多种癌症的风险。
综合考虑利弊平衡、证据水平和患者意愿,“强烈建议食管癌完全治愈患者继续戒烟、戒酒”。
参考
1)Tabuchi T 等人:吸烟和癌症幸存者继发原发性癌症的风险:一项回顾性队列研究。Ann Oncol. 2013;24(10):2699-704。2)Katada C 等人:饮酒和多发性发育异常病变会增加食道、头部和颈部鳞状细胞癌的风险。胃肠病学。2016;151(5):860-9。3)Tabuchi T 等人:酒精和烟草使用对癌症幸存者后续癌症发病风险的联合和独立影响:使用癌症登记的队列研究。Int J Cancer. 2015;137(9):2114-23。四)Khuri FR 等人:吸烟状况、疾病阶段和指标肿瘤部位对头颈部类维生素 A 化学预防试验中第二原发性肿瘤发病率和肿瘤复发的影响。Cancer Epidemiol Biomarkers Prev. 2001;10(8): 823- 9.
第三章食管癌治疗算法和基于算法的治疗策略
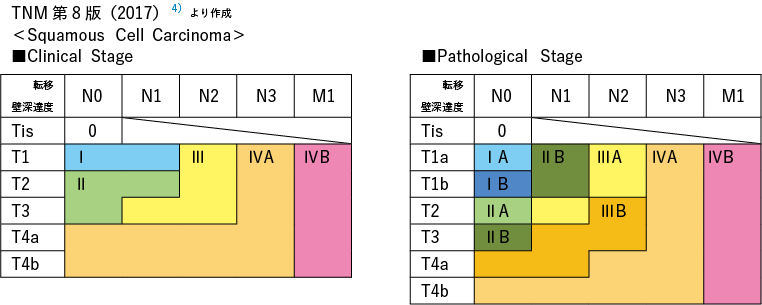
1 食管癌方案和 TNM (UICC) 分类
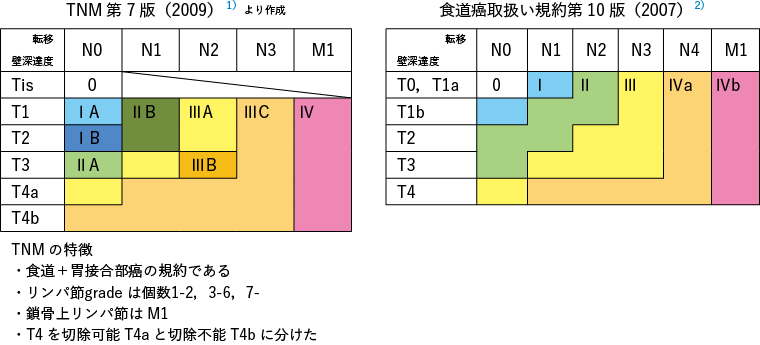
需要注意的是,由于在制定这些指南时引用的参考文献是基于当时的食管癌治疗法规和 TNM(UICC)分类,因此目标疾病阶段存在一些差异。
第8版TNM(UICC)采用基于鳞癌和腺癌预后差异的组织学分类,主要依据欧美治疗结果。在本指南中,分期治疗流程符合日本食管学会第 11 版食管癌治疗规程。

参考
1)编辑:LH Sobin 等,UICC 日本委员会 TNM 委员会 金原出版社,2010 年。2)日本食管学会编:食管癌治疗的临床和病理规则,第 10 版。金原出版社,2007 年。3)日本食道学会编:临床和病理食道癌治疗条例,第 11 版。金原出版社,2015 年。四)JD Brierley 等人(编辑):TNM 恶性肿瘤分类,第 8 版,JOHN WILEY & SONS, LTD.,2017。
2 cStage 0, I 食管癌治疗算法(⇒算法)
包起来
在决定cStage 0和I期食管癌的治疗策略时,第一步是通过内镜检查、颈/胸/腹CT检查、PET检查等评估临床分期。其次,评估壁浸润深度对于确定内镜切除术 (ER)、手术或放化疗的治疗方案很重要。
如果难以评估壁浸润深度,或者患者一般情况不佳,应首先考虑侵入性较小的 ER 指征。当诊断为 cStage 0 (T1a) 并指示 ER 时,需要进行病灶周围评估以预测 ER 后狭窄发展的风险。3/4或更多外周的病变发生ER后狭窄的风险很高,因此需要采取措施预防狭窄。
ER 后组织学评估对于确定是否需要额外治疗非常重要。应观察组织学诊断为 pT1a-EP/LPM 的患者,而诊断为 pT1a-MM/pT1b-SM 的患者应考虑进行额外治疗(手术或放化疗)。如果患者被诊断为cStage I(T1b),应评估患者的手术耐受性,并考虑手术或放化疗的适应症。
临床问题
CQ3对于浅表性食管癌,临床上区分 T1a-EP/LPM 和 T1a-MM 的推荐方法是什么?
证据强度C。在区分 T1a-EP/LPM 和 T1a-MM 时,我们强烈建议使用超声内镜或放大内镜进行仔细检查。(同意率94.7% [18/19])
评论
作为该 CQ 的文献检索结果,PubMed:139 篇,Cochrane:54 篇,Ichushi:166 篇。其中,77篇论文进行了二次筛选,最后13篇论文1-13)进行了定性和定量系统评价。
所有 13 篇论文均来自日本,并且没有对每种方式进行随机对照试验或比较试验。在 13 篇文章中,2篇用于非放大内窥镜检查1,2 ),6 篇用于放大内窥镜检查4-6 ),4 篇用于超声内镜检查 (EUS) 10-13)。我在考虑准确性。在剩下的一个中,放大内窥镜检查3 )在非放大内窥镜检查之后进行。
由于没有直接比较诊断方法的论文,我们使用总结 ROC 曲线比较了每种模式。结果表明,EUS和放大内镜比非放大内镜具有更高的诊断准确性。没有试验能够严格评估将 EUS 与放大内窥镜相结合的附加效果。因此,我们提出“不建议通过 EUS 或放大内镜进行仔细检查”的建议。非放大内窥镜、放大内窥镜和EUS作为医保覆盖的医疗服务被广泛使用,而且成本低、微创,组合使用没有问题。
大多数研究是对前瞻性诊断数据的回顾性分析,只有一项是严格前瞻性的。此外,许多研究被认为在使用 QUADAS(诊断准确性研究的质量评估)的研究质量评估中存在高偏倚风险。综上所述,证据强度为 C。
“使用超声内镜和放大内镜进行详细检查是健康保险可以涵盖的治疗方法。我们弱建议使用超声内镜或放大内镜进行详细检查以进行鉴别诊断。”
参考
1)Hideo Shimada等:[浅表食管癌浸润深度的诊断]从正常观察的角度诊断浅表食管癌浸润深度。胃和肠。2010;45(9):1467-81。2)Chonan A., et al.: [早期食管癌分类及浸润深度] 早期食管癌诊断内镜诊断 疾病分类及浸润深度诊断(通常从内镜的角度)。立即内科。1997;12(12):1705-12。3)Ebi M 等人:单用白光成像对比白光成像的多中心前瞻性试验,然后使用窄带成像放大内窥镜实时成像和诊断浅表食管鳞状细胞癌的浸润深度。 2015;81(6):1355-61。四)Kumagai Y 等人:放大内窥镜检查、立体显微镜检查和浅表性食管癌的微血管结构。内窥镜检查。2002;34(5):369-75。五)Miwako Arima 等:[浅表食管癌浸润深度的诊断] 从 FICE 放大内镜的角度诊断浅表食管癌浸润深度。胃和肠。2010;45(9):1515-25。6)Fujiwara Junko, et al.: [日本食管学会放大内镜分类] 日本食管学会放大内镜分类和侵入深度 B2 血管在诊断侵入深度中的意义。胃和肠。2014;49(2):174-85。7)Oshima T 等人:放大内镜对浅表食管癌的定性诊断和深度诊断的有用性。Prog Dig Endosc。2006;68(2):27-30。8)Miwako Arima 等人:通过放大内窥镜进行切割 放大内窥镜在筛查和诊断食管癌浸润深度中的位置和视角。可拆卸内窥镜。1998;10(4):490-7。9)Akira Dobashi 等:【日本食管学会放大内镜分类】日本食管学会放大内镜分类和浸润深度 B1 血管在浸润深度鉴别诊断中的意义。胃和肠。2014;49(2):153-63。十)Shimizu, Y. 等:浅表食管癌的内镜超声检查。临床病理学。1995;43(3):221-6。11)Esaki M 等人:用于诊断浅表食管癌浸润深度的探针 EUS:凝胶填充法和水填充球囊法的比较. Gastrointest Endosc. 2006; 63: 389-95。12)Yoko Murata:[浅表食管癌2011]浅表食管癌浸润深度的诊断超声内镜。胃和肠。2011;46(5):687-93。13)Miwako Arima 等:[内镜诊断浅表性食管癌的最新进展] 浅表性食管癌深度诊断的进展。放大内镜与 EUS 的意义。胃和肠。2006;41(2):183-96。
CQ4临床上区分浅表性食管癌 T1a-M 和 T1b-SM 的推荐方法是什么?
证据强度C。为了区分 T1a-M 和 T1b-SM,我们强烈建议使用超声内镜或放大内镜进行仔细检查。(100%一致率[19/19])
评论
作为对该 CQ 的文献搜索的结果,PubMed:139 篇文章,Cochrane:54 篇文章和 Ichushi:166 篇文章。初筛共纳入文献377篇,包括浸润深度诊断综述等18篇参考文献。其中,77篇论文进行了二次筛选,最后11篇论文1-11)进行了定性和定量系统评价。
11篇论文中,9篇来自日本1-9) , 1篇来自韩国11 ) ,1篇来自中国10) 。没有随机对照试验,也没有可用于比较方式的试验。11篇文章中,1篇考察了放大内镜的诊断准确性2 ),8篇考察了EUS3-8、10、11 )的诊断准确性。在其余两项研究中,一项在非放大内窥镜检查后进行了放大内窥镜检查和 EUS1 ) ,另一项在放大内窥镜检查后进行了 EUS9 )。
接下来,当使用Summary ROC曲线评估每种方式的诊断准确性时,日本的报告与海外报告之间存在明显差异。由于该系统评价旨在准备日本的指南,因此对来自日本的报告进行了后续分析。
由于没有直接比较诊断方法的论文,我们使用总结 ROC 曲线比较了每种模式。结果显示,放大内镜的诊断准确率高于非放大内镜,EUS的诊断准确率略高于非放大内镜。在日本,由于很难区分 M 和 SM1 癌症,因此发表了许多关于区分 T1b-SM1 和更深层次的癌症和 T1b-SM2 和更深层次的癌症的论文,将 M 和 SM1 癌症归为同一类别。“区分 T1b-SM1 或更深的癌和 T1b-SM2 或更深的癌”与“区分 M 癌和 SM 癌”具有几乎相同的临床意义。在“T1b-SM1 或以下癌症与 T1b-SM2 或以下癌症的鉴别”中,放大内镜和 EUS 比非放大内镜具有更高的诊断准确性这一事实也被用作创建推荐声明的参考。非放大内窥镜、放大内窥镜和EUS作为医保覆盖的医疗服务被广泛使用,而且成本低、微创,组合使用没有问题。
大多数研究是对前瞻性诊断数据的回顾性分析,没有严格的前瞻性研究。此外,许多研究被认为在使用 QUADAS 的研究质量评估中存在高偏倚风险。综上所述,证据强度为 C。
“使用超声波内窥镜和放大内窥镜进行详细检查是健康保险可以涵盖的治疗。因此,我们弱建议使用超声内窥镜或放大内窥镜进行详细检查。”
参考
1)Goda K 等人:用窄带成像放大内窥镜用于预测浅表食管鳞状细胞癌的侵袭深度. Dis Esophagus. 2009;22(5):453-60。2)Kumagai Y 等人:放大内窥镜检查、立体显微镜检查和浅表性食管癌的微血管结构。内窥镜检查。2002;34(5):369-75。3)Yanai H 等人:超声内镜对食管浅表鳞状细胞癌的预后价值和观察者间共识:一项前瞻性研究。Int J Gastrointest Cancer. 2003;34(1):1-8。四)Yanai H 等人:使用配备可切换径向和线性扫描模式的薄超声探头系统对浅表食管癌进行内窥镜超声检查。Gastrointest. Endosc. 1996; 44(5): 578-82。五)Shinkai M 等人:通过超声内镜评估食管鳞状细胞癌的预后。Gut. 2000;47(1):120-5。6)Fukuda M 等人:食管内镜超声检查,World J Surg. 2000;24(2):216-26。7)Kawano T 等人:早期食管癌:使用 Sonoprobe 的内窥镜超声检查。腹部成像。2003;28(4):477-85。8)Hasegawa N 等人:浅表食管癌的术前分期:超声探头和标准超声内镜的比较。浅表食管癌的术前分期:超声探头和标准超声内镜的比较。Gastrointest Endosc. 1996;388-93。9)Miwako Arima 等:[内镜诊断浅表性食管癌的最新进展] 浅表性食管癌深度诊断的进展。放大内镜与 EUS 的意义。胃和肠。2006;41(2):183-96。十)He LJ, et al: 超声内镜对 T1a 和 T1b 食管鳞状细胞癌分期. World J Gastroenterol. 2014; 20(5): 1340-7.11)Jung JI, et al: 影响 EUS 对浅表性食管癌准确性的临床病理因素. World J Gastroenterol. 2014; 20(20): 6322-8.
CQ5是否建议对壁浸润深度被认为是内镜治疗指征的食管癌进行周边评估?
证据强度一个。强烈建议在食管癌治疗前评估周围环境,其壁浸润深度被认为是内镜治疗的指征。(同意率100% [20/20])
评论
经验上已知,对于肿瘤直径较大的食管癌进行内镜治疗时,瘢痕缩小使食管管腔变窄。《治疗指南第2版》指出,内镜治疗的绝对适应症病灶为外周2/3周径以下。
作为对该 CQ 的文献检索的结果,提取了 PubMed:87 篇文章和 Ichushi:96 篇文章。对与内镜治疗相关的原创文章进行了初步和二次筛选,并对3项观察性研究进行了定性和定量的系统评价。
Katada 等人报道,在接受内镜黏膜切除术 (EMR) 的 216 个病灶中,有 13 个病灶出现术后狭窄,所有病灶均切除超过 3/4 周长。1)。Ono 等报道 6 例内镜黏膜下剥离术 (ESD) 围超过 3/4 周长的病例中有 5 例发生术后狭窄。2)。Shi 等人报道,在 34 例 ESD 食管癌病例中,有 32 例周围超过 3/4 周长出现术后狭窄3)。
对这3篇论文的荟萃分析显示,大于3/4周长的患者在接受内镜治疗时发生狭窄的风险高于小于3/4周长的患者,比例为30.93(95%) CI 18.85-50.76) (p 值 <0.001)。
重要的是要预见术后狭窄的可能性。内窥镜检查时的外周评估是一种可以纳入健康保险的治疗,不需要特殊的人工或费用。考虑到利弊之间的平衡、证据的强度和患者的意愿,我们决定在食管癌治疗前对周围进行评估,其壁浸润深度被认为是内镜治疗的指征。强烈推荐。”
参考
1)Katada C 等人:食管浅表病变内镜黏膜切除术后食管狭窄. Gastrointest Endosc. 2003; 57(2): 165-9。2)Ono S 等人:食管内镜黏膜下剥离治疗浅表鳞状细胞肿瘤术后狭窄的预测因子。内窥镜检查。2009;41(8):661-5。3)Shi Q, et al: 食管浅表癌内镜黏膜下剥离术后狭窄的危险因素. 内镜. 2014; 46(8): 640-4.
CQ6食管癌内镜治疗后狭窄的预防措施有哪些?
证据强度一个。为防止食管癌内镜治疗后出现狭窄,我们强烈建议进行预防性球囊扩张、局部注射类固醇或口服类固醇。(同意率90% [18/20])
评论
正如CQ5的建议所述,内镜下治疗周长超过 3/4 周长的食管癌会增加狭窄的风险1-3 ) . 需要采取预防狭窄的措施。
作为对该 CQ 的文献搜索的结果,PubMed:122 篇文章和 Ichushi:61 篇文章被提取。对与内镜治疗相关的原创文章进行了初步和二次筛选,并对一个病例系列和四项观察性研究进行了定性系统评价。
Inoue 等人在 6 例食管周围 ESD 的术后早期进行了预防性球囊扩张,并报告通过反复扩张避免了所有病例的狭窄4)。Ezoe 等人在内镜切除术后 1 周内对 29 名接受内镜切除的食管癌患者 3/4 以上的周长进行了类似的预防性球囊扩张。报告狭窄频率较低5)。
另一方面,Hashimoto 等对 21 例接受环下食管切除术的患者进行术后黏膜下曲安奈德注射,发现狭窄频率明显低于非局部注射组,术后球囊扩张频率明显降低。也少了。报道说6)。Hanaoka 等还对 30 例接受内镜下切除超过 3/4 圆周的食管癌患者(不包括圆周切除病例)进行了切除后黏膜下注射曲安奈德的前瞻性研究,发现疗效相似。7). 此外,Yamaguchi 等人对 19 名进行亚环至环切除术的患者口服泼尼松龙(30 mg/天,减少剂量,持续 8 周),并报告了其对狭窄的预防作用 8 )。
关于这些预防狭窄的方法,在大量的病例中没有比较和检验哪种方法优越的报道。正在进行 JCOG1217 试验,以前瞻性比较曲安西龙黏膜下注射和泼尼松龙口服预防狭窄的疗效,但目前尚不清楚结果。此外,尚未对这些狭窄预防方法的组合进行比较研究。目前,球囊扩张是医保覆盖的唯一方法,但临床上成本相对较低且安全的局部类固醇注射和口服类固醇给药也进行了研究。
人们认为,在出现狭窄症状后,预防狭窄比扩张食道对患者更有益。因此,对于周长超过周长3/4的食管癌行内镜治疗时,强烈建议进行预防性球囊扩张、类固醇局部注射或口服类固醇。然而,虽然并发症发生率尚无全面报道,但仍需充分说明术中预防性球囊扩张穿孔、局部类固醇注射晚期穿孔、口服类固醇全身感染等风险。
参考
1)Katada C 等人:食管浅表病变内镜黏膜切除术后食管狭窄. Gastrointest Endosc. 2003; 57(2): 165-9。2)Ono S 等人:食管内镜黏膜下剥离治疗浅表鳞状细胞肿瘤术后狭窄的预测因子。内窥镜检查。2009;41(8):661-5。3)Shi Q, et al: 食管浅表癌内镜黏膜下剥离术后狭窄的危险因素. 内镜. 2014; 46(8): 640-4.四)Haruhiro Inoue 等人:[食管鳞状细胞癌 ESD 的适应症和实践] 环食管 ESD 和预防性扩张。胃和肠。2009;44(3):394-7。五)Ezoe Y 等人:预防性内镜下球囊扩张治疗内镜下切除后食管狭窄的疗效。J Clin Gastroenterol. 2011;45(3):222-7。6)Hashimoto S 等人:内镜下曲安奈德注射液预防内镜下黏膜下剥离术后食管狭窄的疗效。Gastrointest Endosc. 2011;74(6):1389-93。7)Hanaoka N 等人:病灶内注射类固醇以预防食管癌内镜黏膜下剥离术后狭窄:一项对照前瞻性研究。内窥镜检查。2012;44(11):1007-11。8)Yamaguchi N 等人:口服泼尼松龙治疗浅表食管鳞状细胞癌内镜黏膜下剥离术后食管狭窄的有效性. Gastrointest Endosc. 2011; 73(6): 1115-21。
CQ7如果cStage I食管癌不进行手术,是否应该推荐化疗或放疗?
证据强度C。cStage I 食管癌患者如果不进行手术则不适合内镜切除,强烈推荐放化疗。(同意率84.2% [16/19])
评论
作为该 CQ 的文献检索结果,PubMed:108 篇,Cochrane:18 篇,Ichushi:48 篇。除上述外,6篇文章被认为是必要的,对10篇文章进行了一次和二次筛选后的定性系统评价。没有单独的 cStage I 比较放疗和放化疗的随机对照试验。有一项随机对照试验1 )包括其他阶段和腺癌,以及两项系统评价2,3 )。有两项关于 cStage I 食管癌放化疗的单臂前瞻性研究 4,5 )和一项针对 80 岁及以上患者的 cStage I 和 II 放疗的单臂前瞻性研究6 )。发现仅针对 cStage I 的四项回顾性队列研究(2 项比较两组研究,2 项单组放疗研究)7-10 )。
Cooper 等人进行了一项随机对照试验,比较了 T1-3 N0-1 M0 食管癌的放疗和放化疗1)。在一些非随机试验中,单独放疗的 5 年生存率为 0%,而随机放化疗为 26%。放化疗随机组中有 21% 的患者在治疗过程中没有复发。单独放疗组的 4 级不良事件为 2%,而随机化放疗组为 8%。包括上述研究在内的不限于 cStage I 的两项系统评价均显示放化疗在生存期和无复发生存期方面优于放疗2,3 )。一项系统评价还检查了不良事件,发现放化疗的不良事件明显多于放射治疗(3 级或更高级别的急性期不良事件的风险比:5.16)3)。
在日本一项针对 cStage I 的前瞻性 II 期研究(JCOG9708 研究)中,放化疗(60 Gy,顺铂 + 5-FU)的结果显示完全缓解率为 87.5%,4 年生存率为 80.5%,并且4 年生存率为 80.5%。无复发生存率为 68.1%,未观察到 4 级或更高的不良事件5 )。另一项关于放化疗(55-66 Gy,顺铂+5-FU)加腔内照射(10-12 Gy)的前瞻性研究也显示良好的5年生存率为66.4% 。4)。两项回顾性队列研究比较了 cStage I 食管癌的放化疗和放疗,发现在生存率方面没有显着差异7 , 10)。两项仅针对放疗的回顾性研究发现,5 年生存率范围为 50.4% 至 58.7 % 8,9 )。上述四项回顾性队列研究中的每一项都报告了少量病例(N = 36-68),并且没有针对背景因素进行调整。
综上所述,系统评价的结果不仅限于 cStage I,发现 3 级或更高级别的不良事件增加,但在可接受的范围内,放化疗的生存时间明显长于放疗。因为 JCOG9708 研究等。纳入本研究,显示对放化疗的高反应率,推荐放化疗而不是单独放疗作为 cStage I 食管癌的明确治疗方法。
另一方面,对于不耐受手术的老年人、器官功能障碍患者等并发症风险高的cStage I食管癌患者,需要慎重权衡利弊。
考虑到利弊的平衡、证据的程度和患者的意愿,我们强烈建议对不适合内镜切除且不接受手术的 cStage I 食管癌患者进行放化疗。我推荐它。”
参考
1)Cooper JS 等人:局部晚期食管癌的化学放射治疗:前瞻性随机试验的长期随访 (RTOG 85-01)。放射治疗肿瘤学组。Jama. 1999;281(17):1623-7。2)Wong RK 等人:联合方式放疗和化疗在食管局部癌的非手术治疗中:实践指南。Int J Radiat Oncol Biol Phys. 2003;55(4):930-42。3)Wong R 等人:联合化疗和放疗(无手术)与单独放疗相比局部食管癌。Cochrane Database Syst Rev. 2006;25(1):CD002092。四)Yamada K 等人:临床 I 期 (T1N0M0) 食管癌放化疗的治疗结果 Int J Radiat Oncol Biol Phys. 2006;64(4):1106-11。五)Kato H, et al: A Ⅱ期放化疗治疗Ⅰ期食管鳞状细胞癌的试验: 日本临床肿瘤学组研究 (JCOG9708). Jpn J Clin Oncol. 2009; 39(10): 638-43.6)Kawashima M 等人:对 80 岁或以上胸段食管鳞状细胞癌患者进行放疗的前瞻性试验 Int J Radiat Oncol Biol Phys. 2006;64(4):1112-21。7)Shioyama Y 等人:I 期食管癌放射治疗的临床结果:单一机构经验。Am J Clin Oncol. 2005;28(1):75-80。8)Sasaki T 等人:I 期食管癌患者放疗的治疗结果:单一机构的经验。Am J Clin Oncol. 2007;30(5): 514-9。9)Ishikawa H 等人:I 期 (UICC T1N0M0) 食管鳞状细胞癌的单独放射治疗:手术或联合放化疗的适应症。J Gastroenterol Hepatol. 2006;21(8):1290-6。十)Matsumoto Y. 等:I 期食管癌放疗结果研究。临床放射学。2005;50(7):864-9。
3 cStage II、III 食管癌治疗算法(⇒算法)
包起来
在确定cStage II和III食管癌的治疗策略时,通过CT检查、上消化道内镜检查、PET检查等准确诊断临床分期,然后首先评估患者的一般情况,以确定患者是否耐受手术。决定。如果手术耐受性没有问题,首选术前化疗,然后根治性切除。不进行术前治疗的根治性切除和术前放化疗也是可选的,但如果先行手术,可根据切除标本的组织病理学诊断(尤其是淋巴结转移阳性的患者)给予术后化疗。对不耐受手术但可以接受放化疗或拒绝手术的患者,应考虑根治性放化疗(50 Gy 或以上),如果复发,也应考虑手术切除作为挽救性治疗。对手术不耐受且不适合放化疗、放疗(如肾功能不全患者、老年患者等)、化疗(如有放疗史的患者)、姑息性对症治疗或姑息性治疗的患者治疗 考虑治愈性化疗。
临床问题
CQ8对于cStage II和III食管癌,我们应该推荐基于手术的治疗还是根治性放化疗?
证据强度C。我们强烈建议对 cStage II 和 III 食管癌进行手术治疗。(同意率70% [14/20])
评论
对于 cStage II 和 III 食管癌,根据 JCOG9907 研究的结果推荐术前化疗和手术1 )。另一方面,根治性放化疗也是治疗方法之一。
作为该 CQ 的文献检索结果,PubMed:486 篇,Cochrane:306 篇,Ichushi:167 篇。
已经有三份随机对照试验报告直接比较了手术和明确放化疗的结果2-4 )。但由于所有报道均来自海外,治疗方案与日本不同,日本的治疗政策也大相径庭。
日本根治性放化疗的结果显示在 JCOG9906 单臂 II 期试验中,5 年生存率为 36.8% 5)。
关于观察性研究,已有 10 项研究比较了 cStage II 和 III 期食管癌的手术和根治性放化疗,其中 6 项来自日本6-15)。由于这些试验都不是随机对照试验,因此有许多报道称背景因素和治疗方案与日本目前的标准做法不同。与生存时间相比,10 项研究中有 3 项手术组的总生存时间显着延长。另一方面,只有一篇文章显示确定性放化疗组的总生存期延长。
因此,使用该系统评价的结果很难得出该 CQ 的结论。
关于毒性,在根治性放化疗中,JCOG9906 研究中的晚期毒性为食管炎(3/4 级)13%、心包积液(3/4 级)16%、胸腔积液(3/4 级)9 除了 4%、放射肺炎(3/4 级)发生率为 4%,据报道有 4 人死亡。另一方面,在手术组中,来自日本的 10 项观察性研究中有 6 项报告了与手术相关的死亡率,报告的死亡率为 0-4%。此外,在 JCOG9907 研究中,330 名患者中有 2 名发生了与手术相关的死亡,应该注意的是,根治性放化疗和手术都可能导致严重的不良事件。
如上所述,几乎没有证据表明手术与根治性放化疗相比可以提高总体生存率,并且两种治疗都与某些毒性风险相关。然而,在 JCOG9907 研究中,术前化疗+手术组的 5 年生存率为 55%,而在 JCOG9906 研究中为 37%16 )。此外,对于 cStage II 和III 食管癌,因为许多观察性研究显示手术组有良好的结果。
此外,JCOG0909 试验目前正在进行中,以检查积极手术干预作为抢救手术的有效性,然后进行根治性放化疗治疗 cStage II 和 III 食管癌。如果先行根治性放化疗,还应考虑对残留/复发病灶进行抢救手术的利弊。Tachimori 等人报道,总剂量为 60 Gy 的根治性放化疗后挽救性食管切除术增加了术后并发症发生率并降低了术后住院死亡率,常规手术为 2%,据报道增加到 8% 17)。在JCOG0909研究中,为了减少JCOG9906研究中观察到的不良事件,降低挽救性手术的风险,除了引入三维治疗方案和多场照射外,单次剂量降低至1.8 Gy,总至 50.4 Gy. 的剂量正在改变。本研究已完成患者入组,目前处于观察期,有待研究结果阐明根治性放化疗联合手术多学科治疗的有效性。
“以手术治疗为中心的治疗和根治性放化疗都是健康保险可以承保的治疗。相比之下,我们弱推荐以手术治疗为中心的治疗。”
参考
1)Ando N 等人:一项随机试验比较术后辅助化疗与顺铂和 5-氟尿嘧啶与术前化疗治疗局部晚期食管鳞状细胞癌 (JCOG9907)。Ann Surg Oncol. 2012;19(1): 68-74 .2)Bedenne L 等人:在食管鳞状细胞癌中,先放化疗与单独放化疗的比较:FFCD 9102. J Clin Oncol. 2007; 25(10): 1160-8。3)Chiu PW, et al: 比较标准食管切除术与放化疗治疗鳞状食管癌的多中心前瞻性随机试验:中国大学食管癌研究组 (CURE) 的早期结果. J Gastrointest Surg. 2005; 9(6): 794- 802。四)Stahl M, et al: 局部晚期食管鳞状细胞癌患者的放化疗联合和不联合手术. J Clin Oncol. 2005; 23(10): 2310-7。五)Kato K, et al: 5-氟尿嘧啶和顺铂对 II-III 期食管鳞状细胞癌放化疗的 II 期研究:JCOG 试验 (JCOG 9906). Int J Rad Onol Biol Phys. 2011; 81(3): 684-90.6)Abrams JA 等人:食管切除术与放化疗治疗老年人早期食管癌的比较。Cancer. 2009; 115(21): 4924-33。7)Adams R 等人:英国癌症网络中食管癌多学科治疗与治愈意图的前瞻性比较. Eur J Surg Oncol. 2007; 33(3): 307-13。8)Ariga H 等人:单纯手术和放化疗与选择性手术在可切除的食管鳞状细胞癌中的前瞻性比较。Int J Rad Onol Biol Phys. 2009;75(2):348-56。9)Chan R, et al: Bi-modality (chemo-radiation) vs tri-modality (chemo-radiation after Surgery)treatment for cancer of the esophagus. Dis Esophagus. 2001; 14(3-4): 202-7.十)Hironaka S 等:T(2-3)N(any)M(0) 食管鳞状细胞癌患者根治性放化疗和根治性手术的非随机比较。Int J Rad Onol Biol Phys. 2003;57(2 ):425-33。11)Hsu FM 等人:通过手术和基于紫杉醇的放化疗改善食管鳞状细胞癌的局部控制:回顾性非随机研究的结果. J Surg Oncol. 2008; 98(1): 34-41。12)Matsuda S 等人:经胸食管切除术与根治性放化疗作为初始治疗可耐受经胸食管切除术的食管鳞状细胞癌患者的比较. Ann Surg Oncol. 2015;22(6):1866-73。13)Nagata M 等人:新辅助放化疗后食管切除术与根治性放化疗在可切除的 II/III 期 (T1-3N0, 1M0) 食管鳞状细胞癌中的比较. Esophagus. 2006; 3(3): 105-11.14)Yamashita H 等人:在 82 名日本可切除食管鳞状细胞癌患者中进行根治性放化疗和根治性手术之间的单一机构非随机回顾性比较. Dis Esophagus. 2008; 21(5): 430-6。15)Okada, K.:可切除食管癌的手术和放化疗的比较。久留米医学会杂志。2013;76(8-12):272-83。16)Nomura M 等人:新辅助化疗后手术 (NAC-S) 与明确放化疗 (CRT) 对临床 II/III 期食管鳞状细胞癌 (ESCC) 患者总生存率的比较 (JCOG1406-A)。 . 2017;3 月 17 日:1-7.[Epub 提前印刷]17)Tachimori Y 等人:食管鳞状细胞癌高剂量放化疗后挽救性食管切除术. J Thorac Cardiovas Surg. 2009;137(1):49-54。
CQ9cStage II和III期食管癌在进行以手术为中心的治疗时,推荐术前化疗、术后化疗或术前放化疗哪一种?
证据强度B.cStage II 和 III 期食管癌主要进行手术治疗时: (
1) 术前化疗与术后化疗相比,强烈推荐术前化疗。(同意率89.5% [17/19])证据强度C。(2)在比较术前化疗和术前放化疗时,弱推荐术前化疗。(同意率100% [18/18])
评论
作为对该 CQ 的文献搜索的结果,PubMed:419 篇文章,Cochrane:321 篇文章,Ichushi:98 篇文章和另外 4 篇文章进行了初步筛选,然后进行了定性和定量系统评价。
在比较术前和术后化疗时,JCOG9907 研究调查了顺铂和 5-FU 辅助化疗的时机,显着提高了总生存期。两种治疗方法之间在术后并发症方面没有观察到差异1)。基于这些结果,强烈推荐 cStage II 和 III 期胸段食管癌患者术前化疗顺铂和 5-FU,并被定位为标准治疗 2 )。
接下来,我们比较了术前化疗和术前放化疗。Stahl 等人只有一项随机试验比较了术前化疗和术前放化疗治疗食管胃交界处腺癌的疗效。3 ) 。该研究因病例积累不良而被删减,虽然总生存期终点未显示显着性,但术前放化疗组的 3 年生存率与术前化疗组相比显着延长。术前放化疗可能有用。但是,目标人群是食管胃交界处腺癌,与本次CQ的目标人群不同。
由于术前化疗和术前放化疗之间的比较缺乏得出结论的证据,我们将术前放化疗与单纯手术进行了比较。在日本,尚未进行随机对照试验来检验术前放化疗的重要性)。4-16 在Shapiro 等人16的 CROSS 试验中,术前放化疗组与单纯手术组进行了比较,观察到术前放化疗组的总生存期显着延长。特别是在鳞状细胞癌中,术前放化疗的预后效果显着。Sjoquist 等人17进行的一项荟萃分析比较了术前化疗或术前放化疗与单纯手术治疗,结果表明术前放化疗组的术后生存率显着提高。
在欧洲和美国进行的13 项随机对照试验4-16)中,比较了术前放化疗和单独手术,其中 4项以13-16)5 年生存率作为结果的 在四项随机对照试验中,cStage I和cStage IV都被纳入,化疗中单独使用了卡铂、紫杉醇和顺铂,这与该组的CQ有所不同。
关于与术前治疗相关的毒性,Kumagai 等人 18 )报告说,与术前化疗和术前放化疗相比,术前治疗与单独手术相比,所有食管癌病例的术前治疗死亡率增加。据报道不被接受。然而,当仅限于食管鳞状细胞癌时,有报道称术前放化疗组的术后死亡率和治疗相关死亡率高于单纯手术组。根据Klevebro 等人19)的研究,术前放化疗的术后死亡率和并发症发生率明显高于术前放化疗。
日本目前的标准治疗是顺铂和 5-FU 的术前化疗,但术前放化疗也可能有用。JCOG1109 试验目前正在进行,作为一项随机试验,比较术前三联化疗与多西他赛和术前放化疗与目前的护理标准顺铂和 5-FU 术前化疗。是的,正在等待结果20 )。
术前化疗和术前放化疗都是医保可以覆盖的治疗
。(
1)比较术前化疗和术后化疗,强烈推荐术前化疗。(
2)比较术前化疗和术前放化疗,推荐术前化疗。弱推荐
。 ”
参考
1)Hirao M 等人:术前化疗对晚期胸食管鳞状细胞癌围手术期并发症的影响。Br J Surg. 2011;98(12):1735-41。2)Ando N 等人:一项随机试验比较术后辅助化疗与顺铂和 5-氟尿嘧啶与术前化疗治疗局部晚期食管鳞状细胞癌 (JCOG9907)。Ann Surg Oncol. 2012;19(1): 68-74 .3)Stahl M 等人:术前化疗与放化疗在食管胃交界处局部晚期腺癌患者中的 III 期比较。J Clin Oncol. 2009;27(6):851-6。四)Walsh TN 等人:食管腺癌的多模式治疗和手术的比较。N Engl J Med. 1996;335(7):462-7。五)Tepper J 等人:顺铂、氟嘧啶、放疗和手术三联疗法与单纯手术治疗食管癌的比较 III 期试验:CALGB9781. J Clin Oncol. 2008; 26(7): 1086-92。6)Urba SG 等:局部区域食管癌患者术前放化疗与单独手术的随机试验. J Clin Oncol. 2001; 19(2): 305-13。7)Lee JL 等:可切除食管鳞状细胞癌的术前化疗与超分割放疗加手术与单独手术相比的单一机构 III 期试验。Ann Oncol. 2004;15(6):947-54。8)Burimeister BH 等人:单独手术与放化疗后手术治疗可切除的食道癌:一项随机对照 III 期试验。Lancet Oncol. 2005;6(9):659-68。9)Le Prize E 等人:一项针对局部食管鳞状细胞癌的化学疗法、放射疗法和手术与手术的随机研究。Cancer. 1994; 73(7): 1779-84。十)Apipop C 等:食管癌联合治疗的前瞻性研究。肝胃肠病学。1994;41(4):391-3。11)Nygaard K 等人:术前放疗延长可手术食管癌的生存期:术前放疗和化疗的随机多中心研究。第二次斯堪的纳维亚食管癌试验。World J Surg. 1992;16(6): 1104- 9:讨论 1110。12)Lv J, et al: 围手术期放化疗对食管鳞状细胞癌的长期疗效. World J Gatroenterol. 2010; 16(13): 1649-1654.13)Bosset JF E 等人:在食管鳞状细胞癌中,化疗后手术与单独手术相比。N Engl. J Med. 1997;337(3):161-7。14)Natsugoe S 等人:在单一机构中对术前放化疗后单独手术治疗食管鳞状细胞癌进行随机对照研究。食管疾病。2006;19(6):468-72。15)Mariette C 等人:I 期和 II 期食管癌的单独手术与放化疗后手术:随机对照 III 期试验的最终分析 FFCD 9901. J Clin Oncol. 2014;32(23):2416-22。16)Shapiro J 等人:新辅助放化疗加手术与单纯手术治疗食管癌或结节癌 (CROSS):一项随机对照试验的长期结果。Lancet Oncol. 2015;16(9):1090-8。17)Sjoquist K 等人:可切除食管癌新辅助化疗或放化疗后的生存率:更新的荟萃分析。Lancet Oncol. 2011;12(7):681-92。18)Kumagai K 等人:接受新辅助化疗或放化疗治疗可切除食管和胃食管交界癌患者术后发病率和围手术期死亡率的 Meta 分析。Br J Surg. 2014;101(4):321-38。19)Klevebro F 等人:食管癌和胃食管结合部癌手术后的发病率和死亡率:新辅助化疗与新辅助放化疗的随机临床试验。Eur J Surg Oncol. 2015;41(7):920-6。20)Nakamura K 等人:比较顺铂加 5-FU 与多西他赛、顺铂加 5-FU 与 CF 放疗 (CF-RT) 作为局部晚期食管癌术前治疗的三臂 III 期试验(JCOG1109,NExT 研究)。 Jpn J Clin Oncol. 2013;43(7): 752-5。
CQ10如果 cStage II 或 III 期食管癌进行新辅助治疗和手术,是否推荐术后辅助治疗?
证据强度D.如果 cStage II 或 III 胸段食管鳞状细胞癌进行新辅助治疗和手术,强烈建议不要进行术后化疗。(同意率85% [17/20])
评论
对于cStage II和III期胸段食管癌,JCOG9204研究首先证明术后化疗优于单纯手术1 ),其次是JCOG9907研究,证明术前化疗优于术后化疗。2)术前化疗加手术是目前日本的标准治疗。然而,在术前化疗后进行手术时,术后化疗的有效性尚未得到充分验证。
PubMed:315 篇文章、 Cochrane:188 篇文章和对研究Ichushi:633 篇文章作为该 CQ 的文献搜索结果进行筛选。4)进行了定性系统评价。
日本国内尚无随机对照试验,国外报道了一项随机对照试验。对于可切除的食管鳞状细胞癌,术前化疗后行根治性手术,术后辅助化疗(A组:175例)和未行辅助化疗组(B组:175例)171例)与复发-以无复发生存为主要终点,A组5年无复发生存率为35.0%,B组为19.1%,风险比为0.62,p值<0.0013 )。但在本报告中,方法和化疗与日本不同,并没有描述术前分期。在欧洲,对腺癌进行术前和术后化疗5 , 6)。
一般来说,由于不良事件的发生率高,术后化疗的完成率较低,2,5,6 ) ,目前还不能判断术后化疗的益处是否优越。
术后化疗属于医保范围内的治疗,但考虑到利弊的平衡、证据的强度和患者的意愿,对于cStage II和III期胸段食管鳞状细胞癌,建议进行新辅助治疗+手术。 . 如果是这样,我们强烈建议不要进行术后化疗。”
参考
1)Ando N 等人:手术加化疗与单独手术治疗胸段食管局部鳞状细胞癌的比较:日本临床肿瘤学组研究--JCOG9204. J Clin Oncol. 2003; 21(24): 4592-6。2)Ando N 等人:一项随机试验比较术后辅助化疗与顺铂和 5-氟尿嘧啶与术前化疗治疗局部晚期食管鳞状细胞癌 (JCOG9907)。Ann Surg Oncol. 2012;19(1): 68-74 .3)Zhao Y 等:可切除食管鳞状细胞癌患者的围手术期与术前化疗与手术:III 期随机试验. J Thorac Oncol. 2015; 10(9): 1349-56.四)Ardalan B 等人:食道癌的新辅助、手术和无放射辅助化疗。Jpn J Clin Oncol. 2007;37(8):590-6。五)Cunningham D 等人:围手术期化疗与单独手术治疗可切除的胃食管癌。N Engl J Med. 2006;355(1):11-20。6)Ychou M 等人:围手术期化疗与单独手术治疗可切除胃食管腺癌的比较:一项 FNCLCC 和 FFCD 多中心 III 期试验。J Clin Oncol. 2011;29(13):1715-21。
CQ11如果 cStage II 或 III 食管癌在没有术前治疗的情况下进行手术,是否推荐术后化疗?
证据强度C。cStage II 和 III 期食管癌不进行术前治疗,不建议进行手术,如果组织病理学结果为淋巴结转移阳性,则进行术后化疗。(同意率85% [17/20])
评论
在日本,根据 JCOG9907 研究结果,建议 cStage II 和 III 期胸段食管癌行术前顺铂联合 5-FU 化疗,然后行根治性手术。然而,在临床实践中,当因狭窄而难以进食或存在干扰化疗的因素时,根据患者的情况进行单独手术或术后化疗。此外,在诊断为 cStage I 的情况下进行手术后,有时会出现 pStage II 或 III。因此,有必要在手术前检查术后化疗的必要性。
作为对该 CQ 的文献搜索的结果,PubMed:260 篇文章,Cochrane:258 篇文章和 Ichushi:132 篇文章进行了初步筛选。二次筛选后,我们对三项随机对照试验进行了定性和定量系统评价1-3 )。所有三项随机对照试验均具有低偏倚风险且无不一致之处。然而,pStage IV 病例被纳入,长春地辛被用作术后化疗。因此,在任何一项随机对照试验中,术后化疗都没有提高 5 年生存率,而一项使用三项随机对照试验的荟萃分析显示了相似的结果 4 )。
在 JCOG8806 研究中(术后顺铂+长春地辛 2 疗程组与单纯手术组的比较),未观察到 5 年生存率有显着差异,术后化疗未增加生存率 1 )。随后在JCOG9204研究中(术后顺铂+5-FU 2个疗程组与单纯手术组的比较),虽然总生存率差异不明显,但术后化疗5年无复发生存率明显更高组。授予延期。特别是在淋巴结转移病理阳性的患者中,观察到无复发生存期延长2)。另一方面,在病理淋巴结阴性患者中未观察到无复发生存期延长。在法国进行的一项术后化疗随机试验(比较术后顺铂加 6-8 个疗程的 5-FU 与单独手术)中,约一半的患者接受了姑息性切除术,但据报道中位生存期无差异两组,术后顺铂联合 5-FU 化疗无效3 )。基于这三项随机对照试验的荟萃分析也显示风险比为 0.95(0.78-1.15)(p 值 = 0.59),表明术后化疗并未提高生存率。
迄今为止,JCOG临床试验中单纯手术组的远期结果已大大超过欧美临床试验中手术+辅助治疗组的结果。这被认为是比较日本和欧美的临床试验结果时需要注意的一点。
如上所述,没有证据表明术后化疗可以提高根治性切除患者的总体生存率。此外,与单纯手术相比,术后化疗虽然发生率较低,但仍有一定的治疗相关死亡和不良事件发生率。在 JCOG9204 研究中,与术后化疗相关的 3 级或更高级别的不良事件为贫血(1.7%)、白细胞减少(4.2%)、粒细胞减少(15.8%)、血小板减少(2.5%)和恶心/呕吐(8.3%),腹泻 (2.5%) 和 4 级或更高级别的不良事件,例如粒细胞减少 (2.5%)、心律失常 (0.8%)、感染 (0.8%) 和发热 (0.8%)。然而,JCOG9204试验显示无复发生存期显着改善,尤其是在病理性淋巴结转移患者中,并证明术后化疗可延长无复发生存期。根据日本的证据,术后化疗(顺铂+5-FU,2个疗程)对未经术前治疗进行根治性切除的淋巴结阳性患者延长术后无复发生存期无显着意义。 .
"
参考
1)Ando N 等人:一项针对胸段食管局部鳞状细胞癌联合和不联合化疗的随机手术试验:日本临床肿瘤学组研究. J Thorac Cardiovasc Surg. 1997; 114(2): 205-9。2)Ando N 等人:手术加化疗与单独手术治疗胸段食管局部鳞状细胞癌的比较:日本临床肿瘤学组研究--JCOG9204. J Clin Oncol. 2003; 21(24): 4592-6。3)Pouliquen X 等人:食管鳞状细胞癌姑息性手术切除后的 5-氟尿嘧啶和顺铂治疗。一项多中心随机试验。法国外科研究协会。Ann Surg. 1996;223(2):127-33。四)Zhang SS, et al: 食管鳞状细胞癌的辅助化疗与单独手术:随机对照试验和非随机研究的荟萃分析. Dis Esophagus. 2014; 27(6): 574-84.
CQ12对于 cStage II、III 和 IVa 食管癌,如果在根治性放化疗后获得完全缓解,是否应该推荐额外的化疗?
证据强度C。对于 cStage II、III 和 IVa 食管癌,如果在根治性放化疗后获得完全缓解,则不建议额外化疗。(同意率90% [18/20])
评论
作为该CQ的文献检索结果,PubMed:351篇,Cochrane:22篇,Ichushi:144篇,添加1篇。25篇论文在初筛中被提取,4篇论文在二次筛选中被提取1-4 )。没有试验将额外化疗与完全缓解后的观察进行比较。因此,我们选择了四项关于明确放化疗的大规模研究,并进行了定性系统评价。
所有四项试验中的放化疗包括放疗和同步化疗,然后是两个额外的化疗疗程(顺铂加 5-FU)。在日本进行的两项研究中,在额外化疗之前评估了治疗效果,并且仅在达到部分或完全缓解时才进行额外化疗。预计不良事件会随着额外的化疗而增加,尽管没有明确的证据表明存在差异。
没有证据表明在同步放化疗后完全缓解后增加额外的化疗,其意义尚未明确。然而,之前确立目前放化疗治疗的大规模临床试验包括两个疗程的附加化疗,被认为是国际标准。但是,需要适当谨慎,因为根据患者的情况,危害可能大于益处。保险范围内提供 2 个疗程的额外化疗。
考虑到利弊的平衡、证据的水平和患者的意愿,建议是“如果 cStage II、III 或 IVa 食管癌在根治性放化疗后获得完全缓解,则应给予额外的化疗. 我强烈建议这样做。”
参考
1)Cooper JS 等人:局部晚期食管癌的化学放射治疗:前瞻性随机试验的长期随访 (RTOG 85-01)。放射治疗肿瘤学组。Jama. 1999;281(17):1623-7。2)Minsky BD 等人:INT 0123(放射治疗肿瘤学组 94-05)食管癌联合治疗的 III 期试验:高剂量与标准剂量放射治疗。J Clin Oncol. 2002;20(5): 1167-74。3)Ohtsu A 等人:针对 T4 和/或 M1 淋巴结鳞状细胞癌的确定性放化疗。J Clin Oncol. 1999;17(9):2915-21。四)Kato K, et al: Phase II study of radiotherapy with 5-fluorouracil andcisplatin for Stage II-Ⅲ esophageal squamous cell cancer: JCOG trial (JCOG 9906). Int J Radiat Oncol Biol Phys. 2011; 81(3): 684-90.
4 cStage Ⅳ期食管癌治疗流程(⇒流程)
包起来
在确定 cStage IV 食管癌的治疗策略时,与其他 cStages 一样,通过 CT、胃肠内镜、PET 等进行准确的临床分期以及对 PS 的评估非常重要。
当 PS 良好时,放化疗是有望治愈 cStage IVa 食管癌的治疗选择之一。但放化疗后残体抢救手术可能会增加手术相关死亡人数,需充分考虑利弊平衡,综合判断。化疗是cStage IVb食管癌的主要治疗方法,由于癌症已超出局部区域,因此需要全身治疗。
另一方面,当PS较差时,以姑息性对症治疗为主。然而,在 cStage IVa 的情况下,放射治疗可有效改善食管癌引起的吞咽困难,并且在某些情况下获得了长期生存,尽管它与某些不良事件有关。
临床问题
CQ13cStage IVa 食管癌是否应该推荐放化疗?
证据强度C。我们强烈建议对 cStage IVa 食管癌进行根治性放化疗。(同意率85% [17/20])
评论
作为该CQ的文献检索结果,PubMed:204篇,Cochrane:114篇,Ichushi:145篇,添加1篇。初筛提取49篇文章,二次筛选提取6篇文章进行定性系统评价。在 6 项研究中,1 项是一项相对陈旧且质量较低的以 CQ 为目的的随机对照试验,5 项是针对根治性放化疗的。
根治性放化疗是不可切除的局部晚期食管癌的潜在治愈性治疗选择之一。另一方面,众所周知,对放化疗的反应可能会导致致命的并发症(肿瘤穿孔/穿透)。基于JCOG0303研究的结果,在日本,根治性放化疗常被选择作为PS良好的不可切除的局部晚期食管癌的治疗方法,我们比较了比例(缺点)并检验了这种治疗方法的有效性。
尽管作为治疗结果的长期生存数据很少,但据报道 2 年或 3 年生存率约为 20-30% 1-3),这表明实现长期生存的患者比例为大约 15-20%。假定存在。此外,每份报告都包含一定数量的 PS2 患者,一个共同的特点是,与健康时相比体重减轻等因素与 PS 差相关的患者预后较差。幸存者包括高比例的良好 PS 患者。另一方面,在大约 10-20% 的患者中观察到致命并发症(穿孔/穿透),这是在 cStage IVa 患者中引入治疗的风险因素4 )。
其中一篇摘录的论文是对不可切除的局部晚期食管癌的单一放疗和放化疗的比较1)。被认为是一项相当陈旧且质量低下的随机对照试验,应该注意的是,放疗/化疗方案与目前的方案有显着差异,但结果是,两组之间的生存率没有差异。在其他五项研究中,三项是放化疗的单组前瞻性研究 2,3,5 ) ,两项是诱导化疗后放化疗的单组前瞻性研究 6,7 )(注: JCOG0303
虽然没有数据直接比较明确化放疗与其他治疗方案(不治疗、单独放疗或单独化疗)对于 cStage IVa 食管癌具有良好 PS 的治疗方法,但它被认为是一种可以预期导致永久性的治疗方法一定比例的患者治愈和长期生存。顺铂+5-FU治疗是本文引用的论文中使用的主要化疗方案,在日本的保险范围内实施是可能的。但是,在引入这种治疗方法时,不可避免地存在约10%至20%的致命并发症风险,是应在医患双方就治疗的优缺点进行充分讨论后选择的治疗方法。 .
基于上述结果,综合考虑利弊平衡、证据程度和患者意愿,建议为“我们弱推荐cStage IVa食管癌根治性放化疗”。
参考
1)Slabber CF 等人:单独放疗与放疗加 5-氟尿嘧啶和铂在无法手术的局部晚期食管鳞状细胞癌患者中的随机研究。Am J Clin Oncol. 1998;21(5):462-5。2)Shinoda M 等人:低剂量与标准剂量放化疗治疗不可切除食管鳞状细胞癌的随机研究 (JCOG0303). Cancer Sci. 2015; 106(4): 407-12。3)Ishida K 等人:顺铂和 5-氟尿嘧啶联合放疗治疗晚期食管鳞状细胞癌的 II 期研究:日本食管肿瘤学组 (JEOG)/日本临床肿瘤学组试验 (JCOG9516)。Jpn J Clin Oncol。 2004 年 34(10):615-9。四)Tsushima T 等人:局部晚期不可切除食管癌放化疗相关食管瘘的危险因素:JCOG0303 的补充分析。医学(巴尔的摩)。2016;95(20):e3699。五)Higuchi K 等人:多西紫杉醇、顺铂和 5-氟尿嘧啶 (DCF-R) 在晚期食管癌中的确定性放化疗:2 期试验 (KDOG 0501-P2)。Int J Radiat Oncol Biol Phys. 2014;89 ( 4):872-9。6)Tomblyn MB 等人:西妥昔单抗联合顺铂、伊立替康和胸部放疗作为局部晚期不可切除食管癌的明确治疗:SWOG 的 II 期研究 (S0414)。J Thorac Oncol. 2012;7(5):906 -12。7)Chiarion SV 等人:多西他赛、顺铂和氟尿嘧啶的 II 期试验,随后是卡铂和放射治疗局部晚期食管癌。Br J Cancer. 2007;96(3):432-8。
CQ14对于 PS 较差的 cStage IVa 食管癌,是否应该推荐放射治疗?
证据强度D.对于 PS 较差的 cStage IVa 食管癌,我们弱推荐放疗。(同意率95% [19/20])
评论
对该CQ进行文献检索,从PubMed 386篇、Ichushi 150篇、Cochrane 139篇中,初步筛选出38篇论文,并在二次筛选中对内容进行了审查,最终提取了4篇论文和进行了定性系统评价。
有两份关于 cStage IVa 放化疗的报告。两份报告分别作为单中心和多中心 II 期试验进行。所有研究均来自日本的报道,其中 60 Gy/30 Fr 放疗,2 周休息期联合顺铂和 5-FU 化疗。来自 54 名患者的单中心报告显示,反应率为 87%,中位生存时间为 9 个月,2 年总生存率为 23%,3 级或更高级别的白细胞减少和血小板减少分别为 24% 和 28% , 分别. 还观察到一定程度的毒性, 穿孔发生率为 9% 1)。一项包含 60 名患者的多中心研究报告显示,缓解率为 68%,中位生存时间为 305.5 天,2 年总生存率为 31.5%,4 级或更高毒性为 8.3%,治疗相关死亡为 3.4% 2)。虽然两者都有一些不良事件,但都获得了良好的生存结果。然而,由于 PS 的细节未知或较差的 PS 很少被包括在内,因此作为该 CQ 的目标的较差 PS 的放化疗的意义尚不清楚。此外,PS差时一般难以进行放化疗。
在使用腔内照射的两项比较试验中,一项比较了两种不同的腔内照射方案3 ),另一项是在腔内照射中是否添加外部照射的比较试验)。4 在所有研究中,均获得了良好的缓解效果,6 个月后可吞咽的存活率为 50% 或更高(中位数约为 7 个月)。然而,所有研究均针对 PS 最高为 2 的患者,对于 PS 较差的患者进行腔内照射的意义尚不清楚。此外,在一项比较两种腔内照射方案的研究中 3 ),在多变量分析中,PS 被报告为可吞咽存活率的重要因素。然而,日本很少进行腔内照射,这些结果与该 CQ 没有直接关系。
综上所述,有报道称放化疗和放疗对cStage Ⅳa食管癌有效,但这些报道仅适用于PS未知或PS良好的病例,在日本很少使用。并且没有直接证据证明其有效性。另一方面,放射治疗已被定性证明可有效改善食管癌引起的吞咽困难,尽管有某些不良事件,一些患者仍能存活很长时间。此外,在临床实践中,患者通常强烈希望能够长期存活的治疗。所有治疗都包含在健康保险中。
考虑到利弊的平衡、证据的程度和患者的意愿,建议是“我们弱推荐对 PS 较差的 cStage IVa 食管癌患者进行放射治疗。”
参考
1)Ohtsu A 等人:针对 T4 和/或 M1 淋巴结鳞状细胞癌的确定性放化疗。J Clin Oncol. 1999;17(9):2915-21。2)Ishida K 等人:顺铂和 5-氟尿嘧啶联合放疗治疗晚期食管鳞状细胞癌的 II 期研究:日本食管肿瘤学组 (JEOG)/日本临床肿瘤学组试验 (JCOG9516)。Jpn J Clin Oncol。 2004 年 34(10):615-9。3)Sur RK 等人:HDR 近距离放射治疗作为晚期食管癌姑息治疗的唯一方式的前瞻性随机试验——一项国际原子能机构的研究。Int J Radiat Oncol Biol Phys. 2002; 53(1): 127-33。四)Sur R 等人:比较高剂量率腔内近距离放射治疗 (HDRILBT) 与 HDRILBT 和外照射放射治疗在晚期食管癌姑息治疗中的随机前瞻性研究。近距离放射治疗。2004;3(4):191-5。
转贴CQ12对于 cStage II、III 和 IVa 食管癌,如果在根治性放化疗后获得完全缓解,是否应该推荐额外的化疗?
证据强度C。对于 cStage II、III 和 IVa 食管癌,如果在根治性放化疗后获得完全缓解,则不建议额外化疗。(同意率90% [18/20])
评论
参考第三章食管癌治疗算法及基于算法的治疗策略3
.cStage II, III CQ12
CQ15cStage Ⅳa食管癌,放化疗后仍有残留,是否建议进行手术治疗?
证据强度D.对于cStage Ⅳa食管癌,如果放化疗后仍有残留,我们强烈建议不要进行手术治疗。(同意率85% [17/20])
评论
作为该CQ的文献检索结果,PubMed:290篇,Cochrane:27篇,Ichushi:117篇,新增2篇。初筛抽取42篇论文,二次筛选抽取2篇论文,进行定性系统评价。
我们对在初始治疗中不适合手术切除的 cStage IVa 患者进行了根治性放化疗,并调查了由于残余物的反应而可能切除时增加手术治疗的有用性。没有比较手术与非手术治疗的试验根治性放化疗后。因此,我们决定将在根治性放化疗后进行手术治疗的两篇文章的治疗结果与日本主要非手术治疗的治疗结果进行比较。
这两项提取的研究都是回顾性观察研究,其中 cStage IVa 患者(主要是 T4b 病例)接受了 50 Gy 或以上的根治性放化疗,然后进行了手术治疗。在意大利的一份报告中,51 名受试者中有 96.1% 接受了手术治疗,其中 39.2% 为 R0 切除。R0切除患者的预后往往优于R1/2切除患者,但总体中位生存期为11.1个月,3年生存率为8.8%,5年生存率为5.9% 。1). 手术相关死亡率为 10.2%。另一方面,在日本的一份报告中,在37名受试者中,达到完全临床反应的受试者进行了随访,只有13名对放化疗达到反应的受试者接受了手术,其中12名R0。2 )。与意大利的报告相似,R0切除患者的预后往往优于R1/2切除患者,生存率为35%,5年生存率为23%。没有提到与手术相关的死亡。
根据JCOG0303研究结果,日本目前cStage IVa食管癌的标准治疗是使用顺铂+5-FU的标准放化疗(顺铂:第1天70 mg/m2,5 - FU:700 mg/m2)。2天 1-4,每 4 周 x 2 个疗程,60 Gy/30 Fr)。在 JCOG0303 研究中标准放化疗组的 71 名患者中,12 名患者(约 17%)在方案治疗后因残留或复发接受了手术治疗 3 )。整个试验的中位生存期为13个月,1年生存率为56.8%,3年生存率为27.6%,同时进行了针对R0切除的手术治疗。另一方面,如上所述,手术相关的死亡有增加的可能性,在进行手术治疗时,需要考虑利弊的平衡,综合判断。
由于本次CQ的治疗干预为手术治疗,可在医保覆盖的医疗服务范围内实施。
在比较 Study JCOG0303 和上述两项研究的治疗结果时,(1) Study JCOG0303 是一项临床研究,包括许多病情较稳定的患者;需要考虑复发后手术结果和治疗方案的差异. 然而,根治性照射后的手术确实具有高度侵入性,并且存在术后并发症和治疗相关死亡的风险。考虑利弊,目前尚无充分证据表明积极的手术干预可以改善患者的预后和生活质量,如果放化疗后仍存在,弱建议不要进行手术治疗。目前,计划对该受试者进行一项比较研究(JCOG1510 研究),以比较作为标准治疗的根治性放化疗与在强化诱导化疗后可切除的患者的切除。
参考
1)de Manzoni G, et al: 放化疗后手术治疗胸段食管鳞状细胞癌并伴有邻近器官侵犯的临床证据. J Surg Oncol. 2007; 95(3): 261-6。2)Ikeda K 等人:化学放射治疗后手术治疗可能或实际上累及邻近器官的胸食管癌. Dis Esophagus. 2001; 14(3-4): 197-201。3)Shinoda M 等人:低剂量与标准剂量放化疗治疗不可切除食管鳞状细胞癌的随机研究 (JCOG0303). Cancer Sci. 2015; 106(4): 407-12。
CQ16cStage Ⅳb 您推荐食管癌化疗吗?
证据强度C。我们弱推荐 cStage IVb 食管癌的化疗。(同意率85% [17/20])
评论
对该CQ进行文献检索,提取PubMed:401篇,Cochrane:372篇,Ichushi:76篇,并添加1篇。初筛提取论文43篇,二次筛选提取论文41篇。其中,3 项是关于 CQ 目的的随机对照试验,35 项包括评估化疗干预的益处和危害的研究。对这些进行了定性系统评价。
在该受试者中,只有一项在未治疗组和化疗组之间进行的随机对照试验,将安慰剂与吉非替尼作为二线治疗进行比较1 )。该试验并未显示吉非替尼优于安慰剂。在使用其他药物的II期试验中,顺铂+5-FU联合治疗作为一线治疗的反应率约为30%,中位生存时间为6.6-9.5个月2-5),这是标准治疗. 公认的。一项 5-FU 和奈达铂联合治疗的 II 期试验也报道了顺铂替换为奈达铂的反应率为 39.5%,中位生存时间为 8.8 个月。6)。两者都包含在健康保险中。
在二线治疗中,紫杉醇 100 mg/m 2每周给药 6 次,每 7周重复一次。每 3 周70 mg/m 2的多西他赛单药治疗的反应率为 16%,但中位生存时间为 8.1 个月 8 )。在 PS 良好的患者中不良事件是可以接受的,但在 10% 至 20% 的接受多药治疗的患者中观察到 3 级或更高的严重不良事件,即使在表现良好的患者中也需要谨慎。当出现神经病变、味觉障碍等影响日常生活的不良事件时,需要在考虑患者生活质量的同时决定是否继续治疗。
这些临床试验主要招募了 PS0-1 且经常保留器官功能的患者。尽管没有对此类主题进行明确的比较研究,但推测可以在一定程度上获得预后效果。没有证据表明对 PS 较差的受试者进行化疗,因此不推荐使用,因为目前没有证据支持其疗效。PS较差的患者首先接受姑息性对症治疗,如果观察到改善,他们可能是化疗的候选者。
考虑到利弊之间的平衡、证据的程度和患者的意愿,建议是“我们弱推荐 cStage IVb 食管癌的化疗。”
参考
1)Dutton SJ 等人:吉非替尼治疗化疗后进展的食管癌 (COG):一项 3 期、多中心、双盲、安慰剂对照随机试验。Lancet Oncol. 2014;15(8): 894-904。2)Iizuka T 等人:顺铂和 5-氟尿嘧啶在晚期食管鳞状细胞癌中的 II 期评估:日本食管肿瘤学组试验。Jpn J Clin Oncol. 1992;22(3):172-6。3)Hayashi K 等人:在晚期食管鳞状细胞癌中长期输注顺铂和 5-氟尿嘧啶的 II 期评估:日本食管肿瘤学组 (JEOG) 试验 (JCOG9407)。Jpn J Clin Oncol. 2001;31 (9 ):419-23。四)Bleiberg H 等人:顺铂和 5-氟尿嘧啶 (5-FU) 与单独顺铂治疗晚期鳞状细胞食管癌的随机 II 期研究。Eur J Cancer. 1997;33(8):1216-20。五)Lorenzen S 等人:西妥昔单抗联合顺铂 5-氟尿嘧啶与单用顺铂 5-氟尿嘧啶治疗食管转移性鳞状细胞癌的一线治疗:Arbeitsgemeinschaft Internistische Onkologie 的随机 II 期研究。Ann Oncol. 2009;20(10) : 1667-73。6)Kato K,et al ;日本临床肿瘤学组 (JCOG) 的日本食管肿瘤学组:奈达铂和 5-氟尿嘧啶治疗食管转移性鳞状细胞癌的 II 期研究:日本临床肿瘤学组 (JCOG) 试验( JCOG 9905-DI). 食道. 2014; 11(3): 183-8.7)Kato K, et al: 每周 1 小时输注紫杉醇治疗先前接受铂类化疗的晚期或复发性食管癌患者的 II 期研究. Cancer Chemother Pharmacol. 2011; 67(6): 1265-72.8)Muro K 等:转移性食管癌患者单药多西他赛的 II 期研究. Ann Oncol. 2004;15(6):955-9。
CQ17对于 cStage IVb 食管癌伴梗阻,您是否推荐姑息性放疗?
证据强度C。对于阻塞性 cStage IVb 食管癌,我们强烈推荐姑息性放射治疗。(同意率100% [20/20])
评论
本次CQ文献检索结果,从PubMed:302篇,Ichushi:46篇,Cochrane:79篇,初筛中提取了29篇论文,在二次筛选中对内容进行了审查,最终得到3篇和1篇提取摘要并进行定性系统评价。
在一篇报告 cStage IVb 姑息性放化疗结果的论文中,顺铂 + 5-FU 被给予 40 名 cStage IVb 食管癌患者吞咽困难和 PS2 或更低(40 名患者中有 38 名 PS1 或更低)。40 Gy/20 Fr 放化疗和 尽管观察到了血液毒性,但已报道了相对有利的治疗结果,中位生存期为 308 天,1 年生存率为 45%,在可接受的范围内。5% 死亡1 )。
在 cStage IVb 和 cStage III 合并吞咽困难且不能接受手术的患者中进行单独放疗和放化疗的比较研究2 )是一项随机对照试验,尽管它只是摘要。因为它几乎与重庆。目标PS未知。本研究在 220 名患者中比较了 35 Gy/15 Fr 或 30 Gy/10 Fr 的姑息性照射与顺铂和 5-FU 放化疗的相同照射方案。姑息性放疗组和放化疗组吞咽困难改善率分别为68%和74%,差异无统计学意义,放化疗组胃肠道毒性(恶心、呕吐)明显升高。姑息性放疗组中位生存时间为203天,放化疗组为210天,差异无统计学意义。
有两份报告比较了放射治疗和金属支架的治疗效果3,4 )。在两份报告中,支架组的吞咽改善较早,但放疗组(腔内照射)的吞咽改善持续时间更长。这些报告使用了在日本很少使用的腔内照射,并且与此 CQ 没有直接关系。
综上所述,虽然存在一定的不良事件,但放射治疗对改善吞咽困难有效,且不良反应往往并不严重。吞咽困难患者一般有强烈的改善症状的愿望,治疗由医疗保险支付。考虑到利弊之间的平衡、证据的程度和患者的意愿,建议是“我们弱建议对 cStage IVb 食管癌伴通道阻塞进行姑息性放射治疗。”
参考
1)Ikeda E 等人:同步放化疗作为 IVB 期食管癌患者吞咽困难的姑息治疗的疗效。Jpn J Clin Oncol. 2011;41(8):964-72。2)MG Penniment 等人:晚期食管癌的最佳实践:跨塔斯曼放射肿瘤学组 TROG 03.01 和 NCIC CTG ES 的报告。2 晚期食管癌 (OC) 比较生活质量 (QOL) 和姑息治疗的多国 3 期研究接受放射治疗 (RT) 或放化疗 (CRT) 治疗的患者吞咽困难的研究. Int J Radiat Oncol Biol Phys. 2014;90(1): Supplement S3。3)Bergquist H 等人:支架插入或腔内近距离放射治疗作为晚期食管癌和胃食管交界处癌症患者的姑息治疗。随机对照临床试验的结果。Dis Esophagus. 2005;18(3):131-9。四)Homs MY 等人:单剂量近距离放射治疗与金属支架置入缓解食管癌吞咽困难:一项多中心随机试验。柳叶刀。2004;364(9444):1497-504。
第四章 内镜治疗
包起来
内窥镜切除术 (ER) 包括内窥镜黏膜切除术 (EMR),其中使用圈套器、IT 刀、钩刀等抓住或抽吸损伤的黏膜并切除。有一种内窥镜黏膜下层剥离 (ESD) 方法可以实现整体1-4)切除范围广泛的病灶。其他内窥镜治疗包括光动力疗法 (PDT)、氩等离子体凝固 (APC) 和电磁凝固。
一般说明
1 内镜下切除的指征
深度浸润黏膜层(T1a)的 EP 和 LPM 病变很少发生淋巴结转移,并且具有足够的治愈性。当管壁到达黏膜肌层或轻微侵犯黏膜下层(可达200μm)时,可进行内镜下切除,但有淋巴结转移的可能,因此相对适应症)5-7 对于深入黏膜下层 (T1b)(200 μm 或更多)的肿瘤,其转移率约为 50%,8)甚至浅表癌症也应以与晚期癌症相同的方式进行治疗。
如果黏膜切除超过圆周的四分之三,预计内镜切除后会出现瘢痕狭窄,因此治疗前需要充分解释和预防狭窄9,10 )。
2 切除标本的组织学诊断
治疗前对壁浸润深度的诊断是有限的,在广泛病灶中很难准确诊断壁浸润深度。此外,浸润组织类型和血管侵犯的术前诊断是不可能的。使用切除标本的组织学诊断对于确定是否需要额外治疗很重要,使用整块切除的组织标本进行诊断是必不可少的。
3 内镜下不可切除病灶的治疗
PDT 11已被提出作为内镜下不可切除病例的治疗选择,例如对 ER 边缘残留病灶的附加治疗、放疗或放化疗后附加 ER 期间黏膜抬高困难、出血倾向等。,APC 12)等。
4 整块切除的优越性
对于切除标本的组织学诊断,整块切除是优选的。随着 ESD 的引入,现在可以切除过去在传统 EMR 中被分割的病灶,预计未来设备的发展和该技术的普及。
5 并发症
在 ER 中,已经报道了与切除相关的出血(0.2%)、食管穿孔(1.9%)和切除后瘢痕狭窄(6.0-16.7%)等并发症8 )。需要充分解释。
参考
1)Oyama T 等人:早期食管癌的内镜黏膜下剥离术。临床胃肠肝病。2005;3(7 增刊 1):S67-70。2)Fujishiro M 等人:早期食管癌的内镜黏膜下剥离术。Clin Gastroenterol Hepatorol. 2006;4(6):688-94。3)Ishihara R 等人:日本早期食管癌整块切除中 EMR 和内窥镜黏膜下剥离术的比较. Gastrointest Endos. 2008; 68(6).1066-72。四)Takahashi H 等人:内窥镜黏膜下剥离术作为早期食管鳞状细胞癌的治愈性治疗优于常规内窥镜切除术。Gastrointest Endosc. 2010;72(2):255-64。五)Tsuneo Koyama, et al.: (Diagnosis of esophageal m3/sm1 cancer and remote results) 第 46 届食管色素研究学会问卷调查报告。m3/sm1食管癌伴转移的特点。胃和肠。2002;37(1):71-4。6)Katada C 等人:食管鳞状细胞癌侵犯黏膜肌层的内镜黏膜切除术后临床结果——一项多中心回顾性队列研究。内窥镜检查。2007;39(9):779-83。7)Shimizu Y 等人:食管鳞状细胞癌侵犯黏膜肌层或更深层的内镜黏膜切除术后的长期结果. Gastointest Endosc. 2002; 56(3): 387-90。8)日本食管疾病学会:日本食管癌综合登记,2009. Esophagus. 2016; 13: 110-37.9)Mizuta H 等人:食管浅表癌内镜黏膜下剥离术后食管狭窄的预测因素. Dis Esophagus. 2009; 22(7): 626-31。十)Katada C 等人:食管浅表病变内镜黏膜切除术后食管狭窄. Gastrointest Endosc. 2003; 57(2): 165-9。11)Yano T 等人:光动力疗法作为食管癌根治性放化疗后局部失败的补救治疗. Gastrointest Endosc. 2005; 62(1): 31-6。12)Satoshi Tanabe 等人:氩等离子凝固 (APC) 消融治疗的现状和前景。日本胃肠病学内窥镜学会杂志。2004;46(11):1391-98。
临床问题
CQ18如果浅表食管癌内镜治疗后发现pT1a-MM,是否应该推荐额外治疗?
证据强度D.如果 pT1a-MM 和 LVSI 阳性,强烈建议进行额外治疗。(同意率85% [17/20])
评论
没有随机对照试验或病例对照研究的报告阐明在内镜切除标本中组织病理学诊断为 pT1a-MM 时额外治疗的有用性。
在手术结果报告中,pT1a-MM 鳞状细胞癌切除标本中淋巴结转移的频率据报道为 0-27%。CI:9.85-19.76) 为1-8)。在腺癌中,关于 pT1a-MM 转移频率的报道很少,但据报道在 pT1a 中为 0-5%。) 为9-11)。另一方面,内镜切除标本中评估为 pT1a-MM 的患者复发淋巴结转移的频率为 0-4.2%,鳞状细胞癌为 5/223(2.24%,95% CI:0.73%)。-5.15 ) 7 , 12 , 13),据报道在腺癌中为 0% 14),特别是在鳞状细胞癌中。- MM 患者的淋巴结转移频率差异很大。两例淋巴结转移频率差异的主要原因被认为是手术标本和内镜切除标本病理诊断方法的差异。由于手术标本比内窥镜切除标本厚,我们不能否认 pT1b 病例包括在评估为 pT1a-MM 的病例中的可能性。其理由是 pT1a-MM 淋巴浸润的频率差异很大(内镜切除病例中的 pT1a-MM:0-8.1% 7、12 ),手术标本:18.2-41.2% 1-4,7) )。
浅表食管癌手术后淋巴结转移的危险因素报道较少,据报道差异显着(阴性病例:4/38(10.5%),阳性病例:5/12(41.7%))4 ) . 此外,在对淋巴结转移危险因素的多变量分析中,在所有 T1 病例5、6 )和 pT1a-MM/pT1b-SM1 病例中,阳性淋巴浸润的优势比为 3.63-6.11。在4 )中为 3.83 ,并且仅在 pT1a-MM 病例中为 7.333 7)。一项对内镜切除患者异时转移危险因素的研究发现,所有pT1患者的淋巴结或远处转移频率为3.73%(15/402),pT1a-EP/LPM为0.36%(15/402)。 /280), pT1a-MM 为 4.29% (3/70), pT1b-SM1 为 11.7% (2/17), pT1b-SM2 为 25.7% (9/35)。在多变量分析中,只有浸润深度是显着的危险因素,pT1a-MM与pT1a-EP/LPM的危险比为13.1(95% CI:1.3-133.7,p值=0.03) )。13 另一方面,淋巴血管浸润阳性不是整个浅表性癌异时转移的显着危险因素。显着更高(46.7% vs. 0.7%,p值<0.0001)13). 所回顾的文章均为回顾性病例系列,在内镜下切除的病例中,对淋巴浸润阳性的病例进行了主要以放化疗为主的附加治疗,切除后诊断为pT1a-MM的患者转移复发的风险高于pT1a的患者-EP/LPM,阳性淋巴浸润是危险因素。
如果 pT1a-MM 在内窥镜切除标本中经组织病理学诊断,则手术或放化疗被认为是明确的附加治疗。据报道,T1a 病例术后5年疾病特异性生存率为98-100% ,总生存率为82-100% 。死亡率为0.2-3.6 % 4,8, 11,15 )。据报道,cStage I (cT1N0M0) 放化疗的 4 年总生存率为 80.5%,5 年总生存率为 66.4%,5 年疾病特异性生存率为 76.8%,cT1a 病例为 85.2% . 然而,许多 cT1b 病例被包括在内16 , 17)。作为严重的晚期并发症,食道瘘(3.2%)、食道狭窄(3.2%)、3级心脏缺血(1%)和呼吸衰竭(2.8%)均有报道,但没有报道与治疗相关的死亡16,17 ) . 关于内镜切除术后的附加放化疗,虽然调查了少数病例,但 pT1a-MM 和 T1b-SM1 的 5 年总生存率和疾病特异性生存率均为 100%,而 3 年疾病特异性生存率 具体生存率为92.9%,虽然没有关于不良事件的详细报告,但没有严重的不良事件或治疗相关的死亡。12、18 ) 。_ 考虑到利弊之间的平衡,对于复发风险高的患者,应在内镜治疗后对pT1a-MM进行额外治疗。
基于上述结果,大部分报告为回顾性病例系列报告,迄今为止尚未获得高证据结果。放化疗,主要作为附加治疗,可以在医保下进行,在某些情况下,强烈建议进行附加治疗。”
参考
1)Endo M 等人:手术切除的胸段食管浅表癌淋巴结转移的临床病理学分析。Dis of Esophagus. 2000;13(2):125-9。2)Noguchi H 等人:内镜黏膜切除术治疗浅表性食管癌的评估。Surg Laparosc Endosc Percutum Tech. 2000;10(6):343-50。3)Araki K, et al: 伴有淋巴结和远端转移的浅表食管鳞状细胞癌的病理特征. Cancer. 2002; 94(2): 570-5。四)Eguchi T 等人:食管癌内镜黏膜切除术后附加治疗的组织学标准:464 例手术切除病例分析。Modern Patho. 2006;19(3):475-80。五)Kim DU 等人:T1 食管鳞状细胞癌淋巴结转移的危险因素。J Gastro Hepatol. 2008;23(4):619-25。6)Choi JY 等:浅表食管鳞状细胞癌内镜切除术的可行性. Gastrointest Endosc. 2011; 73(5): 881-9。7)Akutsu Y 等人:T1 食管鳞状细胞癌转移的总体患病率。Ann Surg. 2013;257(6):1032-38。8)Tanaka T 等人:T1 食管鳞状细胞癌:食管切除术后的长期结果和预后因素。Ann Surg Oncol. 2014;21(3):932-8。9)Barbour AP 等人:早期食管腺癌的风险分层:淋巴扩散和预后因素分析。Ann Surg Oncol. 2010;17(9):2494-502。十)Leers JM 等人:T1 食管腺癌患者淋巴结转移的患病率。食管切除术标本的回顾性研究。Annals of Surg. 2011;253(2):271-8。11)Merkow RP 等人:局部食管癌的治疗趋势、淋巴结转移风险和结果。J Natl Cancer Inst. 2014;106(7):dju133。12)Katada C, et al: 内窥镜黏膜切除术后侵犯黏膜肌层的食管鳞状细胞癌的临床结果——一项多中心回顾性队列研究。内窥镜检查。2007;39(9):779-83。13)Yamashina T 等人:浅表食管鳞状细胞癌内镜切除术后的长期结果和转移风险。Am J Gastroenterol. 2013;108(4):544-51。14)Herrero LA 等人:与早期食管和贲门腺癌深度侵袭相关的淋巴结转移风险:基于内窥镜切除标本的研究。内窥镜检查。2010;42(12):1030-6。15)Ancona E 等人:预测浅表性食管癌中的淋巴结状态。Ann Surg Oncol. 2008;15(11):3278-88。16)Yamada K 等人:临床 I 期 (T1N0M0) 食管癌的放化疗治疗结果 Int J Rad Oncol Biol. Phys. 2006;64(4):1106-11。17)Kato H, et al: A Ⅱ期放化疗治疗Ⅰ期食管鳞状细胞癌的试验: 日本临床肿瘤学组研究 (JCOG9708). Jpn J Clin Oncol. 2009; 39(10): 638-43.18)Shimizu Y 等人:EMR 联合放化疗:一种治疗浅表性食管鳞状细胞癌的新方法。Gastrointest Endosc. 2004;59(2): 199-204。
转贴CQ5是否建议对壁浸润深度被认为是内镜治疗指征的食管癌进行周边评估?
证据强度一个。强烈建议在食管癌治疗前评估周围环境,其壁浸润深度被认为是内镜治疗的指征。(同意率100% [20/20])
评论
参考第三章食管癌治疗算法及基于算法的治疗策略2
.cStage 0, I CQ5
转贴CQ6食管癌内镜治疗后狭窄的预防措施有哪些?
证据强度一个。为防止食管癌内镜治疗后出现狭窄,我们强烈建议进行预防性球囊扩张、局部注射类固醇或口服类固醇。(同意率90% [18/20])
评论
参考第三章食管癌治疗算法及基于算法的治疗策略2
.cStage 0, I CQ6
第五章手术治疗
1 宫颈食管癌手术
包起来
在颈段食管癌的手术中,往往需要进行喉切除术,而术前放化疗和根治性放化疗往往以保留喉部为目的。保留喉手术虽然保留了发声功能,但容易发生误吸和肺炎,必须充分考虑其适应症。联合喉切除术存在由于失去声音功能而导致生活质量恶化的问题。没有报道显示宫颈食管癌手术与根治性放化疗的预后有显着差异,在选择治疗方法时应慎重考虑生活质量。
一般说明
由于颈段食管癌好发于气管、大血管、神经和甲状腺密集的部位,因此经常侵犯邻近器官。此外,淋巴结转移频率高,常在晚期癌症状态下确诊。然而,由于与胸段食管癌相比,它很少引起大范围的转移,因此在相对大量的病例中需要手术。颈食管癌手术的一个主要问题是需要联合切除喉部的大量病例。因此,有些病例术前放化疗保留喉部,术前肿瘤缩小1 ),或根治性放化疗后局部残留或复发,部分病例可进行抢救手术2)。
保留喉部手术适用于咽部、喉部或气管无肿瘤浸润的患者。保留发声功能是最大的好处,但另一方面,它也有容易吸入和肺炎的缺点,通常需要进行一次气管切开3 )。因此,必须充分考虑适应症和手术程序,例如增加喉部抬高手术等防止误吸的措施4 )。
当肿瘤侵犯咽、喉或气管时,需要联合喉切除术(咽咽食管切除术)。即使浸润不直接到达咽部,也适用于无法确保与重建肠吻合所必需的颈部食道的情况。喉切除术与声音功能的丧失有关,这会显着降低生活质量。
颈段食管癌切除术后的主要重建方法包括游离空肠移植重建5 )和胃管重建6 )。游离空肠移植是首选,但胸段食管癌患者或宫颈食管癌肛门侧延伸至胸段食管的患者可选择胃管重建。
颈段食管癌虽然淋巴结转移的频率较高,但大多局限于颈段和部分上纵隔,且主要在该区域进行清扫。但目前关于淋巴结清扫术对颈段食管癌疗效的报道较少,这是未来研究的课题。
没有报道显示宫颈食管癌手术与根治性放化疗的预后有显着差异,在选择治疗方法时应慎重考虑生活质量。
参考
1)Shiraishi Osamu 等:喉咽癌和颈段食管癌的治疗策略 强调通过诱导放化疗和手术技术保留喉部的多学科治疗策略。日本气管食管公报。2014;65(2):144-7。2)Takuji Yasuda 等:[下咽癌和宫颈食管癌的治疗策略] 宫颈食管癌的治疗策略旨在进一步提高可治愈性和功能。日本气管食管公报。2008;59(2):99-102。3)Yasuaki Nakajima 等人:宫颈食管癌的手术治疗 保留喉部的手术策略。日本气管食管公报。2014;65(6):447-56。四)白石修等:【下咽浅表及颈段食管癌的内镜诊治】颈段食管癌手术 咽部还能留多远?可拆卸内窥镜。2016;28(1):115-21。五)Mayanagi S, et al: The use of short segment free jejunal transfer as salvage Surgery for 颈段食管癌和下咽癌. World J Surg. 2014; 38(1): 144-9.6)Ullah R, et al: Pharyngo-laryngo-osophagectomy 和胃上拉治疗环状软骨后和颈部食管鳞状细胞癌. J Laryngol Otol. 2002; 116(10): 826-30。
临床问题
CQ19对于需要喉切除术且需要保留喉部的食管癌,我们应该推荐术前或根治性放化疗吗?
证据强度D.对于需要联合喉切除术且需要保留喉部的食管癌,我们强烈建议进行术前或根治性放化疗。(同意率84.2% [16/19])
评论
在颈段食管癌中,需要联合喉切除的病例的治疗方法的选择是临床实践中的一个主要问题。联合喉切除术导致声音功能丧失和生活质量显着下降1 )。因此,术前或根治性放化疗通常以保留喉部为目的。
作为对该 CQ 的文献检索的结果,从 PubMed 和 Ichushi 中提取了 130 篇文章。此外,还对其他 7 篇文章进行了初步和二次筛选,并对 12 篇观察性研究 2-13)进行了定性和定量系统评价。
日本报道了宫颈食管癌手术和根治性放化疗之间喉部保留率的比较2)以及通过引入放化疗来保留喉部的策略3、4 ) 。据他们介绍,放化疗的喉部保留率为53-78%,优于单纯手术的19-24%的保留率。此外,也有关于)8,9)后进行和术前放化疗 最近,日本开展了一项针对食管癌根治性放化疗的多中心II期临床试验,报道完全缓解率为73.3% 10)。
日本食管学会最近进行的一项全国性调查发现,由于保留喉部困难而接受术前治疗(化疗、放化疗)的患者中有 24.5% 能够保留喉部,而接受根治性放化疗的患者中有 47.3% 能够保留喉部。在11)中保存是可能的。
此外,在任何比较放化疗和手术在生存率方面的报告中均未观察到显着差异2,3,12-14),并且有3项研究可以比较5年生存率 2,3,12 ) .同样,荟萃分析结果未观察到显着差异(优势比 1.38,p 值 = 0.22)。
至于不良事件,大约 38% 的放化疗患者出现 3 级或更高级别的白细胞减少,大约 5-20% 的患者出现 3 级或更高级别的食管炎、吞咽困难和吞咽困难12)。此外,有报道称,保留喉手术中肺炎较为常见,气管切开率高,还观察到吞咽困难。
综上所述,术前或根治性放化疗有助于提高喉部保留率。但是,它对提高存活率没有用。此外,由于放化疗或保留喉手术后可能发生吞咽困难,因此在治疗过程中还应考虑经口摄入的生活质量。考虑到证据的程度和利弊之间的平衡,建议是“对于希望保留喉部的需要联合喉切除术的食管癌患者,因为这是一种患者非常渴望的治疗方法,并且在医疗保险范围内. 相比之下,我们强烈推荐术前或根治性放化疗。
参考
1)Suzuki G 等:局部晚期 (T3-4) 喉、下咽和颈食管疾病的非手术多模式治疗喉保留策略的易感因素. Anticancer Res. 2014; 34(9): 5205-10。2)Tsutomu Nakamura 等人:下咽癌和宫颈食管癌的治疗策略 晚期宫颈食管癌的根治性放化疗结果。日经海报。2008;59(2):115-9。3)Yasuda T. 等人:下咽癌和宫颈食管癌的治疗策略 宫颈食管癌的治疗策略旨在进一步改善可治愈性和功能。日经海报。2008;59(2):99-102。四)Shiraishi Osamu 等:喉咽癌和颈段食管癌的治疗策略 强调通过诱导放化疗和手术技术保留喉部的多学科治疗策略。日经海报。2014;65(2):144-7。五)Shiozaki H, et al: 颈段食管癌手术治疗中的喉保留-喉悬吊环咽肌切开术联合手术. Dis Esophagus. 2000; 13(3): 213-8.6)Horváth OP 等人:放化疗后保留喉的咽-食管切除术治疗咽-食管交界处的癌症。Ann Thorac Surg. 2001;72(6):2146-7。7)Adham M 等人:联合化疗和放疗后进行手术治疗食管鳞状细胞癌患者。Cancer. 2000;89(5):946-54。8)Yamada K 等人:颈食管癌放射治疗的治疗结果. Acta Oncol. 2006; 45(8): 1120-5。9)Suzuki, Y. 等人:诱导化疗和放化疗在晚期宫颈食管癌中的作用。癌症和化疗。2010;37(1):71-5。十)Zenda S, et al: 顺铂和 5-氟尿嘧啶联合放疗作为宫颈食管鳞状细胞癌患者器官保存方法的多中心 2 期研究. Int J Radiat Oncol Biol Phys. 2016; 96(5): 976-84。11)Kato H, et al ; 日本食管学会“食管癌诊断和治疗指南”委员会:新辅助治疗或根治性放化疗可提高宫颈食管癌患者的喉保留率。日本全国调查. 食道. 2016; 13(3): 276-82.12)Yoshihiro Kinoshita 等:晚期咽癌和宫颈食管癌的治疗策略 我科晚期下咽癌和宫颈食管癌的治疗结果。日经海报。2011;62(2):102-10。13)Tong DK 等人:目前对宫颈食管癌的治疗。World J Surg. 2011;35(3): 600-7。14)Cao CN, et al: 初级放疗与初级手术治疗颈段食管癌的比较. JAMA Otolaryngol Head Neck Surg. 2014; 140(10): 918-26.
CQ20对于可切除的颈段食管癌,您是否推荐在手术中进行颈段和上纵隔淋巴结清扫?
证据强度C。在可切除的颈段食管癌手术中,不建议对颈段和上纵隔淋巴结进行清扫。(同意率80% [16/20])
评论
颈段食管癌虽然很少转移至腹部淋巴结,但转移多见于上纵隔淋巴结,因此应慎重考虑清扫范围。
作为对该 CQ 的文献检索的结果,从 PubMed 和 Ichushi 中提取了 108 篇文章。此外,还增加了从其他研究中提取的20篇文章,经过一、二次筛选后,对9篇观察性研究进行了定性系统评价。
所有 9 项研究均为案例系列研究,由于解剖范围的差异,未对结果进行比较。其中有七份来自日本的报道。其中,发现了三份报告,检查了 50 多例宫颈食管癌1-3)。据他们介绍,淋巴结转移发生在深于 T1b 的病例中,41% 至 59% 转移至颈部食管旁淋巴结 [101],33% 至 42% 转移至锁骨上淋巴结 [104],33% 至 42% . 19% 至 37% 的淋巴结 [102] 和 2% 至 7% 的浅表淋巴结 [100] 发现转移。在纵隔淋巴结中,11-25% 的患者转移至喉返神经淋巴结 [106rec],0-12% 的患者转移至上胸段食管旁淋巴结 [105]。[101]、[102] 和 [104] 的转移率在 Ce 局部病例中很高,并且在 pT3 或更深的 [106rec] 和 [105] 中也观察到转移。在 CeUt 中,除了 [101]、[102]、[104]、[106rec] 和 [105] 显示出相对较高的转移灶。在 CePh 中,向 [101]、[102] 和 [104] 的转移率很高,但未观察到向纵隔的转移。此外,在咽后淋巴结中发现约 5% 的转移[103]。在其他六份报告中也观察到了类似的趋势4-9)。
预后有两篇报道1、3 ),但均随着淋巴结转移程度的增加预后恶化,均未提及清扫的效果。
虽然没有报道与颈部夹层相关的严重并发症,但在上纵隔夹层相关并发症中,甲状旁腺功能减退占 53%,气管坏死和大血管破裂各占 13%。4 )。因此,在进行纵隔解剖时,需要选择合适的入路和仔细的手术操作。
综上所述,所有颈段食管癌均存在比 T1b 更深的淋巴结转移,且转移至 [101]、[102] 和 [104] 的频率较高。Ce 和 CeUt 病例在 [106rec] 和 [105] 中也显示出转移。但对这些淋巴结清扫效果尚不清楚,纵隔清扫术中会出现气管坏死、大血管破裂等严重并发症。考虑到证据的强度、利弊的平衡,以及可以在医保覆盖的医疗范围内进行,建议“在可切除的宫颈食管癌手术中,宫颈不推荐淋巴结和纵隔淋巴结清扫。”
参考
1)Sasaki T, et al.: 我科宫颈食管癌的临床研究。头颈癌。2008;34(1):56-61。2)Eguchi, A. 等人:[食管癌应在何种程度上进行解剖?] 宫颈食管癌。手术。2000;62(7):743-7。3)Seiji Kishimoto, et al.: [食道癌切除到什么程度?] 宫颈食道癌 考虑进展方向确定宫颈食道癌切除范围。手术。2000;62(7):731-6。四)Hirano S 等人:上纵隔淋巴结清扫术治疗下咽癌和颈部食管癌。Ann Otol Rhinol Laryngol. 2007;116(4):290-6。五)Fujita H 等人:基于淋巴结区室的颈段食管癌的新 N 类。食道。2008;5(1):19-26。6)Akabane, H. 等人:宫颈食管癌的手术治疗 我们在宫颈食管癌手术治疗方面的经验。日经食会杂志。2006;57(2):125-9。7)Timon CV 等人:晚期喉癌、下咽癌和颈食管癌的气管旁淋巴结受累。喉镜。2003;113(9):1595-9。8)Martin AS:晚期喉癌、下咽癌和颈食管癌中的颈部和纵隔淋巴结受累。Head Neck. 2001;23(9):772-9。9)Yagi K 等人:颈部食管癌的淋巴结转移。头颈部肿瘤。1997;23(1):189-94。
2 胸段食管癌手术
包起来
胸段食管癌常有颈部、胸部、腹部广泛的淋巴结转移,一般切除范围包括这3个区域的淋巴结。同样在胸中段食管癌的情况下,根据法规的修订,锁骨上淋巴结[104]分为两组,D2解剖需要三个区域的解剖。
在腹腔镜手术中,左侧卧位的胸部推拿是主流,但也有俯卧位的胸部推拿。目前处于临床研究阶段,已启动一项随机对照试验(Study JCOG1409),将远期结果与标准心脏直视手术进行比较,等待结果。
一般说明
胸段食管癌常有颈、胸、腹广泛淋巴结转移,一般行全切除,包括颈、胸、腹淋巴结。如果壁浸润深度比T1a-MM深,有淋巴结转移的可能,T1b-SM2,3应视为晚期癌1-2)。
由于淋巴结转移的分布和转移率因主要病变所占据的部位、其大小和浸润深度而异,因此根据具体情况使用CT、US、MRI、PET等。并确定解剖范围。根据对日本食管学会国家登记处数据的分析3 ),第 11 版《食管癌治疗规则》指出,即使在胸中段食管癌中,锁骨上淋巴结 [104] 也分为两组,D2解剖包括三个解剖区域。成为必要的。锁骨上淋巴结清扫术 [104] 不能通过胸部手法进行,该区域的明确淋巴结清扫术需要颈椎入路。
胸段食管癌的根治性手术一般从三个途径进行:颈部、胸部和腹部。关于颈段食管旁淋巴结的解剖[101],有一种观点认为,不仅可以从颈部进行,也可以从纵隔进行。
食管切除术和内镜重建术在微创性、治愈性和远程治疗效果方面目前处于临床研究阶段,但它们在未来是有希望的治疗方法。胸腔镜和腹腔镜食管切除重建、纵隔镜和腹腔镜内镜辅助经食管裂孔闭合性食管切除术已有报道,2013年病例分析发现37.6%的病例接受了腹腔镜手术。死亡率为2.44%,与3.03%的总死亡率相比是安全的。腹腔镜手术的适应症因设施而异,有些设施甚至表明 cT3 病例和术前放化疗。
为了安全进行腹腔镜手术,缩短手术时间,增加淋巴结清扫程度,采用小切口直接操作结合小开胸手术的方法,VATS(Video-Assisted Thoracoscope Surgery),有一种HALS(手辅助腹腔镜手术) 插入一只手进行手术的方法。过去,胸部操作是在左侧卧位进行的,但最近,全胸腔镜胸部操作也在俯卧位进行。此外,还进行通过颈部伤口插入纵隔镜的纵隔淋巴结清扫和使用腹腔镜通过经食道裂孔的纵隔淋巴结清扫。虽然有报道称内窥镜手术通过放大效应识别精细的解剖结构,可以保留血管和神经并进行高精度的淋巴结清扫,但长期结果与传统的标准开胸手术进行了比较。一项随机对照试验(研究JCOG1409) 已经启动,等待结果4 )。
参考
1)Akutsu Y 等人:T1 食管鳞状细胞癌转移的总体患病率:295 例患者的回顾性分析。Ann Surg. 2013;257(6):1032-8。2)Akutsu Y 等人:临床 T1N0 胸食管癌中总体和初始淋巴结转移的患病率:来自前瞻性多中心研究 JCOG0502 的结果. Ann Surg. 2016; 264(6): 1009-15。3)Tachimori Y 等人:根据肿瘤位置对食管鳞状细胞癌进行淋巴结清扫的疗效。食管。2016;13:1-7。四)Kataoka K 等人:胸腔镜与开放式食管切除术治疗胸段食管癌的随机 III 期试验:日本临床肿瘤学组研究 JCOG1409. Jpn J Clin Oncol. 2016; 46(2): 174-7。
临床问题
CQ21我们应该推荐胸腔镜食管切除术治疗胸段食管癌吗?
证据强度C。对于胸段食管癌,我们弱推荐胸腔镜食管切除术。(同意率95% [19/20])
评论
在日本,开胸食管切除术一直是主流,但在Akaishi等人引入胸腔镜食管切除术后,食管下段切除术迅速普及。通过最大限度地减少胸壁破坏来实现微创,并且由于放大效应而期望精确的手术操作,但目前尚未获得关于其安全性和有效性的充分结论。
作为该CQ的文献检索结果,PubMed:447篇,Cochrane:199篇,Ichushi:120篇。经过初步和二次筛选,我们对 1 项随机对照试验和 34 项观察性研究进行了定性和定量系统评价。
关于疗效,欧洲(主要是荷兰)只有一份报告直接比较了心脏直视手术和胸腔镜手术的治疗结果的随机对照试验2)。这项研究只是一项短期研究,包括术后呼吸系统并发症,并未报告长期生存情况。此外,虽然只有观察性研究比较了心脏直视手术和胸腔镜手术的长期生存率,但过去已有 11 项研究3-13 ),其中 5项日本 3,8,10-12来自. 这五篇文章中的三篇显示了胸腔镜手术在 5 年总生存率方面的优越性,其中两篇使用心脏直视手术组作为历史对照。没有报告证明心脏直视手术对 5 年总生存期的优越性。由于所有报告都是回顾性队列研究,因此很难使用本系统评价的结果得出关于长期预后的结论。
关于安全性,在上述随机对照试验中,两组之间在术后 30 天死亡率方面未观察到显着差异2)。在对10项观察性研究进行的荟萃分析中,两组之间未观察到显着差异4、10、12-19)(图 1)。在一项随机对照试验中,心脏直视手术组术后肺炎的发生率为 34%,胸腔镜手术组为 12%,明显低于 2 )。然而,在对 2011 年日本 NCD 登记的 5,354 例食管切除重建术的分析中,总体并发症发生率明显较高,胸腔镜手术组为 44.3%,而心脏直视手术组为 40.8%。胸腔镜手术组 30 天内的再手术率也显着高于 8.0%,而心脏直视手术组为 5.6%19 )。在针对cStage I患者的JCOG0502中,对胸腔镜手术组和胸腔镜手术组进行了比较)。20 目前,不可否认的是,日本胸腔镜手术组的并发症发生率较高。

关于术后住院时间,在上述随机对照试验中,胸腔镜手术组的中位数为11天(7-80天),明显高于胸腔镜手术组14天(1-120天)的中位数。手术组。2)。对10项观察性研究的荟萃分析结果也表明,尽管异质性很高,但与开放手术组相比,胸腔镜手术组的缩短显着缩短5、6、18、21-27 。)(图 2)。
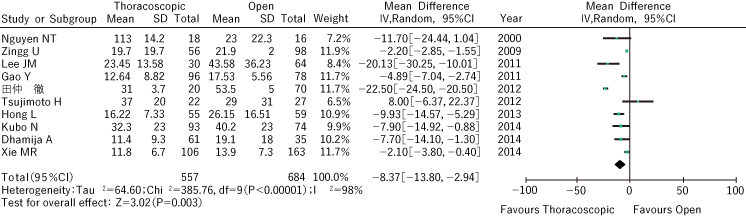
尽管胸腔镜食管切除术可以缩短住院时间,但目前没有足够的证据证明有助于患者生存。考虑到利弊的平衡、证据的程度以及患者的意愿,建议为“我们弱推荐胸段食管癌胸腔镜食管切除术”。目前,一项针对临床I/II/III期食管癌(T4除外)的胸腔镜手术和心脏直视手术的随机对照III期研究(JCOG1409研究)已经在日本启动,等待结果。
参考
1)Akaishi T 等人:胸腔镜整块全食管切除术和根治性纵隔淋巴结切除术。J Thorac Cardiovasc Surg. 1996;112(6):1533-41。2)Biere SS 等人:食管癌患者的微创与开放式食管切除术:多中心、开放标签、随机对照试验。柳叶刀。2012;379(9829):1887-92。3)Osugi H, et al: 电视胸腔镜食管切除术与根治性淋巴结清扫术治疗食管鳞状细胞癌开放手术的比较. Br J Surg. 2003; 90(1): 108-13.四)Smithers BM 等:开放式和微创食管切除术的结果比较. Ann Surg. 2007; 245(2): 232-40。五)Zingg U 等人:食管癌患者的微创食管切除术与开放式食管切除术。Ann Thorac Surg. 2009;87(3):911-9。6)Lee JM 等:将腹腔镜手术纳入微创食管切除术有什么好处吗?对食管癌患者围手术期结果的影响 World J Surg. 2011;35(4):790-7。7)Nafteux P 等人:微创食管切除术:一种有价值的替代开放式食管切除术治疗早期食管和胃食管结合部癌的方法。Eur J Cardiothorac Surg. 2011;40(6):1455-63。8)Kunisaki C 等人:胸腔镜辅助手术与小切口和手辅助腹腔镜手术治疗食管癌的意义:单一外科医生的经验。J Gastrointest Surg. 2011;15(11):1939-51。9)Sundaram A 等人:微创食管切除术后的生存和生活质量:单外科医生的经验。Surg Endosc. 2012;26(1):168-76。十)Miyasaka D, et al: 食管癌微创手术可行性的临床评估. Asian J Endosc Surg. 2013; 6(1): 26-32.11)Takeno S, et al: 回顾性研究使用倾向评分阐明胸腔镜食管切除术在食管癌患者中的肿瘤学可行性. World J Surg. 2013; 37(7): 1673-80。12)Komine Osamu 等人:电视辅助胸腔镜食管切除术治疗食管癌的短期术后优势和 5 年随访结果:与单一经验丰富的外科医生进行的传统开放食管切除术的历史比较。食管。2014;1) : 54-63。13)Tapias LF 等人:新辅助治疗后开放和微创 Ivor Lewis 食管切除术的结果. Ann Thorac Surg. 2016; 101(3): 1097-103。14)Pham TH 等人:胸腔镜-腹腔镜联合食管切除术和开放式 Ivor-Lewis 食管切除术后围手术期结果的比较。Am J Surg. 2010;199(5):594-8。15)Daiko H 等人:胸腔镜食管切除术在俯卧位进行扩大淋巴结清扫术治疗临床 I 期胸食管癌的技术和肿瘤学可行性的初步研究。Surg Endosc. 2012;26(3):673-80。16)Kinjo Y 等:胸腔镜-腹腔镜联合食管切除术的疗效:食管癌患者术后并发症和中期肿瘤学结果的比较。Surg Endosc. 2012;26(2):381-90。17)Dolan JP 等:局部晚期食管癌开放和微创食管切除术后合并症对结果和总生存期的影响. Surg Endosc. 2013; 27(11): 4094-103。18)Hong L 等人:Siewert I 型食管胃交界腺癌三野微创食管切除术的短期结果. Ann Thorac Surg. 2013;96(5):1826-31。19)Takeuchi H 等人:使用日本全国网络数据库中包含的 5354 名患者数据的食管切除术风险模型. Ann Surg. 2014; 260(2): 259-66。20)Nozaki I 等人:使用来自 JCOG0502 的数据评估胸腔镜食管切除术治疗 T1bN0M0 癌症的安全性概况:一项前瞻性多中心研究。Surg Endosc. 2015;29(12):3519-26。二十一)Nguyen NT 等人:微创食管切除术与经胸和经食管食管切除术的比较. Arch Surg. 2000; 135(8): 920-5。二十二)高 Y 等:开放式三野和微创食管切除术治疗食管癌的比较. Interact Cardiovasc Thorac Surg. 2011; 12(3): 366-9。23)Tsujimoto H 等人:食管癌的电视胸腔镜手术可减轻术后全身反应和肺部并发症。外科手术。2012;151(5):667-73。24)Tetsuyuki Tanaka 等人:食管癌的微创手术和改善结果的努力从开胸手术到关节镜手术 (VATS-E)。奈良医学会杂志. 2012; 63(5-6): 83-7.二十五)Kubo N, et al: 胸腔镜和腹腔镜联合手术对可切除食管癌患者根治性食管切除术后肺部并发症的影响. Anticancer Res. 2014; 34(5): 2399-404.26)Xie MR, et al: 微创 Ivor-Lewis 食管切除术治疗食管癌的短期结果. Ann Thorac Surg. 2014; 97(5): 1721-7.27)Dhamija A 等人:尽管住院时间较短,但微创食管切除术比开放式食管切除术更昂贵。Eur J Cardiothorac Surg. 2014;45(5):904-9。
CQ22食管癌根治术是否应推荐颈淋巴结清扫术?
证据强度B.强烈建议对中上段食管癌行颈淋巴结清扫术。(同意率90% [18/20])
评论
2015年10月发布第11版食管癌管理规范,改变颈部淋巴结清扫范围。对于中胸段食管癌(Mt),[104](锁骨上淋巴结)从第 3 组改为第 2 组,对于下胸段食管癌(Lt),[101](颈段食管旁淋巴结)改为第 3 组. 从第 2 组开始,[104] 从第 4 组更改为第 3 组。颈淋巴结清扫现在被认为不仅对上胸段食管癌 (Ut) 很重要,而且对 Mt 和 Lt 也很重要。
作为对该 CQ 的文献检索的结果,提取了 PubMed:251 篇文章和 Ichushi:166 篇文章。在初步和二次筛选后,我们对 1 项随机对照试验和 5 项观察性研究进行了定性系统评价。
日本的一项随机对照试验,直接比较了接受颈部淋巴结清扫术的组与因病例数少而没有显示出显着差异的组之间的治疗结果和并发症,有延长生存期的趋势1)。此外,日本报道了 3 项观察性研究发现颈淋巴结清扫术可延长生存期2-4 ),1 项研究未显示下胸段食管癌患者的生存期延长。胸中段食管癌3) . 另一项是仅关注下胸段食管癌的观察性研究,但发现上纵隔或中纵隔淋巴结转移患者的生存期延长4 )。此外,在日本和国外的另外两项观察性研究中,颈部淋巴结清扫组中)。5、6,,
此外,颈部淋巴结清扫术对中上食管癌的清扫疗效指数(转移淋巴结频率(%)×5年生存率(%)/100)显示出较高的清扫效率7)。在下胸段食管癌中,解剖效果指数[101]为0.8-2.7,[104]为0-0.6,相对较低,但[101]的转移阳性率为4.7-12.4%。 104] 的阳性转移率为3.7-7% 7,8 )。这些结果表明,食管癌的颈部淋巴结切除术在许多延长生存期的报告中是有用的。
另一方面,关于安全性,一项随机对照试验报告了横神经麻痹增加和气管切开术增加作为术后并发症,但观察到喉返神经麻痹、呼吸系统并发症和缝合,未观察到失败增加 1 )。此外,日本和海外的两项观察性研究报告了喉返神经麻痹、缝合失败等的增加,3,6) 3,6) 但日本的三项研究报告了术后并发症的发生率。2-5 )。日本报道的四项关于术后住院死亡率的观察性研究未显示颈部淋巴结切除术后死亡率增加2-5)。
有许多报道称颈部淋巴结清扫术可延长中上食管癌的生存期。关于安全性,不能否认并发症增加的风险,但在日本没有住院死亡人数增加的报告,有很多报告说可以安全地进行。考虑到利弊之间的平衡、证据的程度和患者的偏好,建议是“我们强烈建议对中上食管癌进行颈部淋巴结清扫术”。
参考
1)Nishihira T 等人:一项针对胸段食管癌扩大颈部和上纵隔淋巴结切除术的前瞻性随机试验。Am J Surg. 1998;175(1):47-51。2)Kato H, et al: 颈部淋巴结清扫术治疗胸食管癌的评估. Ann Thorac Surg. 1991; 51(6): 931-5。3)Fujita H 等人:胸段食管鳞状细胞癌的最佳淋巴结切除术:比较短期和长期结果. World J Surg. 2003; 27(5): 571-9。四)Igaki H, et al: 3-field dissection 治疗下胸段食管鳞状细胞癌的上纵隔和/或中纵隔淋巴结转移患者的生存率提高. Ann Surg. 2004; 239(4): 483-90。五)Noguchi T 等人:两步三区域淋巴结清扫术对胸食管癌有益。Dis Esophagus. 2004;17(1):27-31。6)Fang WT, et al: 胸段食管鳞状细胞癌的选择性三野淋巴结清扫术. Dis Esophagus. 2007; 20(3): 206-11.7)Udagawa H 等人:淋巴结站分组的重要性和三区淋巴结切除术治疗胸食管癌的基本原理。J Surg Oncol. 2012;106(6):742-7。8)Tachimori Y, et al, The Registration Committee for the Esophageal Cancer of the Japan Esophageal Society: Efficacy of lymph node dissection for each station based on esophageal cancer location. Esophagus. 2016; 13(2): 138-45.
3 食管胃结合部癌(腹食管癌)手术
包起来
食管胃结合部癌的治疗策略和手术技术存在争议,尤其是Western分类腺癌或Siewert II型。日本胃癌学会和日本食管学会联合工作组基于回顾性分析提出了食管胃交界处癌的最佳解剖范围为 4 cm 或更小。目前正在进行一项针对更晚期肿瘤的解剖范围的前瞻性临床研究。
一般说明
其他国家使用 Siewert 分类来定义食管胃结合部癌,但在日本,日本胃癌学会和日本食管学会均采用西方分类。关于 Siewert 分类,I 型通常被视为胸段食管癌,III 型通常被视为贲门癌。另一方面,在西方分类中,鳞状细胞癌通常根据胸段食管癌进行治疗。因此,对于西方分类或 Siewert II 型腺癌的治疗策略和手术技术存在争议。
胃食管交界处癌可扩散至颈部、纵隔、上腹部和腹主动脉周围。日本胃癌学会和日本食管学会联合工作组在对手术病例进行回顾性分析的基础上,根据夹层效果指数(转移率×转移病例的5年生存率)确定了推荐的夹层范围。未来,有望在此基础上通过病例积累来验证淋巴结清扫术的疗效。但该回顾性分析也指出了一些问题,如针对4cm以下的肿瘤,上中纵隔和腹主动脉周围淋巴结清扫病例少。目前正在进行一项针对更晚期肿瘤的解剖范围的前瞻性临床研究。
此外,日本胃癌学会和日本食管学会联合工作组根据内镜检查结果提出了食管胃交界处的定义。淋巴结切除术的算法也基于肿瘤的主要占据部位是口侧还是交界处的肛门侧。然而,在临床实践中,通过内镜检查发现晚期癌的交界处往往是不可能的,而且由于裂孔疝的高频率,即使通过透视或CT也常常难以估计。因此,临床实践中难免对食管胃交界处的判断变得模棱两可。虽然食管和胃切除的范围是根据淋巴结清扫的范围来确定的,但可以设想各种外科手术,从全食管胃切除术到下食管和贲门胃切除术。在食管胃结合部癌的手术中,手术侵犯不仅受切除范围的影响,还受入路方式的影响,因此需要考虑手术侵犯和治愈率之间的平衡。
临床问题
CQ23您是否推荐食管胃结合部癌手术中的下纵隔淋巴结切除术?
证据强度C。我们弱推荐食管胃结合部癌手术中的下纵隔淋巴结清扫术。(同意率95% [19/20])
评论
第11版《食管癌治疗条例》将“食管胃交界处癌定义为食管胃交界处上下2厘米的区域,癌的中心位于该区域内”。食管胃交界处癌最佳淋巴结清扫范围尚未开展大规模随机对照试验,目前尚无证据。JCOG9502试验是一项关于手术技术的大规模随机对照试验,在该试验中比较了左开胸和经食管入路对胃癌和食管胃交界处腺癌侵犯食管≤3cm的疗效。裂孔方法的长期结果已得到证实1,2 )。在本研究中,左侧开胸完全清扫下纵隔淋巴结无助于生存,左侧开胸组术后并发症明显高于经肝门组。因此,《胃癌治疗指南》指出非开胸/经食管入路是食管胃结合部癌的标准外科手术。另一方面,相同的指南描述了长轴小于等于 4 cm 的食管胃交界处癌的淋巴结清扫流程。虽然建议进行清洁,但如果肿瘤位于胃侧,则不建议进行组织学检查。但JCOG9502研究并未比较有无下纵隔淋巴结清扫,下纵隔淋巴结清扫术本身在食管胃结合部癌患者中的临床意义尚未阐明。
对该 CQ 的文献检索产生了 PubMed:284 篇文章,Cochrane:80 篇文章和 Ichushi:176 篇文章。在这个CQ中,我们根据食管-胃结合部癌的定义(食管癌治疗规定,第11版)提取了针对Western分类和Siewert II型癌症的论文。尚未进行比较有无下纵隔淋巴结清扫术的生存预后的随机对照试验,其中大多数是在单中心(一些包括多中心)进行的病例系列研究。在初步和二次筛选后,我们对 20 个案例系列研究进行了定性系统评价2-21)。
20份报告中有12份来自日本。在本CQ的系统评价中,20篇文章中有17篇定义为Siewert分类2、4-7、9、11-21 ) ,2篇定义为West分类8-10) ,1篇定义为上下1厘米以内)3 由于这些试验都不是随机对照试验,因此存在背景因素的差异和不一致的结果评估方法。13项研究中,3项研究排除了pT12,9,12 ),17项研究包括了pT13-8,10,11,13-21 )。从 20 份报告中提取了较低纵隔淋巴结转移率和解剖效果指数作为结果,并针对该 CQ 进行了评估。
下纵隔淋巴结转移率为4.3-31.3%([110]:3.3-30.4%,[111]:0-11.1%,[112]:0-15.3%)。根据组织学,腺癌为 4.3-30.4%([110]:3.3-16.1%,[111]:0-11.1%,[112]:0-15.3%),鳞状细胞癌为 25-31.3%([110] :15.4-30.4%,[111]:4.3-8.3%,[112]:0-8.3%)。一项调查食管浸润长度的报告显示,食管浸润长度≤2cm时下纵隔淋巴结转移/复发率为3.4%,食管浸润长度超过2cm时为26.4%。22)明显更高。20 篇文章中有 8 篇报告了以解剖效果指数作为生存期延长的评价,下纵隔淋巴结清扫效果指数为 2.8-17.6%([110]:1.1-14.3%,[111]:0-6.7%, [112 ] :0-5.4 % ) 8,12,13,17-21 )。没有证据比较食管胃结合部癌伴或不伴下纵隔淋巴结清扫术的术后并发症、手术时间和术后生活质量。
因此,从本次系统评价的结果很难得出结论,考虑到患者的实力和意愿,我们弱推荐食管胃结合部癌手术应行下纵隔淋巴结清扫术。 .
参考
1)Sasako M 等人:左胸腹入路与腹腔经裂孔入路治疗贲门或贲门下胃癌:一项随机对照试验。Lancet Oncol. 2006;7(8):644-51。2)Kurokawa Y 等人:一项随机临床试验的十年随访结果,该试验比较了左胸腹和腹部经食管入路对食管胃交界处或贲门腺癌的全胃切除术。Br J Surg. 2015;102(4):341 -8。3)村上真一等:食管-胃结合部癌的临床病理学研究,特别是鳞状细胞癌与腺癌的比较。日本胃肠外科学会杂志。1998;31(5):1057-64。四)Dresner SM 等人:食管胃交界处腺癌的转移性淋巴结播散模式。外科手术。2001;129(1):103-9。五)Mönig SP 等人:胃食管交界处腺癌中淋巴结转移的地形分布。Hepatogastroenterology. 2002;49(44):419-22。6)Di Martino N 等人:食管胃交界处腺癌的手术治疗:预后因素分析。Hepatogastroenterology. 2005;52(64):1110-5。7)Siewert JR 等人:食管-胃交界处的腺癌. Scand J Surg. 2006; 95(4): 260-9。8)Fujita H 等人:基于淋巴结区室的食管胃交界处癌症的新 N 类。食管。2007;4(3):103-10。9)Pedrazzani C 等人:晚期胃食管交界处腺癌中的淋巴结受累。J Thorac Cardiovasc Surg. 2007;134(2):378-85。十)Tamura T 等人:非开胸纵隔镜辅助经食管下食管切除术治疗食管胃结合部癌的疗效。日本胃肠外科学会杂志。2011;44(9):1079-88。11)Kakeji Y 等人:食管胃交界处癌的淋巴结转移,以及适当淋巴结清扫的确定。Surg Today. 2012;42(4):351-8。12)Hasegawa S, et al: Siewert Ⅱ/Ⅲ型食管胃结合部腺癌淋巴结清扫术的优先级. Ann Surg Oncol. 2013; 20(13): 4252-9.13)Yoshikawa T 等人:淋巴结清扫对食管胃交界处腺癌和鳞状细胞癌的理论治疗影响。胃癌。2016;19(1):143-9。[Epub 2014]14)Hosoda K 等人:下纵隔淋巴结切除术治疗食管胃交界处癌的影响. Anticancer Res. 2015;35(1):445-56。15)Parry K 等人:胃食管交界处腺癌的外科治疗。Ann Surg Oncol. 2015;22(2): 597-603。16)Leers JM 等人:胃食管交界处和远端食管腺癌的临床特征、生物学行为和生存率与食管切除术后相似。J Thorac Cardiovasc Surg. 2009;138(3):594-602;讨论 601-592。17)Yamashita H 等人:Siewert II 型食管胃交界癌的最佳淋巴结清扫范围。Ann Surg. 2011;254(2):274-80。18)Hosokawa Y 等人:根据 Siewert 分类的食管胃交界处腺癌的临床病理学特征和预后因素:日本单一机构的经验. Ann Surg Oncol. 2012; 19(2): 677-83。19)Mine S, et al: Siewert Ⅱ型食管胃交界处腺癌左肾静脉周围淋巴结切除术. Br J Surg. 2013; 100(2): 261-6.20)Yabusaki H, et al: Siewert Ⅱ型鳞状细胞癌与食管胃结合部癌同区手术治疗策略的比较:来自日本单一高容量癌症中心的数据. Surg Today. 2014; 44(8): 1522- 8.二十一)Peng J, et al: Optimal Extent of Lymph Node Dissection for Siewert Type II Esophagogastric Junction Adenocarcinoma. Ann Thorac Surg. 2015; 100(1): 263-9.二十二)Kurokawa Y 等:食管胃交界处腺癌纵隔淋巴结转移和复发。外科手术。2015;157(3):551-5。
CQ24我们应该在食管胃结合部癌手术中推荐全胃切除术吗?
证据强度D.我们强烈建议不要在食管胃结合部癌手术中进行全胃切除术。(同意率90% [18/20])
评论
第11版《食管癌管理条例》将食管胃结合部癌定义为“食管胃结合部上下2cm为食管胃结合部区域,癌的中心位于该区域内”。 ' 食管胃结合部癌淋巴结清扫的最佳范围尚无明确证据,可进行食管切除术、全胃切除术等,目前手术方式的选择由外科医生或机构自行选择。一般来说,食管胃结合部癌的胃切除范围通常选择为心脏胃切除术或全胃切除术。],[6] 由有无淋巴结清扫来定义。日本胃癌学会和日本食管学会联合工作组的一项全国性调查(273 个机构的 3,177 名患者)报告说,在 2001 年至 2010 年期间切除的食管胃结合部癌长达 4 厘米 [4sa],[4sb], [4d].]、[5]、[6]报道,无论肿瘤中心或组织学类型如何,淋巴结转移的频率都极低。没有规定1)。
作为对该 CQ 的文献检索的结果,PubMed:175 篇文章,Cochrane:133 篇文章,Ichushi:243 篇文章被提取。在这个 CQ 中,我们对 Western 分类和 Siewert II 型癌症的全胃切除术和贲门胃切除术进行了系统评价。从提取的文献中,没有随机对照试验比较全胃切除术和贲门胃切除术的生存预后。在初步和二次筛选后,我们对 15 个案例系列研究进行了定性系统评价2-16)。
九份报告中有五份来自日本5,7-16)。在对该 CQ 的系统评价中,15 个中有 13 个由 Siewert 分类2-4、6、8-16 )定义,2个由 Nishi 分类5、7 )定义。由于这些试验都不是随机对照试验,因此存在背景因素的差异和不一致的结果评估方法。从 15 份报告中提取结果,其中胃切除术不是在远端胃切除术中进行,而是在全胃切除术中进行 [4d]、[5]、[6] 和淋巴结转移率和解剖效果指数,并评估了这个 CQ。
[4d],[5],[6]淋巴结转移率为[4]:0-6.3%,[5]:0-3.5%,[6]:0-5.0%,与解剖效果指标为 [4]: 0-1.5, [5]: 0-1.8, [6]: 0-1.65 , 9-16)。没有证据比较食管胃结合部癌全胃切除术和贲门胃切除术的术后并发症、手术时间、术后体重减轻和术后生活质量。
因此,从本次系统评价的结果很难得出本次CQ的结论。考虑到证据的强度、患者的意愿等,决定``我们弱建议手术中不要进行全胃切除术。用于食管胃结合部癌”。
参考
1)日本胃癌学会主编:胃癌治疗指南第 4 版。金原出版。2014:15-16。2)Dresner SM 等人:食管胃交界处腺癌的转移性淋巴结播散模式。外科手术。2001;129(1):103-9。3)Di Martino N 等人:食管胃交界处腺癌的手术治疗:预后因素分析。Hepatogastroenterology. 2005;52(64):1110-5。四)Siewert JR 等人:食管-胃交界处的腺癌,Scand J Surg 2006;95(4):260-9。五)Fujita H 等人:基于淋巴结区室的食管胃交界处癌症的新 N 类。食管。2007;4(3):103-10。6)Pedrazzani C 等人:晚期胃食管交界处腺癌中的淋巴结受累。J Thorac Cardiovasc Surg. 2007;134(2):378-85。7)Tamura T 等人:非开胸纵隔镜辅助经食管下食管切除术治疗食管胃结合部癌的疗效。日本胃肠外科学会杂志。2011;44(9):1079-88。8)Kakeji Y 等人:食管胃交界处癌的淋巴结转移,以及适当淋巴结清扫的确定。Surg Today. 2012;42(4):351-8。9)Hasegawa S, et al: Siewert Ⅱ/Ⅲ型食管胃结合部腺癌淋巴结清扫术的优先级. Ann Surg Oncol. 2013; 20(13): 4252-9.十)Yoshikawa T 等人:淋巴结清扫对食管胃交界处腺癌和鳞状细胞癌的理论治疗影响。胃癌。2016;19(1):143-9。[Epub 2014]11)Yamashita H 等人:Siewert II 型食管胃交界癌的最佳淋巴结清扫范围。Ann Surg. 2011;254(2):274-80。12)Hosokawa Y 等人:根据 Siewert 分类的食管胃交界处腺癌的临床病理学特征和预后因素:日本单一机构的经验. Ann Surg Oncol. 2012; 19(2): 677-83。13)Mine S, et al: Siewert Ⅱ型食管胃交界处腺癌左肾静脉周围淋巴结切除术. Br J Surg. 2013; 100(2): 261-6.14)Fujitani K 等人:晚期 Siewert Ⅱ型贲门腺癌的腹部淋巴结扩散模式和最佳腹部淋巴结切除术:多中心研究结果。胃癌。2013;16(3):301-8。15)Yabusaki H, et al: Siewert Ⅱ型鳞状细胞癌与食管胃结合部癌同区手术治疗策略的比较:来自日本单一高容量癌症中心的数据. Surg Today. 2014; 44(8): 1522- 8.16)Goto H, et al: Siewert Ⅱ型和Siewert Ⅲ型食管胃交界处腺癌最佳淋巴结清扫范围不同. 胃癌. 2014; Mar 22.[提前出版电子版]
4 围手术期管理及临床路径
包起来
日本和海外的机构已经设计了食管癌的临床路径,以确保安全的围手术期管理,并发症少,但鲜有明确的证据报告。近年来引入的围手术期管理新概念加速康复外科(ERAS)或食管切除术中的快速通道手术的临床意义已开始被研究。
一般说明
临床路径是包括患者状况、医疗目标、评估和记录的标准治疗计划,是通过分析与标准的偏差来提高医疗质量的方法1 )。1980 年代,随着美国诊断相关组/预期支付系统 (DRG/PPS) 的引入,临床路径被引入,其主要目标是缩短住院时间和降低医疗费用2。。在日本,许多疾病的临床路径在 1990 年代开始引入,这与 DPC(诊断程序组合)系统的引入相吻合。临床路径被认为对于提高医疗服务质量、员工培训和促进以患者为中心的团队医疗服务(包括加强知情同意)很重要。
为了进行食道癌并发症少的安全的围手术期管理,国内外各机构进行了各种努力。对入侵的反应。随着腹腔镜手术等微创手术的引入,引入食管癌临床路径作为安全的围手术期管理程序的设施数量正在增加。很少有报道证明其实际有用性3 , 4)。
近年来,欧洲和美国将加速术后恢复(ERAS)或快速手术等新概念引入围手术期管理。ERAS 小组于 2001 年在欧洲临床营养与代谢学会 (ESPEN) 中成立,并于 20045 年宣布了结肠切除术的 ERAS 方案,此后进行了各种研究,并将其应用于手术的围手术期管理。快速通道手术是一项多学科康复计划,它全面引入了旨在术后早期恢复的循证程序,目前几乎与 ERAS 同义。最近,ERAS 和快速通道手术在食管切除术中的临床意义已经被研究,有报道说术后并发症、住院时间和死亡率降低,但目前的证据并不高 6-9。)。
对于食管癌围手术期管理,各机构独立建立的临床路径的有效性进行了比较和检验,其临床意义有待验证。
参考
1)日本临床路径学会。http://www.jscp.gr.jp/index.html2)Zehr KJ 等人:主要胸部病例的标准化临床护理路径降低了医院成本。Ann Thorac Surg. 1998; 66(3): 914-9。3)低 DE 等:食管切除术——不再只是死亡率:标准化的围手术期临床路径改善食管癌患者的预后。J Gastrointest Surg. 2007;11(11): 1395-402。四)Munitiz V 等人:经胸 (Ivor Lewis) 食管切除术后促进恢复的书面临床路径的有效性。 British J Surg. 2010;97(5):714-8。五)Fearon KC 等人:加速术后恢复:对结肠切除术患者临床护理的共识审查。Clin Nutr. 2005;24(3):466-77。6)Findlay JM, et al: The effect offormalizing enhanced recovery after esophagectomy with a protocol. Dis Esophagus. 2015; 28(6): 567-73。7)Findlay JM 等人:促进食管切除术的恢复:系统评价和循证指南. Ann Surg. 2014; 259(3): 413-31。8)Markar SR 等人:增强的恢复途径可改善食管切除术后的术后结果:系统评价和汇总分析。Dis Esophagus. 2015;28(5):468-75。9)Shewale JB 等人;德克萨斯大学医学博士安德森食管癌协作组:快速食管切除术方案对食管癌患者结果和医院收费的影响. Ann Surg. 2015; 261(6): 1114-23。
临床问题
CQ25预防食管癌术后并发症的推荐围手术期管理是什么?
证据强度B.在食管癌的围手术期管理中,我们弱推荐术前呼吸康复,术后早期引入肠内营养,围手术期给予甲泼尼龙预防术后并发症。(同意率80% [16/20])
评论
通过对该CQ的文献检索,初步筛选出23篇与预防食管癌围手术期管理中术后并发症相关的论文。3项关于术前呼吸治疗有效性的随机对照试验,2项随机对照试验术后早期肠内营养、ERAS 1 篇综述和围手术期类固醇我们对四篇文章进行了定性和定量的系统评价,其中包括一篇荟萃分析。
1)关于术前呼吸治疗和呼吸康复
使用最近报道的三项随机对照试验1-3)对食管癌术前进行的呼吸治疗或呼吸康复的有效性进行了评估,并评估了术后肺炎和呼吸系统并发症作为结果。进行了荟萃分析。风险差的积分值为0.14,95% CI为0.02-0.27,p值为0.02(图1)。
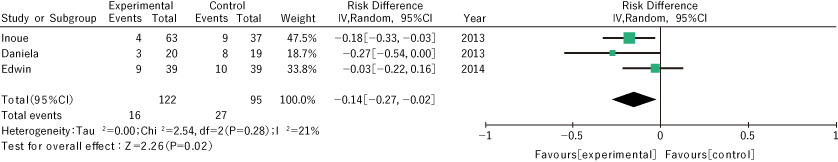
2)术后肠内营养治疗
我们评估了两项比较术后早期肠内营养与肠外营养的随机对照试验4、5),并以术后感染的发生率作为结果进行了荟萃分析。风险差异为0.38,95% CI 0.24-0.52(p值<0.00001),有证据表明术后早期肠内营养与肠外营养相比可减少伤口感染等术后感染(图2)。
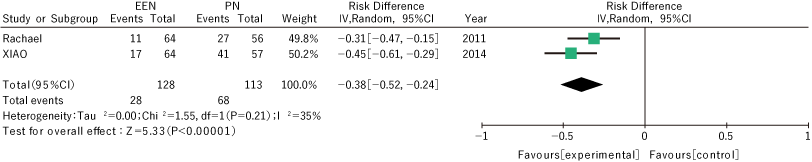
——以术后感染发生率为结局的荟萃分析——
另外, 20156年发表的一篇关于Enhanced Recovery for esophagectomy 的综述有一篇比较肠内和肠外营养的文章,包括一项荟萃分析、五项随机对照试验和一项观察性研究。各种,并且不可能进行包括这些的荟萃分析。
3)关于围手术期类固醇
由 Engelman 等人发表的一项荟萃分析 7 )。作为结果,甲基强的松龙与术后器官损伤(优势比 = 0.30)、呼吸系统并发症(优势比 = 0.41)、败血症(优势比 = 0.37)、肝损伤(优势比 = 0.18)和心血管疾病相关。被认为可以显着减少并发症,例如 没有报告类固醇的副作用,例如增加缝合失败或延迟伤口愈合。该荟萃分析后未检索到新报告,表明围手术期使用甲基强的松龙有助于预防术后并发症。
呼吸康复、肠内营养、类固醇给药都是保险医疗范围内可以进行的治疗,在管理上,我们弱推荐术前呼吸康复、术后早期引入肠内营养、围手术期给予甲泼尼龙。预防术后并发症。”
参考
1)van Adrichem EJ 等人:比较两种术前吸气肌训练计划以预防接受食管切除术的患者出现肺部并发症:一项随机对照试验研究。Ann Surg Oncol. 2014;21(7):2353-60。2)Inoue J, et al: 通过食管癌患者的强化术前呼吸康复预防术后肺部并发症. Dis Esophagus. 2013; 26(1): 68-74.3)Dettling DS 等:食管切除术患者术前吸气肌训练的可行性和有效性:一项初步研究. Physiother Res Int. 2013;18(1): 16-26。四)小博 Y 等:术后早期肠内营养对食管切除术后患者支持的疗效. Minerva Chir. 2014; 69(1): 37-46.五)Barlow R, et al: Prospective multicentre randomised controlled trial of early enterental Nutrition for patients getting接受上消化道大手术切除术. Clin Nutr. 2011; 30(5): 560-6.6)Findlay JM 等人:促进食管切除术的恢复:系统评价和循证指南. Ann Surg. 2014; 259(3): 413-31。7)Engelman E 等人:术前单剂量皮质类固醇给药对术后发病率的影响. J Gastrointest Surg. 2010; 14(5): 788-804。
CQ26您是否建议在食管癌的围手术期管理中引入临床路径?
证据强度C。我们强烈建议在食管癌的围手术期管理中引入临床路径。(同意率100% [20/20])
评论
通过对该CQ的文献检索,初步筛选出18篇论文,排除了在二次筛选中被认为内容不合适的论文。,1项前瞻性队列研究2),6项回顾性队列研究1- 8),共对8篇文章进行了定性和定量的系统评价。所有这些论文都检查了 ERAS 或快速手术的效果,而不是经典的临床路径。ERAS 和快速通道手术方案的本质是“为围手术期专门创建的临床路径大纲”,不同于现有的临床路径在每个设施单独设置和验证。相反,它通过证据来验证并得到ESPEN等全球学术组织的推荐。
所有这些文章都指出,作为引入 ERAS 或快速手术的结果,术后住院时间缩短了,但只有一项前瞻性研究提供了有限的证据。
使用五项观察性研究进行了荟萃分析,这些研究报告说引入临床途径可以改善呼吸系统并发症的发生率。综合值为 0.07 的风险差、0.01-0.13的95% CI 和 0.03 的 p 值。
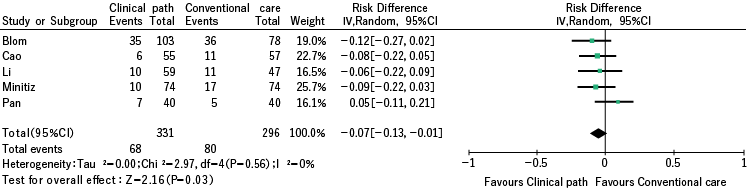
- 以呼吸系统并发症发生率作为结果的荟萃分析 -
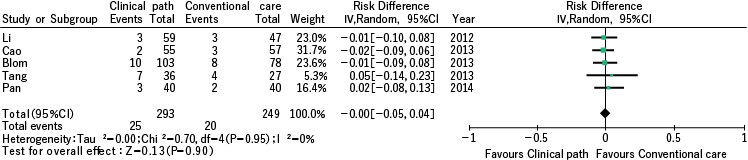
另一方面,使用五项回顾性研究进行荟萃分析,以再入院率作为结果,但未观察到显着差异,风险差异为 0.00 (95% CI -0.05-0.04),p 值为 0.90 (图 2 ). ).
以上审阅的论文均为海外报道,Ivor Lewis食管胃切除术(ILOG)在外科手术方面的观察性研究较多,期待日本的报道。
综上所述,引入最初由循证方案(如 ERAS 或快速通道手术)建立的综合围手术期临床路径将在一定程度上有用。然而,从当前报告及其分析中获得的证据强度被评为 C。
引入临床路径是一种可以在保险医疗范围内实施的治疗,我们强烈建议
参考
1)Findlay JM 等人:Maynard 增强食管切除术的恢复:系统评价和循证指南. Ann Surg. 2014; 259(3): 413-31。2)Ford SJ 等人:食管胃切除术后增强恢复计划的实施和有效性:一项前瞻性队列研究。Int J Surg. 2014;12(4):320-4。3)Cao S 等:食管切除术后的快速康复计划和常规护理:一项回顾性对照队列研究。支持护理癌症。2013;21(3):707-14。四)Blom RL 等人:食管手术中增强恢复方案的初步经验 World J Surg. 2013;37(10):2372-8。五)Li C, et al: An增强的恢复途径减少食管切除术后的停留时间。Surgery. 2012; 152(4): 606-14。6)Munitiz V 等人:书面临床路径在经胸 (Ivor Lewis) 食管切除术后促进恢复的有效性。Br J Surg. 2010;97(5):714-8。7)Pan H 等人:对接受微创食管切除术的患者使用快速手术方案:初步结果。Interact Cardiovasc Thorac Surg. 2014;19(3):441-7。8)Tang J 等人:通过实施加速康复包缩短接受食道和胃切除术的患者的住院时间。Ann R Coll Surg Engl. 2013;95(5):323-8。
第六章不可切除的晚期/复发性食管癌的化疗
包起来
化疗在许多情况下被用作治疗食管癌的唯一全身疗法。它用于cStage I-IV局部食管癌的放化疗和术前化疗,以及不可切除的晚期/复发性食管癌。对于不可切除的晚期/复发性食管癌,使用顺铂+5-FU联合治疗,尽管没有明确的证据表明可以延长生存期。紫杉烷类和其他药物在这些药物难治性时也可用作二线治疗,但报告仅限于少数 II 期试验,其使用需要谨慎。
一般说明
全身化疗是不可切除的晚期或复发性食管癌的标准治疗。尽管在与未治疗组的比较研究中没有显示出明显的生存益处,但已经报道了单药或联合治疗的疗效,化疗是标准治疗。
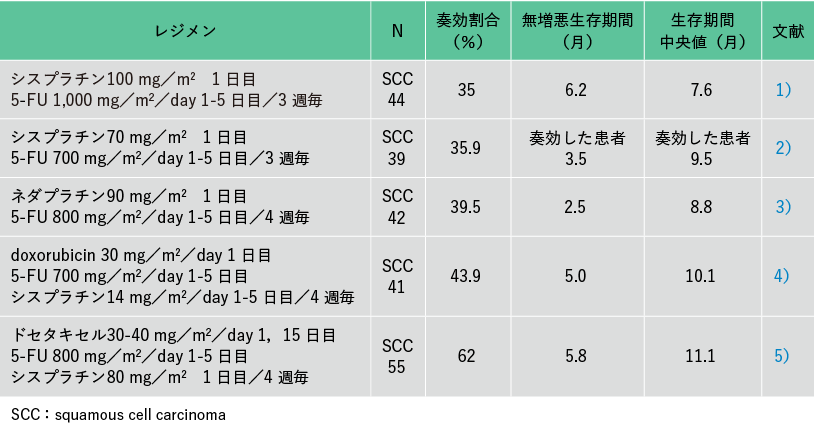
1 已被证明在一线治疗中有效的药物和联合治疗
据报道,作为单一药物,5-FU、铂类药物、紫杉烷类药物和长春花生物碱的反应率为 15-40%,中位生存时间为 3-10 个月。据报道,联合治疗的反应率比单一药物高 20% 至 60%(表 1)1-3)。虽然有很多关于两种或三种药物联合治疗的报道,但只有一份报告将它们与单一药物进行了比较,而且大多是在少数患者中进行的 II 期试验的报道。顺铂+5-FU联合治疗,预期有协同作用,奈达铂+5-FU联合治疗作为两药联合治疗。顺铂和 5-FU 的联合治疗被认为是这些患者的标准治疗,有报道称三联疗法与紫杉烷类药物联合治疗的反应率高达 60% 。4、5 ),其对延长生存期的影响尚不清楚,目前希望将其用作临床研究的一部分。目前正在进行顺铂+5-FU联合治疗与多西他赛每2周一次的比较研究(JCOG1314研究),等待结果。
2 已被证明在二线治疗中有效的药物和联合治疗
当顺铂和 5-FU 难治时,没有药物在二线治疗中显示出明显的生存获益。应使用氟嘧啶类和铂类药物以外的已显示疗效的药物,但必须考虑毒性和利弊之间的平衡(表2)。紫杉类药物如多西他赛和紫杉醇通常作为单一药物给药6,7 )。重新给药用于一线治疗和多药治疗的药物8 )对该受试者的意义尚不清楚。
关于分子靶向药物的报道很少,但是关于EGFR抑制剂的报道有,据报道有效率在10-20%。一项安慰剂和吉非替尼(一种表皮生长因子受体 (EGFR) 抑制剂)在食管癌(包括腺癌)二线治疗患者中的比较研究并未证明吉非替尼的疗效10 )。尽管未来生物标志物的开发可能会显示其在某些特定受试者中的有用性,但目前尚不清楚 EGFR 抑制剂在食管癌中的有用性。
3 已被证明在三线治疗中有效的药物和联合治疗
如果患者对上述药物变得难治或不耐受,建议进行姑息性对症治疗,因为没有报告显示明显疗效。具有新作用机制的免疫检查点抑制剂 nivolumab 的疗效已在 II 期试验中得到报道9 ),但临床应用仍需等待 III 期对比试验的结果。
参考
1)Bleiberg H 等人:顺铂和 5-氟尿嘧啶 (5-FU) 与单独顺铂治疗晚期鳞状细胞食管癌的随机 II 期研究。Eur J Cancer. 1997;33(8):1216-20。2)Iizuka T 等人:顺铂和 5-氟尿嘧啶在晚期食管鳞状细胞癌中的 II 期评估:日本食管肿瘤学组试验。Jpn J Clin Oncol. 1992;22(3):172-6。3)Kato K,et al ;日本临床肿瘤学组 (JCOG) 的日本食管肿瘤学组:奈达铂和 5-氟尿嘧啶治疗食管转移性鳞状细胞癌的 II 期研究:日本临床肿瘤学组 (JCOG) 试验( JCOG 9905-DI). 食道. 2014; 11(3): 183-8.四)Honda M 等人:多柔比星、顺铂和氟尿嘧啶联合治疗转移性食管鳞状细胞癌。Dis Esophagus. 2010;23(8):641-5。五)Hironaka S 等人;日本食管肿瘤学组/日本临床肿瘤学组:2 周多西他赛联合顺铂加氟尿嘧啶治疗转移性食管癌的 I/II 期试验 (JCOG0807). Cancer Sci. 2014; 105(9): 1189 - 95。6)Muro K 等:转移性食管癌患者单药多西他赛的 II 期研究. Ann Oncol. 2004;15(6):955-9。7)Kato K, et al: 每周 1 小时输注紫杉醇治疗先前接受铂类化疗的晚期或复发性食管癌患者的 II 期研究. Cancer Chemother Pharmacol. 2011; 67(6): 1265-72.8)Jin J 等人:多西他赛和奈达铂的二线联合化疗治疗顺铂预处理的难治性转移性/复发性食管鳞状细胞癌。J Thorac Oncol. 2009;4(8):1017-21。9)Kudo T 等人:Nivolumab 治疗食管鳞状细胞癌:一项开放标签、多中心、2 期试验。Lancet Oncol. 2017;18(5):631-9。十)Dutton SJ 等人:吉非替尼治疗化疗后进展的食管癌 (COG):一项 3 期、多中心、双盲、安慰剂对照随机试验。Lancet Oncol. 2014;15(8): 894-904。
临床问题
CQ27推荐哪种化学疗法作为不可切除的晚期/复发性食管癌的一线治疗?
证据强度C。顺铂 + 5-FU 治疗被弱推荐为不可切除的晚期或复发性食管癌的一线治疗。(同意率95% [19/20])
评论
对该CQ进行文献检索,提取PubMed:401篇,Cochrane:372篇,Ichushi:76篇,并添加1篇。初筛提取论文36篇,二次筛选提取论文31篇。我们对 2 项随机对照试验和 27 项试验进行了定性系统评价,在这些试验中,化疗干预作为随机试验进行,涉及本 CQ 的目的。
与未治疗组相比,没有任何化学疗法可以明显延长不可切除的晚期或复发性食管癌的生存期。比较顺铂单药治疗与顺铂加 5-FU 的较早试验未显示联合治疗的优越性。此外,一项对顺铂+5-FU 治疗联合和不联合西妥昔单抗的比较研究并未显示出明显的西妥昔单抗附加作用。然而,据报道,顺铂+5-FU联合治疗的反应率约为30%,中位生存时间为6.6-9.5个月1-4),目前被公认为标准治疗。已有报道联合使用紫杉醇5 )、伊立替康6)、卡培他滨7)和顺铂代替5-FU,该法的临床定位不明确。大约 10% 的不良事件包括 3 级或更高级别的中性粒细胞减少、恶心和不适。奈达铂+5-FU 联合治疗(顺铂替换为奈达铂)也被报告为II 期研究,反应率为39.5%,中位生存时间为8.8 个月。8 )。由于目标不是治愈,而是延长生命,因此需要在考虑不良事件程度和患者意愿的同时,慎重决定是否继续治疗。
近年来,有报道称三药联合化疗疗效显着,缓解率约为60%,中位生存期为10个月或更长9-13)。与目前的护理标准顺铂加 5-FU 相比,长期生存的优势尚未得到证实,因此应仔细考虑其使用。目前,JCOG1314顺铂+5-FU联合治疗联合多西他赛每2周一次的随机对照试验正在进行中14 ),等待结果。所有治疗都包含在健康保险中。
考虑到利弊平衡、证据水平和患者偏好,推荐声明是“我们弱推荐顺铂和 5-FU 治疗作为不可切除的晚期/复发性食管癌的一线治疗。”。
参考
1)Iizuka T 等人:顺铂和 5-氟尿嘧啶在晚期食管鳞状细胞癌中的 II 期评估:日本食管肿瘤学组试验。Jpn J Clin Oncol. 1992;22(3):172-6。2)Hayashi K 等人:在晚期食管鳞状细胞癌中长期输注顺铂和 5-氟尿嘧啶的 II 期评估:日本食管肿瘤学组 (JEOG) 试验 (JCOG9407)。Jpn J Clin Oncol. 2001;31 (9 ):419-23。3)Bleiberg H 等人:顺铂和 5-氟尿嘧啶 (5-FU) 与单独顺铂治疗晚期鳞状细胞食管癌的随机 II 期研究。Eur J Cancer. 1997;33(8):1216-20。四)Lorenzen S 等人:西妥昔单抗联合 cisplatin-5-fluorouracil 与 cisplatin-5-fluorouracil 单独治疗食管转移性鳞状细胞癌的一线治疗:Arbeitsgemeinschaft Internistische Onkologie 的一项随机 II 期研究。Ann Oncol. 2009;): 1667-73。五)Zhang X, et al: 紫杉醇和顺铂在晚期食管鳞状细胞癌患者中的 II 期试验. Am J Clin Oncol. 2008; 31(1): 29-33.6)Lee DH, et al: A II 期试验,每周一次改良伊立替康和顺铂治疗未接受化疗的转移性或复发性食管鳞状细胞癌患者。Cancer Chemother Pharmacol. 2008;61(1):83-8。7)Lee J, et al: 卡培他滨和顺铂 (XP) 作为晚期食管鳞状细胞癌患者一线化疗的 II 期研究. Cancer Chemother Pharamcol. 2008; 62(1): 77-84.8)Kato K,et al ;日本临床肿瘤学组(JCOG)的日本食管肿瘤学组:奈达铂和 5-氟尿嘧啶治疗食管转移性鳞状细胞癌的 II 期研究:日本临床肿瘤学组(JCOG)试验( JCOG9905 -DI). 食道. 2014; 11(3): 183-8.9)Ilson DH 等人:紫杉醇、氟尿嘧啶和顺铂在晚期食管癌患者中的 II 期试验。J Clin Oncol. 1998;16(5):1826-34。十)Takahashi H 等人:多西他赛/顺铂/氟尿嘧啶联合化疗治疗转移性食管鳞状细胞癌的 I/II 期研究。J Thorac Oncol. 2010;5(1):122-8。11)Tamura S 等人;Osaka Gastrointestinal Cancer Chemotherapy Study Group:多西他赛、顺铂和 5-氟尿嘧啶 (DCF) 治疗转移性食管癌的 II 期研究 (OGSG 0403)。Anticancer Res. 2012;32(4):1403-8。12)Hironaka S 等人;日本食管肿瘤学组/日本临床肿瘤学组:2 周多西他赛联合顺铂加氟尿嘧啶治疗转移性食管癌的 I/II 期试验 (JCOG0807). Cancer Sci. 2014; 105(9): 1189 - 95。13)Miyazaki T 等人:多西他赛、奈达铂和 5-氟尿嘧啶联合化疗治疗晚期食管癌的 II 期研究. Ann Surg Oncol. 2015;22(11):3653-8。14)Kataoka K 等人;日本食管肿瘤学组/日本临床肿瘤学组:一项随机对照 III 期试验,比较 2 周多西他赛联合顺铂加氟尿嘧啶(2 周 DCF)与顺铂加氟尿嘧啶(CF)治疗转移性或复发性患者食管癌:日本临床肿瘤学组研究 JCOG1314(MIRACLE 研究)的基本原理、设计和方法。Jpn J Clin Oncol. 2015;45(5):494-8。
CQ28如果顺铂 + 5-FU 作为不可切除的晚期或复发性食管癌的一线治疗无效,推荐哪种化疗作为二线治疗?
证据强度C。如果不能切除的晚期或复发性食管癌对顺铂+5-FU治疗作为一线治疗无效,我们弱推荐紫杉醇治疗和多西他赛治疗作为二线治疗。(100%一致率[18/18])
评论
作为该CQ的文献检索结果,PubMed:445篇,Cochrane:254篇,Ichushi:156篇,添加1篇。初筛抽取14篇论文,二次筛选抽取11篇论文。对 1 项以 CQ 为目的的随机对照试验和 7 项进行化疗干预的试验进行了定性系统评价。
顺铂和5-FU的联合治疗被广泛用作不可切除的晚期或复发性食管癌的一线治疗,其他药物常用于治疗失败的病例。进行了一项比较 EGFR 抑制剂吉非替尼与安慰剂在不可切除的晚期或复发性食管癌二线治疗中的随机试验。总生存期、主要终点(安慰剂组:3.67个月,吉非替尼组:3.73个月,风险比:0.90(95% CI:0.74-1.09))无显着差异。判断为1)。对于其他药物,已经报道了单臂 II 期试验的结果。紫杉醇100 mg/m 2每周给药6次,每7周重复一次,缓解率为44.2%,中位生存时间为10.4个月,效果较好2 )。每3 周70 mg/m2 的单药多西他赛给药导致 16% 的反应率和 8.1 个月的中位生存时间(包括一线治疗病例)3)。虽然在对比研究中没有观察到明显的生存获益,但考虑到单纯姑息性对症治疗的预后为3~6个月,以上2种药物推荐给病情相对较好的患者,被认为是有效的。此外,伊立替康与多西他赛的联合治疗、紫杉醇与顺铂的联合治疗、多西他赛与奈达铂的联合治疗均有报道,但每种疗法的疗效均显着高于单药治疗,但并未认识到差异。
不良事件方面,紫杉醇给药后3级或以上中性粒细胞减少发生率为52.8%,发热性中性粒细胞减少发生率为3.8%,肺炎发生率为7.5%,其中88%发生中性粒细胞减少,其次为感染。联合治疗往往具有高毒性,在 21% 的接受伊立替康和多西他赛治疗的患者中,有 1 例治疗相关死亡因肺炎和 3 级或更高级别的疲劳。多西他赛与顺铂联合治疗的患者中,32%的患者出现3级以上的疲劳,很难积极推荐多药联合治疗作为下一步治疗。
需要注意的是,这些证据是针对可以参加临床试验的条件较好的患者。对于食管狭窄、误吸易发生肺炎的晚期食管癌患者,中性粒细胞减少可能导致致命的不良反应。因此,有必要在仔细评估患者病情、支持治疗体系、不良反应风险评估等后做出决定,并根据病情考虑不给予化疗。由于目标不是治愈,而是延长生命,因此需要在考虑不良事件程度和患者意愿的同时,慎重决定是否继续治疗。所有治疗都包含在健康保险中。
考虑到利弊的平衡、证据的程度和患者的偏好,建议将紫杉醇作为对顺铂和 5-FU 治疗无效的不可切除的晚期或复发性食管癌患者的二线治疗。 '' 疗法,不推荐多西他赛疗法。”
参考
1)Dutton SJ 等人:吉非替尼治疗化疗后进展的食管癌 (COG):一项 3 期、多中心、双盲、安慰剂对照随机试验。Lancet Oncol. 2014;15(8): 894-904。2)Kato K, et al: 每周 1 小时输注紫杉醇治疗先前接受铂类化疗的晚期或复发性食管癌患者的 II 期研究. Cancer Chemother Pharmacol. 2011; 67(6): 1265-72.3)Muro K 等:转移性食管癌患者单药多西他赛的 II 期研究. Ann Oncol. 2004;15(6):955-9。
第七章 放射治疗
包起来
对于根治性放疗,推荐同时进行化疗。对于可切除的晚期癌症,目前正在考虑引入术前放化疗作为临床试验。在不可切除的病例中,根据 PS 指示单独放化疗或放疗。cStage IVb 食管癌伴梗阻可考虑姑息性放疗。放化疗的总剂量通常为 60 Gy 或 50.4 Gy,应避免不必要的延长治疗时间。
一般说明
随机对照试验及其荟萃分析表明,在确定性治疗方面,同步放化疗比单独放疗更有效1,2 )。因此,除了由于年龄或合并症而难以同时使用的病例外,更推荐放化疗。
放射治疗适用于病变局限于局部或区域淋巴结的患者。T1a或T1b患者内镜治疗后有残留癌或有淋巴结转移的可能,可考虑加用(化)放疗。
术前化疗和手术是日本可切除晚期癌症的标准治疗方法,而放化疗则针对不适合手术或不想接受手术的患者。此外,目前正在对该受试者的临床试验研究术前放化疗。在无法切除的情况下,如果 PS 良好,可能需要放化疗,然后可以考虑手术。对于 PS 较差的患者,可考虑单独放疗。对于阻塞性 cStage IVb 食管癌,可考虑姑息性放疗。放射治疗可用于无远处转移的术后复发,以及术后残留或未治疗的病例。
目前,大多数设施都使用 CT 进行三维治疗计划,并且正在考虑肿瘤和危险器官的剂量进行高精度治疗。单独使用放疗时,由于肿瘤细胞再生加速,局部控制率可能会降低,因此应避免不必要的延长治疗时间3 )。关于确定性治疗的最佳总剂量,主要由美国 RTOG(Radiation Therapy Oncology Group)进行的放化疗中总剂量 50.4 Gy 和 64.8 Gy 的随机对照试验显示高剂量组具有优势。4). 在日本,主要报道了使用 60 Gy 的放化疗,但考虑到放化疗和根治性照射后的抢救手术导致的晚期毒性降低,使用 50.4 Gy 的临床试验也在进行中。临床上应结合全身情况、肿瘤体积、照射范围、危险器官剂量等因素确定剂量。对于单独的放射治疗,通常规定 60 至 70 Gy。
参考
1)Herskovic A 等人:联合化疗和放疗与单独放疗相比食管癌患者。N Engl J Med. 1992;326(24):1593-8。2)Wong R 等人:联合化疗和放疗(无手术)与单独放疗相比局部食管癌。Cochrane Database Syst Rev. 2006;25(1):CD002092。3)Nishimura Y 等人:用放射治疗治疗食管癌:总治疗时间和分割的影响。Int J Radiat Oncol Biol Phys. 1994;30(5):1099-105。四)Minsky BD 等人:INT 0123(放射治疗肿瘤学组 94-05)食管癌联合治疗的 III 期试验:高剂量与标准剂量放射治疗。J Clin Oncol. 2002;20(5): 1167-74。
临床问题
CQ29您是否建议避免因放疗暂停而延长放疗时间?
证据强度C。强烈建议不要延长放射治疗的持续时间。(同意率95% [19/20])
评论
考虑到肿瘤细胞的加速再生,实体瘤的放射治疗应避免不必要的延长治疗周期。PubMed:185 篇文章,Cochrane:192 篇文章,Ichushi:119 篇文章作为对该 CQ 的文献搜索的结果进行了初步筛选。二次筛选后,我们对五项随机对照试验和四项观察性研究进行了定性系统评价。
五项随机对照试验比较了采用不同剂量分割方法和不同照射时间的治疗结果1-5 )。一份报告显示,与常规分段照射的 7-8 周的照射期相比,晚期加速分段照射的治疗期缩短约 1 周至 6.4 周时,局部控制率和存活率显着提高。1),有一份报告指出治疗结果有改善的趋势,但没有显着差异2)。一份报告称,与传统的分次照射相比,尝试通过每周进行七次照射(包括周六和周日)来缩短治疗时间,并显示出局部主要效果的改善 3 )。另一方面,当比较 6.4 周的晚期加速分次照射与 4.4 周的全时加速分次照射时,有报道称后者仅增加了不良事件,并没有改善治疗结果4 )。此外,在一项比较常规分次照射与 2 Gy 剂量和每剂量 2.5 Gy 和 3 Gy 剂量的研究中,导致每剂量 21-23 次 2.5 Gy(总治疗期为 30 天 +/- 3 天)生存率明显提高 5 )。这五项随机对照试验均评估了通过加速超分割照射或增加单次剂量来缩短照射时间的效果,并没有直接考察停药延长照射时间的效果。
观察性研究报告说,在单独放疗的情况下,局部控制率会随着治疗时间的延长而降低6-9)。虽然没有获得足够的证据来说明可以容忍多少延长,但据报道,对于大于 5 cm 的肿瘤,延长照射时间 1 周并休息一段时间相当于损失 1.8 Gy。一份报告是编制6),另有报道称照射时间延长1天后局部控制率下降2.3% 7)。由于存在多种混杂因素可能会影响生存率等治疗结果的恶化,因此有观察性研究表明“延长照射时间”本身是否有效果的充分理由。没有。
由于处理急性不良事件,通过暂停延长照射时间通常在临床上是不可避免的,并且不是基于患者的意愿。此外,关于放疗的保险待遇也没有区别。在放射治疗的情况下,如上所述,局部控制率可能随着照射时间的延长而降低。然而,没有报告提供与该 CQ 一致的有力证据,并且尚不清楚辐照时间延长到何种程度是允许的。考虑到利弊的平衡、证据的程度和患者的意愿,建议是“我们弱建议不要延长放射治疗中的照射时间”。
参考
1)Shi XH, et al: 食管癌放射治疗的晚期加速分割. Radiother Oncol. 1999; 51(1): 21-6.2)Wang JH, et al: 常规分数和晚期加速超分割三维适形放射治疗食管癌的随机对照试验. Cell Biochem Biophys. 2012; 62(1): 107-12.3)Sun SP 等人:食管癌患者每周 7 天连续加速照射的随机临床试验:关于肿瘤反应和急性毒性的初步报告。World J Gastroenterol. 2006;12(43):7047-50。四)Wang Y, et al: 食管癌连续加速超分割和晚期加速超分割放疗的比较. Int J Radiat Oncol Biol Phys. 2002; 54(1): 131-6。五)Ma Z, et al: Analysis of different fractionation of 3-dimensional conformable radiotherapy for esophageal cancer. Int J Clin Exp Med. 2015; 8(7): 11139-45.6)Kajanti M 等人:整体治疗时间对食管鳞状细胞癌根治性放疗局部控制的影响。Int J Radiat Oncol Biol Phys. 1995;32(4):1017-23。7)Nishimura Y 等人:用放射治疗治疗食管癌:总治疗时间和分割的影响。Int J Radiat Oncol Biol Phys. 1994;30(5):1099-105。8)Nishimura Y 等人:头颈癌、食道癌和宫颈癌分次放射治疗的最佳总治疗时间。日本放射肿瘤学会杂志。1996;8(4):303-15。9)Kenji Nemoto 等人:浅表性食管癌放疗的结果——单独外照射治疗病例的研究。日本放射肿瘤学会杂志。1999;11(3):207-13。
转贴CQ14对于 PS 较差的 cStage IVa 食管癌,是否应该推荐放射治疗?
证据强度D.对于 PS 较差的 cStage IVa 食管癌,我们弱推荐放疗。(同意率95% [19/20])
评论
参考第三章食管癌治疗算法及基于算法的治疗策略4
.cStage IV CQ14
转贴CQ17对于 cStage IVb 食管癌伴梗阻,您是否推荐姑息性放疗?
证据强度C。对于阻塞性 cStage IVb 食管癌,我们强烈推荐姑息性放射治疗。(同意率100% [20/20])
评论
参考第三章食管癌治疗算法及基于算法的治疗策略4
.cStage IV CQ17
第八章 多学科治疗
1 术前术后辅助治疗
包起来
目前,日本cStage II和III期胸段食管癌的标准治疗是顺铂+术前化疗+5-FU+手术。另一方面,在欧美,术前放化疗加手术是标准治疗。目前正在进行一项随机对照试验(JCOG1109 研究),以评估 DCF 治疗与多西他赛和术前放化疗(顺铂 + 5-FU,放疗 41.4 Gy)相比目前的顺铂 + 5-FU 治疗的优越性。
一般说明
对于食管癌,近年来开展了化疗、放疗和手术相结合的多学科治疗。在日本,JCOG9204 试验比较了手术单药治疗和术后化疗与顺铂加 5-FU1 )。虽然在同一研究中两组的总生存期无显着差异,但单纯手术组的无复发生存期(DFS)为 5 年,DFS 为 45%,而术后为 5 年化疗组DFS同比显着提高至55%,这种预后作用在淋巴结转移病理阳性的患者中尤为明显。因此,在当时的日本,对于手术切除后经组织病理学诊断证实有淋巴结转移的病例,术后化疗被认为是标准的治疗策略。在随后的JCOG9907研究中,研究了顺铂+5-FU辅助化疗的时机,术前化疗组的总生存期更长(5年生存率比术后化疗组为55% vs. 43%) ),这被证明明显更好2 )。因此,日本 cStage II 和 III 期胸段食管癌的标准治疗策略是术前化疗,顺铂加 5-FU,然后进行根治性手术。
另一方面,在欧美,术前放化疗是术前化疗和放疗相结合,然后进行根治性手术的标准治疗方法。尽管术前放化疗比术前化疗提供了更高的局部控制率,但它可能会增加围手术期并发症和手术相关死亡率。在日本,已经进行了高精度淋巴结切除术以进行局部控制,并且认为术前放射治疗是不必要的。由于在欧洲和美国通过手术进行局部控制还不够充分,许多随机对照试验已报道,以验证术前放化疗的有效性3)。在荷兰进行的大规模随机对照试验 CROSS 试验中,术前放化疗+手术组与单纯手术组相比显着延长了总生存期(中位总生存期 49.4 个月 vs. 24.0 个月)4)。另一方面,两组术后并发症发生率无显着差异。
JCOG9907试验的亚组分析结果提示,目前术前化疗顺铂+5-FU对cStage III胸段食管癌患者的预后效果可能不够,认识到有必要增加术前气胸化疗或强调局部控制的术前放化疗。紫杉烷类抗肿瘤药(紫杉醇/多西他赛)是被认为对食管癌有效的药物之一。目前,将上述顺铂+5-FU疗法与多西紫杉醇相结合的DCF疗法备受关注。2012年开始的JCOG1109试验是一项随机对照试验,旨在研究DCF治疗和术前放化疗(顺铂+5-FU,放疗41.4 Gy)对目前顺铂+5-FU治疗的优越性。为了在日本建立cStage II 和III 胸段食管癌的标准治疗方法5 )。
参考
1)Ando N 等人:手术加化疗与单独手术治疗胸段食管局部鳞状细胞癌的比较:日本临床肿瘤学组研究--JCOG9204. J Clin Oncol. 2003; 21(24): 4592-6。2)Ando N 等人:一项随机试验比较术后辅助化疗与顺铂和 5-氟尿嘧啶与术前化疗治疗局部晚期食管鳞状细胞癌 (JCOG9907)。Ann Surg Oncol. 2012;19(1): 68-74 .3)Sjoquist KM 等:可切除食管癌的新辅助化疗或放化疗后的生存:更新的荟萃分析。Lancet Oncol. 2011;12(7): 681-92。四)van Hagen P 等人:食管癌或结节癌的术前放化疗。N Engl J Med. 2012;366(22):2074-84。五)Nakamura K 等人:比较顺铂加 5-FU (CF) 与多西他赛、顺铂加 5-FU (DCF) 与 CF 放疗 (CF-RT) 作为局部晚期食管癌术前治疗的三组 III 期试验。 JCOG1109, NExT 研究). Jpn J Clin Oncol. 2013; 43(7): 752-5。
临床问题
转贴
CQ9cStage II和III期食管癌在以手术治疗为主的情况下,推荐术前化疗、术后化疗或术前放化疗哪一种?
证据强度B.以手术为主治疗cStage II或III期食管癌时,(
1)与术前术后化疗相比,强烈推荐术前化疗。(同意率89.5% [17/19])证据强度C。(2)在比较术前化疗和术前放化疗时,弱推荐术前化疗。(同意率100% [18/18])
评论
参考第三章食管癌治疗算法及基于算法的治疗策略3
.cStage II, III CQ9
转贴CQ10如果cStage II或III期食管癌进行新辅助治疗+手术,是否推荐术后辅助治疗?
证据强度D.如果 cStage II 或 III 胸段食管鳞状细胞癌进行新辅助治疗和手术,强烈建议不要进行术后化疗。(同意率85% [17/20])
评论
参考第三章食管癌治疗算法及基于算法的治疗策略3
.cStage II, III CQ10
转贴CQ11如果 cStage II 或 III 期食管癌在没有术前治疗的情况下进行手术,是否推荐术后化疗?
证据强度C。我们强烈建议 cStage II 和 III 食管癌在没有术前治疗的情况下进行手术,如果组织病理学结果为淋巴结转移阳性,则进行术后化疗。(同意率85% [17/20])
评论
参考第三章食管癌治疗算法及基于算法的治疗策略3
.cStage II, III CQ11
2 放化疗
包起来
放化疗已被证明比单独的放射治疗更能延长局部晚期食管癌患者的生存期。在进行非手术治疗时,它被定位为标准治疗,针对cStage 0-IVa的适应症为根治性放化疗。有报道在可切除的病例中,放化疗与单纯手术的疗效相当,但没有直接的比较研究。由于推定放化疗和手术的效果更优,因此定位为手术效果不佳的患者的一种选择。耐受者或拒绝手术者。重要的是选择合适的放射剂量、照射范围和化疗,考虑治疗策略,包括放化疗后残留/复发病例的抢救治疗。
一般说明
1) cStage 0, I 的放化疗
放化疗适用于周围 3/4 或更多周长的病变,以及浸润到黏膜下层以下且内镜检查困难的病变。JCOG9708 研究显示了良好的结果,完全缓解率为 87.5%,4 年生存率为 80.5% 1)。9例(12.5%)治疗后残留癌变,30例(41%)复发,9例发现无功能病灶。已知 cStage I 患者即使在完全缓解后也会在食管中出现复发或多发异时性病变2 )。在可以进行内窥镜治疗的阶段进行内镜检查并发现复发或多发性异时病变非常重要。
此外,据报道,10%~50%的病例在内镜下治疗后黏膜下浸润明显或黏膜内病变伴血管侵犯显示潜伏淋巴结转移。考虑为非根治性切除3)。淋巴结清扫术的根治性手术目前是此类病例的标准附加治疗,但有报道表明区域淋巴结预防性放化疗联合顺铂和 5-FU4 的有效性。)。在 JCOG 0508 研究中,对预计可通过内镜治疗的有限 cT1bN0 食管癌(最高 SM2)进行内镜治疗。对于接受过治疗的阳性疾病或 pT1b 患者的 3 年生存率(本研究的主要终点)预防性放化疗为 90.7%(90% CI,84.0-94.7)。另一方面,由于内镜治疗后切缘阳性而接受根治性放化疗的 15 名患者中有 3 名(20%)死于基础疾病。需要仔细验证以确定哪些 cT1bN0 病例适合这种治疗。该临床试验于 2016 年 6 月在美国临床肿瘤学会报告,正在等待发表。
2) cStage II 和 III 的放化疗
有报道称cStage II和III的放化疗相当于单纯手术5 ),但JCOG9906研究结果显示完全缓解率为62.2%,3年生存率为44.7%,5-年生存率为36.8%,虽然不能直接比较,但被认为不如相同受试者术前化疗+手术(5年生存率55%)的结果(JCOG9907研究)。推荐作为一种在某些情况下有望治愈的治疗方法6 )。在美国 RTOG 进行的 RTOG9405/INT0123 研究中,顺铂(75 mg/m2 ,第 1、29 天)和 5-FU(1,000 mg/m2 ,第 1-4、29-32 天)一组使用 50.4 Gy 和 64.8比较了 Gy 与化疗的组合,但 64.8 Gy 组显示出对延长生存期没有影响,尽管它具有剧毒7)。因此,顺铂(75 mg/m 2,第 1、29 天)和 5-FU(1,000 mg/m 2,第 1-4、29-32 天)联合化疗,剂量为 50.4 Gy。方案)被认为是放化疗的标准治疗之一。在日本进行的改良 RTOG (mRTOG) 方案的 II 期试验中,在原 RTOG 方案的基础上进行了区域淋巴结预防性照射的方案,完全缓解率为 70.6%,3-年生存率为63.8%。8 ). 与照射 60 Gy 的 JCOG9906 研究相比,使用 50.4 Gy 的 mRTOG 方案降低了晚期毒性,但应注意与增加化疗剂量相关的骨髓抑制、粘膜炎和胃肠道症状。此外,后文所述的抢救疗法的积极使用也有助于改善治疗效果。JCOG0909 研究调查了在 mRTOG 方案中添加补救治疗的标准以及补救治疗的安全性。
3) cStage IVa 的放化疗
手术切除是不可能的,但当疾病局限于放射野时,放化疗是标准治疗。在顺铂+5-FU联合60 Gy放疗的单中心II期试验中,完全缓解率为33%,3年生存率为23%,有报道生存率为31.5% , 9 ,10 )放化疗联合顺铂和 5-FU 是标准治疗。5-FU(700 mg/m 2,第 1-4 天,29-32 天)、顺铂(70 mg/m 2 ,第 1、29 天)和 5-FU(200 mg/m 2)、顺铂( 4 mg/m 2 ) 在第 1-5、8-12、15-19、22-26、29-33 和 36-40 天,然后是 60 Gy 的辐射剂量。两项比较联合治疗的随机试验未能找到低剂量化疗的明显益处11,12 )。DCF+放疗的临床试验,其中多西他赛联合顺铂+5-FU,报告了42.1%的良好完全缓解率。由于观察到中性粒细胞减少,有必要仔细考虑其适应症13 )。. 一项由强化诱导化疗后手术或放化疗组成的多学科治疗已被研究,并显示出良好的短期结果,1 年生存率为 67.9% 14),并计划进行一项比较研究 (JCOG1510)。
4) 用于放化疗的放射剂量和化疗
在 RTOG8501 中,对食管癌的单独放疗(64 Gy)和同步放化疗(顺铂 + 5-FU + 50 Gy)进行了比较。推荐15)。此外,一项关于化疗和放疗的荟萃分析报告说,与序贯联合化疗相比,化疗和放疗的时机与化疗和放疗联合可显着延长生存期16)。此外,在上述(RTOG9405/INT0123 研究中,无论是生存时间还是局部控制率,均未观察到高剂量组的优势2,第 1-4 天,29-32 天) 50.4 Gy 的伴随辐射剂量。在日本, 60 Gy 的辐射剂量使用较少的剂量,例如顺铂(70 mg/m 2,第 1、29 天)和 5-FU(700 mg/m217、18)。mRTOG 方案正在逐步引入多学科治疗,包括抢救治疗,其有效性已在 JCOG0909 试验中得到验证。
5) 根治性放化疗引起的不良事件
放化疗的不良反应主要分为急性毒性和晚期毒性。急性毒性主要发生在化疗和放疗联合阶段,发生在治疗开始后 1 至 2 个月。晚期毒性通常与辐射有关,并在治疗完成后数月至数年观察到。急性毒性包括胃肠道毒性、恶心、呕吐、肾功能不全、白细胞减少、食管炎和吞咽困难。)治疗指南” 20)等。晚期毒性包括放射性肺炎、胸腔积液、心包积液、缩窄性心包炎和甲状腺机能减退,这些影响约 10% 患者的日常生活21-23)。由于它可能是致命的,因此定期随访、询问呼吸困难等主观症状和早期治疗很重要。
6) 根治性放化疗后局部残留或复发病例的抢救治疗
当食管癌放化疗后局部病灶残留或复发时,可通过手术或内镜治疗获得长期生存。有报道称,抢救性手术在实现 R0 切除后可实现长期生存,但同时也有人指出,术后并发症的发生率和院内死亡率会增加24-28)。如果病变留在黏膜内,可以安全地进行抢救性内镜治疗29,30 )。据报道,光动力疗法 (PDT) 即使在怀疑浸润到黏膜下层和固有肌层时也是有效的,并且被认为是选择之一31)。
参考
1)Kato H 等人:I 期食管鳞状细胞癌放化疗的 II 期试验:日本临床肿瘤学组研究 (JCOG9708). Jpn J Clin Oncol. 2009; 39(10): 638-43。2)Motoori M 等:临床 T1bN0M0 食管癌患者根治性食管切除术和根治性放化疗的比较. Ann Surg Oncol. 2012;19(7):2135-41。3)Igaki H 等人:临床 I 期胸段食管鳞状细胞癌患者的临床病理学特征和生存期采用三区淋巴结清扫术治疗。Eur J Cardiothorac Surg. 2001;20(6):1089-94。四)Kawaguchi G 等人:内镜黏膜下剥离术继以放化疗治疗浅表食管癌的效果。Radiat Oncol. 2015;10:31。五)Hironaka S 等:T(2-3)N(any)M(0) 食管鳞状细胞癌患者根治性放化疗和根治性手术的非随机比较。Int J Radiat Oncol Biol Phys. 2003;57(2 ):425-33。6)Kato K 等人;日本临床肿瘤学组 (JCOG) 的胃肠道肿瘤学研究组:II-III 期食管鳞状细胞癌的 5-氟尿嘧啶和顺铂放化疗的 II 期研究:JCOG 试验 (JCOG 9906)。 Radiat Oncol Biol Phys. 2011;81(3):684-90。7)Minsky BD 等人:INT 0123(放射治疗肿瘤学组 94-05)食管癌联合治疗的 III 期试验:高剂量与标准剂量放射治疗。J Clin Oncol. 2002;20(5): 1167-74。8)Kato K 等人:II-III 期食管癌的 50.4 Gy 剂量同步放化疗联合选择性淋巴结照射的 II 期研究. Jpn J Clin Oncol. 2013; 43(6): 608-15。9)Ohtsu A 等人:针对 T4 和/或 M1 淋巴结鳞状细胞癌的确定性放化疗。J Clin Oncol. 1999;17(9):2915-21。十)Ishida K 等人:顺铂和 5-氟尿嘧啶联合放疗治疗晚期食管鳞状细胞癌的 II 期研究:日本食管肿瘤学组 (JEOG)/日本临床肿瘤学组试验 (JCOG9516)。Jpn J Clin Oncol。 2004;34(10):615-9。11)Nishimura Y 等人:顺铂/5-FU 同步放化疗治疗食管癌的随机 II 期研究的长期随访 (KROSG0101/JROSG021)。Jpn J Clin Oncol. 2012;42(9):807-12。12)Shinoda M 等人:低剂量与标准剂量放化疗治疗不可切除食管鳞状细胞癌的随机研究 (JCOG0303). Cancer Sci. 2015; 106(4): 407-12。13)Higuchi K 等人:多西紫杉醇、顺铂和 5-氟尿嘧啶 (DCF-R) 用于晚期食管癌的确定性放化疗 I 期试验:Kitasato 消化疾病和肿瘤学组试验 (KDOG 0501)。Radiother Oncol. 2008;87 (3):398-404。14)Yokota A 等人:多西他赛加顺铂和 5-氟尿嘧啶诱导化疗和随后的局部晚期不可切除食管癌的转换手术的化学选择 II 期研究。Br J Cancer. 2016;155(11):1328-34。15)Cooper JS 等人:局部晚期食管癌的化学放射治疗:前瞻性随机试验的长期随访 (RTOG 85-01)。放射治疗肿瘤学组。JAMA. 1999;281(17):1623-7。16)Wong RK 等人:联合方式放疗和化疗在食管局部癌的非手术治疗中:实践指南。Int J Radiat Oncol Biol Phys. 2003;55(4):930-42。17)Nishimura Y 等人:1999 年至 2003 年间食管癌放射治疗的临床实践和结果:日本放射肿瘤学研究组 (JROSG) 调查. Int J Clin Oncol. 2012; 17(1): 48-54。18)Umezawa R 等人:2000 年后单一机构 II-III 期胸食管癌放化疗的长期结果-重点比较三种方案。BMC Cancer. 2015; 15: 813。19)日本肿瘤学会主编:止吐药合理使用指南,2015 年 10 月,第 2 版。金原出版社,2015 年。20)日本医学肿瘤学会编:发热性中性粒细胞减少症 (FN) 临床实践指南。南光堂,2012。二十一)Ishikura S 等人:胸段食管鳞状细胞癌根治性放化疗后的长期毒性。J Clin Oncol. 2003;21(14):2697-702。二十二)Morota M, et al: 胸食管癌根治性同步放化疗后的晚期毒性. Int J Radiat Oncol Biol Phys. 2009; 75(1): 122-8。23)Asakura H, et al: Analysis of dose-volume histogram parameters for radio-volume histogram parameters forradiation pneumonitis after明确的同步放化疗食管癌. Radiother Oncol. 2010; 95(2): 240-4.24)Tachimori Y 等人:食管鳞状细胞癌大剂量放化疗后挽救性食管切除术. J Thorac Cardiovasc Surg. 2009; 137(1): 49-54。二十五)Swisher SG 等:根治性化疗和放疗后复发性肿瘤的抢救性食管切除术. J Thorac Cardiovasc Surg. 2002;123(1):175-83。26)Meunier B 等人:食管鳞状细胞癌根治性放化疗失败后挽救性食管切除术. Dig Surg. 1998; 15(3): 224-6。27)Nakamura T 等人:晚期食管癌根治性化疗和放疗后挽救性食管切除术。Am J Surg. 2004;188(3):261-6。28)Takeuchi H, et al: 影响放化疗后接受食管切除术的食管癌患者长期生存的因素. World J Surg. 2010; 34(2): 277-84.29)Yano T 等人:食管鳞状细胞癌根治性放化疗后局部失败患者的挽救性内镜黏膜切除术的长期结果。内窥镜检查。2008;40(9):717-21。30)Makazu M, et al: 内镜黏膜切除作为ⅠB、Ⅱ、Ⅲ期食管鳞状细胞癌根治性放化疗后局部失败患者的抢救治疗的可行性. Dis Esophagus. 2014; 27(1): 42-9.31)Hatogai K 等人:食管癌根治性放化疗后局部复发性病变的挽救性内镜治疗的局部疗效和生存结果. Radiat Oncol. 2016; 11(1): 31。
临床问题
转贴CQ7如果cStage I食管癌不进行手术,是否应该推荐化疗或放疗?
证据强度C。对于不适合内镜切除的 cStage I 食管癌患者,强烈建议在没有手术的情况下进行放化疗。(同意率84.2% [16/19])
评论
参考第三章食管癌治疗算法及基于算法的治疗策略2
.cStage 0, I CQ7
转贴CQ8对于cStage II和III食管癌,我们应该推荐基于手术的治疗还是根治性放化疗?
证据强度C。我们强烈建议对 cStage II 和 III 食管癌进行手术治疗。(同意率70% [14/20])
评论
参考第三章食管癌治疗算法及基于算法的治疗策略3
.cStage II, III CQ8
转贴CQ12对于 cStage II、III 和 IVa 食管癌,如果在根治性放化疗后获得完全缓解,是否应该推荐额外的化疗?
证据强度C。对于 cStage II、III 和 IVa 食管癌,如果在根治性放化疗后获得完全缓解,我们强烈建议额外化疗。(同意率90% [18/20])
评论
参考第三章食管癌治疗算法及基于算法的治疗策略3
.cStage II, III CQ12
转贴CQ13cStage IVa 食管癌是否应该推荐放化疗?
证据强度C。我们强烈建议对 cStage IVa 食管癌进行根治性放化疗。(同意率85% [17/20])
评论
参考第三章食管癌治疗算法及基于算法的治疗策略4
.c 第四阶段,CQ13
CQ30预处理可切除食管癌放化疗后残留或复发是否应推荐抢救性手术?
证据强度C。对于预处理可切除的食管癌放化疗后残留或复发,我们弱推荐挽救性手术。(同意率95% [19/20])
评论
根治性放化疗后持续性或复发性疾病的治疗选择有限。如果可切除,手术是唯一的治愈性治疗方法,但据报道围手术期死亡率很高,其有效性尚不确定。
作为对该 CQ 的文献搜索的结果,PubMed:189 篇文章,Cochrane:124 篇文章和 Ichushi:84 篇文章进行了初步筛选。二次筛选后,没有随机对照试验,对11个病例对照研究和4个病例系列进行了定性系统评价。
11项病例对照研究中,术前放化疗加手术8项,单纯手术1项,未对患者进行挽救性手术的2项研究。在这两种情况下,对该 CQ 的直接性都很低,并且进行抢救手术的预后改善效果尚不清楚。抢救手术组3年总生存率为17.0-50.6% 1-12),5年总生存率为25.4-50.6% 1-3 , 6-13)(表1)。另一方面,与术前放化疗+手术组相比,9项研究的住院死亡率为8.9%(49/550)。这高于术前放化疗+手术组(2,4,6-8,10,12-14)的住院死亡率6.3 % (64/1020 )(表2 )。

在亚组分析中,R0 切除和复发被报道为抢救手术的良好预后因素。15 篇文章中有 8 篇在亚组分析中显示了 R0 切除的优越性,但尚未建立对复发病例的评估。
综上所述,当预期R0切除时,抢救手术是一种可以在健康保险下进行的治疗,是治疗选择之一。但是,由于这是一种死亡率很高的治疗方法,因此在获得有关风险和长期结果的充分知情同意后,应在高度专业化的设施中进行操作,并且需要谨慎处理。考虑到利弊之间的平衡、证据的强度和患者的意愿,我们“对于预处理可切除的食管癌,如果在放化疗后观察到残留或复发,我们强烈建议进行挽救性手术。”和
参考
1)Wang S 等:食管鳞状细胞癌根治性放化疗后挽救性食管切除术的预后分析:淋巴结切除术的重要性。J Thorac Cardiovasc Surg. 2014;147(6):1805-11。2)Takeuchi H, et al: 影响放化疗后接受食管切除术的食管癌患者长期生存的因素. World J Surg. 2010; 34(2): 277-84.3)Tachimori Y 等人:食管鳞状细胞癌大剂量放化疗后挽救性食管切除术. J Thorac Cardiovasc Surg. 2009; 137(1): 49-54。四)Smithers BM 等人:根治性放化疗后挽救性食管切除术与术前新辅助放化疗后切除术相比的结果. Dis Esophagus. 2007; 20(6): 471-7。五)Nishimura M 等人:根治性放化疗后挽救性食管切除术。Gen Thorac Cardiovasc Surg. 2007;55(11):461-4,讨论 464-5。6)Nakamura T 等人:晚期食管癌根治性化疗和放疗后挽救性食管切除术。Am J Surg. 2004;188(3):261-6。7)Morita M, et al: 挽救性食管切除术对根治性放化疗后残余或复发癌症的临床意义. J Gastroenterol. 2011; 46(11): 1284-91。8)Marks JL 等人:食管腺癌根治性放化疗失败后挽救性食管切除术。Ann Thorac Surg. 2012;94(4):1126-1132,讨论 1132-23。9)D' Journo XB 等人:食管癌抢救手术的适应症和结果. Eur J Cardiothorac Surg. 2008; 33(6): 1117-23。十)Chao YK 等人:食管鳞状细胞癌放化疗失败后的抢救手术。Eur J Surg Oncol. 2009;35(3):289-94。11)Takemura M, et al: [确定性放化疗后挽救性胸腔镜食管切除术的临床结果和预后]. Gan to kagaku ryoho. 2015; 42(12): 1469-71.12)Markar S 等人:放化疗后的抢救手术治疗食管癌:这是一种可行的治疗选择吗?J Clin Oncol. 2015; 33(33): 3866-73。13)Miyata H 等人:胸食管癌根治性放化疗后挽救性食管切除术. J Surg Oncol. 2009; 100(6): 442-6。14)Tomimaru Y 等人:影响接受根治性放化疗后进行抢救手术的食管癌患者预后的因素。J Surg Oncol. 2006;93(5):422-8。
第九章 食管癌治疗后的随访
包起来
食管癌治疗后随访的目标是(1)早期发现和早期治疗复发,以及(2)早期发现和早期治疗多种癌症和多种癌症。此外,就治疗后的系统管理和对生活质量的理解而言,随访很重要。
食管癌治疗后的监测取决于初始治疗是什么以及初始治疗时癌症的进展程度。请记住,早期发现和早期治疗可以使长期生存,进行随访。重要的是要注意发生 有必要建立一个基于共识的跟踪系统并验证其有效性。
一般说明
1 内镜切除术后的随访
内镜切除术后一定的随访方法尚未确立。局部复发通常发生在初始治疗后1年内,但可能在 2 至 3 年后发生,需要长期随访1,2 )。碘染色食管内镜检查主要用于寻找局部复发,有很多报道称切除后1年每3或6个月进行一次1-5 )。碎片切除和多个未染色的碘区具有很高的局部复发风险,需要更严格的食管内镜检查1-4 , 6)。淋巴结复发和器官复发可在 2 至 3 年后发现,需要定期和长期随访7,8 ) 。
检查方法包括胸腹对比增强 CT 和 EUS,每 6 至 12 个月进行一次 9 )。作为随访方法的一个例子,JCOG0508研究“内镜黏膜切除术(EMR)联合放化疗治疗黏膜下浸润临床Ⅰ期(T1N0M0)食管癌Ⅱ期的疗效研究将包括每4个月检查一次,颈腹部CT检查。对比,并在 EMR 后 3 年测量肿瘤标志物 SCC。
2 根治术后的随访
在日本,29-43% 的病例发生根治性手术后复发,大约 85% 的复发病例发生在术后 2 年内,但复发可能更晚,需要谨慎10-12)。复发的类型包括淋巴结复发、局部复发、器官复发和播散性复发,但复杂复发也很常见12 )。
目前,食管癌根治性切除术后的实际随访方法由各机构确定,尚无明确定期随访有用性或有效随访方法的报道。根据本指南审查委员会进行的一项全国性调查13 ),以肿瘤标志物和CT为中心的影像诊断在切除后的前2年内每年至少进行4次,第3年后每年至少进行2次. 许多机构持续随访,包括长达 5 年的随访,但有些机构持续随访 10 年。实践中主要进行胸腹部增强CT和上消化道内镜检查,必要时进行颈/腹部US、骨显像、PET-CT。在许多设施中,CT 扫描的频率通常是每 3 到 6 个月一次,并且经常根据进展程度和手术后的年数而变化。
3 根治性放化疗后的随访
CT和食管内镜通常作为根治性放化疗后的随访方法,但没有报道证明频率和观察期的适当性。根据一项全国性调查 13 ),大多数病例在放化疗后的第一年每 3 个月进行一次随访,对于 cStage II 或更高的晚期癌症,相同的随访持续到 3 年。大多数病例。所有机构在治疗后至少随访 5 年。原发性食管病变和淋巴结复发常见于放化疗后,多发生在治疗开始后1~2年内。
食管癌根治性放化疗后,不仅要对复发进行随访,还要对放射治疗的晚期反应(如放射性肺炎、胸腔积液和心包积液)进行随访14 )。这些会严重损害患者的生活质量,甚至可能因迟发效应而导致死亡。
4 多发性食管癌和多器官癌的注意事项
食道癌是一种在食道中异时发生多种癌症的疾病。此外,其他器官的异时性癌症如胃癌和头颈癌的发生并不少见15 , 16)。考虑到这一点,应进行上消化道内窥镜检查,并定期仔细观察咽、整个食道(手术病例中的剩余食道)和胃。应特别注意多处碘未染色区和头颈部癌患者的头颈部异时性病变的发生16 , 17)。放大内窥镜结合窄带成像 (NBI) 可用于检测浅表头颈癌18)。此外,需要注意结直肠癌和其他癌症的发展。
参考
1)Katada C 等人:EMR 后食管鳞状细胞癌的局部复发。Gastrointest Endosc. 2005;61(2):219-25。2)Esaki M 等:内镜黏膜切除治疗后浅表性食管癌局部复发的危险因素。内窥镜检查。2007;39(1):41-5。3)Ishihara R, et al: EMR 和内镜黏膜下剥离术在日本早期食管癌整块切除中的比较. Gastrointest Endosc. 2008; 68(6): 1066-72。四)Takahashi H 等人:内镜黏膜下剥离术作为早期食管鳞状细胞癌的治愈性治疗优于传统内镜切除术(附视频)。Gastrointest Endosc. 2010; 72(2): 255-64, 264 e1-2 .五)Toyonaga T 等人:1,635 例食管、胃和结肠直肠内镜黏膜下剥离病例:并发症发生率和长期结果。Surg Endosc. 2013; 27(3): 1000-8。6)Urabe Y 等人:异时性多发性食管鳞状细胞癌和内窥镜黏膜切除术后 Lugol 排尿病变。内窥镜检查。2009;41(4):304-9。7)Katada C, et al: 内窥镜黏膜切除术后侵犯黏膜肌层的食管鳞状细胞癌的临床结果——一项多中心回顾性队列研究。内窥镜检查。2007;39(9):779-83。8)Ono S 等人:内镜黏膜下剥离术治疗浅表食管鳞状细胞肿瘤的长期结果. Gastrointest Endosc. 2009; 70(5): 860-6。9)Katada C 等人:食管鳞状细胞癌内镜黏膜切除或内镜黏膜下剥离后的监测。Dig Endosc. 2013;25 增刊 1:39-43。十)Toh Y, et al: 食管癌患者根治性食管切除术后的随访和复发:复发的首要指标及其预后价值. Esophagus. 2010; 7(1): 37-41.11)Kunisaki C 等:根治性食管切除术后肿瘤复发的食管癌患者的手术结果. J Gastrointest Surg. 2008;12(5):802-10。12)Sugiyama M 等人:食管癌完全切除后复发的模式和时间。Surg Today。2012;42(8):752-8。13)Toh Y 等人:一项全国范围内对日本食管癌患者根治性食管切除术或根治性放化疗完全缓解后随访策略的调查. Esophagus. 2016; 13(2): 173-81.14)Ishikura S, et al: Long-Term Toxicity After Definitive Chemoraradiotherapy for Squamous Cell Carcinoma of the Thoracic Esophagus. J Clin Oncol. 2003;21(14):2697-702。15)Chuang SC, et al: Risk of second original cancer in esophageal cancer patients: a pooled analysis of 13 cancer registries. Cancer Epidemiol Biomarkers Prev. 2008; 17(6): 1543-9。16)Morita M, et al: Surgical strategy for esophageal cancer associated with head and neck cancer. Surg Today. 2013; 44(9): 1603-10.17)Hori K, et al: Lugol-voiding 病变是食管癌或头颈癌患者第二次原发性鳞状细胞癌的重要危险因素。Am J Gastroenterol. 2011;106(5):858-66。18)Katada C 等人:用于检测食管鳞状细胞癌患者头颈部浅表鳞状细胞癌的窄带成像。内窥镜检查。2010;42(3):185-90。
临床问题
CQ31对于治疗完全治愈后的随访,应该推荐高频诊断成像、低频诊断成像还是无诊断成像的随访?
证据强度D.我们强烈建议进行随访,包括频繁的诊断成像,作为通过治疗实现完全恢复后的随访。(同意率85% [17/20])
评论
很少有比较研究检查对食管癌完全手术切除或根治性放化疗 (CRT) 取得完全反应的患者的随访方法。
作为该CQ的文献检索结果,PubMed:324篇,Cochrane:274篇,Ichushi:183篇。在初步和二次筛选后,对九项观察性研究进行了定性系统评价。唯一一份比较不同随访方式之间结果的报告来自加拿大。据他们说,复发或死亡的风险没有差异,这取决于是否伴随使用诊断成像作为完全切除后的随访。这是一项小样本的回顾性研究1 )。
有报道称切除术后包括影像学检查在内的频繁随访(术后早期每年约3~4次),面谈及验血值均未见异常,仅通过影像学检查发现,主要是CT检查. 2-4 ) . 大约 85% 的复发性食管癌病例在手术后 2 年内被诊断出来3-5)。另一方面,关于复发后治疗的效果,在术后单个淋巴结等有限区域复发的食管癌患者中,观察到以完全治愈为目标的手术、(化学)放射治疗等。进行根治性切除术是有用的(见CQ33)。根治性放化疗后,不仅对复发,而且对放射治疗的晚期影响,如放射性肺炎、胸腔积液和心包积液6)都必须进行随访。
基于上述背景,在日本,经常使用诊断成像进行随访观察,特别是在治疗后的早期阶段。根据本指南评审委员会开展的一项全国性调查7 ),以肿瘤标志物和CT为中心的影像诊断在切除后的前2年内每年至少进行4次,第3年后每年至少进行2次。 . 在许多情况下,大多数机构的随访,包括随访,持续到第 5 年(大约 70% 到第 7 年)。根治性放化疗后,通常以比切除后更短的间隔给予。另一方面,根据 NCCN(国家综合癌症网络)指南 8 ),在食管切除术或根治性放化疗后,“如果无症状,每 3 到 6 个月一次,持续 2 年,然后每 6 到 12 个月一次,持续 3 到 5 年。每年,此后每年进行一次面谈和体检,并在认为临床必要时增加血液生化检查、胃肠镜和活检以及影像学检查。”,未显示依据。在日本,由于可以在保险医疗的范围内进行,但其效果与总医疗费用增加之间的平衡9 ),以及辐射照射的问题,所以在日本的随访费用相对较低由于频繁的诊断成像等。还应注意,尚未充分考虑 然而,同样重要的是要注意,有报道称患者更喜欢通过诊断成像进行随访,即使已知这不会导致生存率提高10 )。
考虑到利弊之间的平衡、证据的程度和患者的意愿,建议是“如果通过治疗达到完全治愈,应进行随访,包括频繁的诊断成像。我们强烈建议
参考
1)Peixoto RD 等人:胃食管癌根治性治疗后的监测模式。Gastrointest Cancer.2014;45(3):325-33。2)Lou F 等人:食道癌复发模式和对监测的影响. J Thorac Oncol. 2013; 8(12): 1558-62。3)Toh Y 等人:食管癌患者根治性食管切除术后的随访和复发:复发的首要指标及其预后价值. Esophagus. 2010; 7(1): 37-43.四)Abate E 等人:腺癌食管切除术后复发:确定最佳随访间隔和测试。J Am Coll Surg. 2010;210(4):428-35。五)Sugiyama M 等人:食管癌完全切除后复发的模式和时间。Surg Today。2012;42(8):752-8。6)Ishikura S 等人:胸段食管鳞状细胞癌根治性放化疗后的长期毒性。J Clin Oncol. 2003;21(14):2697-02。7)Toh Y, et al:一项全国范围内对日本根治性食管切除术或根治性放化疗完全缓解后食管癌患者随访策略的调查. Esophagus. 2016; 13(2): 173-81.8)Ajani JA 等:食管和食管胃结合部癌,1.2015 版。J Natl Compr Cancer Netw. 2015;13(2):194-227。9)Polinder S 等人:食管癌手术后两种不同随访方案的成本比较研究。Eur J Cancer. 2009;45(12):2110-5。十)Blom RL 等人:患者在筛查潜在治愈性食管切除术后复发性疾病中的偏好。Dig Surg. 2012;29(3):206-12。
CQ32您是否建议对治疗治愈的患者定期检测肿瘤标志物(CEA、SCC 抗原等)?
证据强度D.对于已完全康复的患者,不建议定期检测肿瘤标志物(CEA、SCC 抗原等)。(同意率90% [18/20])
评论
在食管癌治疗后的随访中,除了影像学检查外,还经常测量肿瘤标志物。作为该CQ的文献检索结果,PubMed:178篇,Cochrane:102篇,Ichushi:131篇。针对未测量的肿瘤标志物的干预研究为0项,均为基于病例系列的观察性研究。在初步和二次筛选后,我们对 13 项观察性研究进行了定性系统评价。
目前食管癌保险承保的肿瘤标志物是CEA、SCC抗原和p53抗体。CYFRA21-1 是鳞状细胞癌的肿瘤标志物,但不在保险范围内。有报道称,肿瘤标志物的升高与复发相关,1,2 )并且在诊断成像之前2,3),但其中大多数是相对较旧的少数病例报告。随着诊断成像的最新进展,目前尚不清楚单独定期测量肿瘤标志物是否有助于早期检测。没有考虑成本方面的好处。据报道,2007 年被医疗保险覆盖的血清 p53 抗体即使在浅表性癌症中也具有较高的敏感性 4 ),但很少有报道证明其对治疗后复发监测的有用性。
根据本指南审查委员会进行的全国性调查 5 ),日本的大多数机构测量 CEA 和 SCC 抗原以诊断复发,通常从第 1 年到第 6 年每年两次。
综合考虑利弊平衡、证据水平、临床实际情况和成本,建议“对已完全治愈的患者定期监测肿瘤标志物(CEA、SCC抗原等)”。治疗。强烈建议进行准确的测量。
参考
1)Hidetoshi Makita 等人:食管鳞状细胞癌患者术后肿瘤标志物测量随时间推移的意义——来自复发病例的研究。日本胃肠外科学会杂志。2004;37(12):1805-12。2)Kawaguchi H 等人:食管鳞状细胞癌患者的 CYFRA 21-1 测定:检测复发的临床应用。癌症。2000;89(7):1413-7。3)Clark GW 等人:食管癌管理中的癌胚抗原测量:亚临床复发的指标。Am J Surg. 1995;170(6):597-600。四)Shimada H 等人:血清 p53 抗体是浅表食管鳞状细胞癌中有用的肿瘤标志物。Cancer. 2000;89(8):1677-83。五)Toh Y, et al:一项全国范围内对日本根治性食管切除术或根治性放化疗完全缓解后食管癌患者随访策略的调查. Esophagus. 2016; 13(2): 173-81.
第十章 复发性食管癌的治疗
包起来
由于食管癌的初始治疗是多种多样的,包括内镜治疗、根治性手术和根治性放化疗,因此需要根据初始治疗的类型分别考虑对复发性食管癌的治疗。此外,根据复发的类型是淋巴结复发、局部复发、远处器官复发还是合并复发,治疗方法也不同,复发时患者的一般情况也会影响治疗方法的选择。由于复发性食管癌的治疗难以进行大规模的临床试验,目前几乎没有证据表明其有用性。根据复发的类型,可能会获得治愈,例如根治性放化疗后的抢救手术,但治疗通常以抑制肿瘤进展或改善生活质量为目的。
一般说明
1 内镜下切除术后复发的治疗
内镜下黏膜切除术后局部复发常发生在初次治疗后1年内,但也可能发生在2~3年后。近年来,内镜下切除的适应症在临床研究中不断扩大1 )。内镜下切除后附加治疗的适应症和类型并不固定,有些病例仅用于随访观察2)。(第四章内镜治疗:见)
2 根治术后复发的治疗
在日本,食管癌根治性手术后的复发率为 28-47% 1-4 ) ,在欧洲和美国的报道中, 50 % 或更高的复发率并不少见5,6 )。22-68%发生淋巴结/局部复发,12-51%发生远处器官转移,7-27%发生两者合并复发。颈部和上纵隔的复发在淋巴结复发中最常见,肺、肝、骨和脑在远处器官复发中最常见,依次排列。小肠和结肠也有转移1、2 ) 。
食管癌根治性切除术后复发患者的生存率极低,从确诊复发的中位生存期为5~10个月。另一方面,由于已经报道了一些长期存活或完全康复的病例,因此也可以考虑对复发性病变进行积极治疗1-16)。
食管癌根治性切除术后复发的治疗应根据复发的部位、类型和程度进行选择。治疗方法因复发时的一般情况、复发是否在手术的操作范围内以及是否进行术前或术后照射而有所不同。因此,对大量各种病理状况的患者进行治疗的结果报道很少。
3 根治性放化疗完全缓解复发的治疗
近年来,不仅对于不可切除的食管癌,而且对于判断为可切除的食管癌,选择根治性放化疗作为初始治疗的机会越来越多。已经获得了许多完全缓解的病例,但也有许多复发病例,包括局部复发。复发的治疗因病理和全身情况而异,尚无共识,但如果复发是局部的,可进行手术或内镜下切除等抢救性治疗8,17 . 。(第八章多学科治疗2.CQ30放化疗及抢救手术)。
参考
1)Fuji Y., et al.: [晚期食管癌的治疗:旨在提高证据水平和治疗结果] 根治性切除术后的复发治疗和随访方法。消化手术。2008;31(11):1653-62。2)Kuwano H., et al.: [胃肠癌的术后随访和监测] 食管癌。消化手术。2009;32(6):1017-27。3)Toh Y 等人:食管癌患者根治性食管切除术后的随访和复发:复发的首要指标及其预后价值. Esophagus. 2010; 7(1): 37-43.四)Miyata H 等人:食管鳞状细胞癌根治性切除术后复发患者的生存因素。Ann Surg Oncol. 2011;18(12):3353-61。五)Kato H, et al: 根治性食管切除术后复发性食管癌的分类和二或三野淋巴结切除术. Anticancer Res. 2005; 25(5): 3461-8。6)Abate E 等人:腺癌食管切除术后复发:确定最佳随访间隔和测试。J Am Coll Surg. 2010;210(4):428-35。7)Jingu K, et al: 放射治疗联合奈达铂(顺-二氨-糖铂)和 5-氟尿嘧啶治疗术后局部复发性食管癌的结果. BMC Cancer. 2006; 6: 50.8)Watanabe M 等人:食管鳞状细胞癌食管切除术或根治性放化疗后淋巴结复发的淋巴结切除术结果。Gen Thorac Cardiovasc Surg. 2014;62(11): 685-92。9)Watanabe M, et al: 胸段食管鳞状细胞癌食管切除术后颈部淋巴结复发的挽救性淋巴结切除术. Dis Esophagus. 2012; 25(1): 62-6.十)Nakamura T 等:根治性切除后食管癌淋巴结复发的多模式治疗。Ann Surg Oncol. 2008;15(9):2451-7。11)Tsuchida E, et al: 使用低剂量连续输注 5-氟尿嘧啶的同步放化疗治疗食管鳞状细胞癌术后区域淋巴结复发. Esophagus. 2005; 2(1): 25-31.12)Zhu YL, et al: A retrospective evaluation of radiotherapy for treatment of local esophageal squamous cell Cancer Rejection after Initial Complete Surgery. J Investig Med. 2013; 61(1): 34-9.13)Baxi SH 等人:初次手术后局部复发性食管癌的挽救性放化疗:回顾性综述. J Med Imaging Radiat Oncol. 2008; 52(6): 583-7。14)Shioyama Y 等人:手术后复发性食管癌的放射治疗:临床结果和预后因素. Jpn J Clin Oncol. 2007;37(12):918-23。15)Yamashita H 等人:食管癌术后局部复发的抢救放疗。Dis Esophagus. 2005;18(4):215-20。16)Ichida H 等人:食管癌肝和/或肺转移的术后复发模式和肝和/或肺切除术. World J Surg. 2013; 37(2): 398-407。17)Wang S 等:食管鳞状细胞癌根治性放化疗后挽救性食管切除术的预后分析:淋巴结切除术的重要性。J Thorac Cardiovasc Surg. 2014;147(6):1805-11。18)Chen Y, et al: 根治性放化疗或单独放疗后复发性食管鳞状细胞癌的挽救性放化疗与挽救性手术的比较. Dis Esophagus. 2014; 27(2): 134-40.19)Tachimori Y 等人:食管鳞状细胞癌大剂量放化疗后挽救性食管切除术. J Thorac Cardiovasc Surg. 2009; 137(1): 49-54。20)Takeuchi M 等人:在食管鳞状细胞癌放化疗后局部失败的患者中挽救内镜黏膜下剥离术。Scand J Gastroenterol. 2013;48(9):1095-101。二十一)Makazu M 等人:内镜黏膜切除术作为 IB、II 和 III 期食管鳞状细胞癌根治性放化疗后局部失败患者的抢救治疗的可行性。Dis Esophagus. 2014;27(1):42-9。二十二)Yano T 等人:食管鳞状细胞癌根治性放化疗后局部失败患者的挽救性内镜黏膜切除术的长期结果。内窥镜检查。2008;40(9):717-21。23)Matono S 等人:不进行食管切除术的挽救性淋巴结切除术是食管癌根治性放化疗后复发或残留淋巴结的一种选择。食管。2014;11(3):197-203。
临床问题
CQ33如果根治性切除后局部区域复发,是否推荐针对根治性的积极治疗?
证据强度D.如果根治性切除后出现局部复发,我们弱推荐根治性手术和(化学)放射治疗。(同意率70% [14/20])
评论
作为该CQ的文献检索结果,PubMed:70篇,Cochrane:177篇,Ichushi:24篇。经过初步和二次筛选后,对 12 项观察性研究进行了定性系统评价。
当根治性手术后局部区域出现复发或复发时,可采用手术或(化学)放射治疗作为根治性治疗。几项研究已经证明手术对局部淋巴结复发(例如颈部淋巴结)的有用性,1-4),但都是回顾性观察研究。有较多的报道证明(放)放疗对根治术后局部复发的有效性5-10),是临床上广泛使用的治疗方法。目前,尚未进行前瞻性评价。比较研究的方法。器官复发的切除仅在少数病例中进行了调查,11,12 )并且其有用性尚不清楚。
尚不清楚什么样的复发情况可以预期完全治愈,也无法明确回答以根治为目标的积极治疗的利弊,包括成本问题。然而,在实际临床实践中,患者(家属)对积极治疗的愿望被认为相对较高。应充分告知患者预后和不良事件,并根据患者意愿确定适应症。
综合考虑利弊平衡、取证程度、费用问题以及临床实际情况,建议为“如果根治性切除后局部出现复发,则以根治为目的的手术,”弱推荐放疗。”
参考
1)Watanabe M 等人:食管鳞状细胞癌食管切除术或根治性放化疗后淋巴结复发的淋巴结切除术结果。Gen Thorac Cardiovasc Surg. 2014;62(11): 685-92。2)Watanabe M, et al: 胸段食管鳞状细胞癌食管切除术后颈部淋巴结复发的挽救性淋巴结切除术. Dis Esophagus. 2012; 25(1): 62-6.3)Nakamura T 等:根治性切除后食管癌淋巴结复发的多模式治疗。Ann Surg Oncol. 2008;15(9):2451-7。四)Ma X, et al: 挽救性淋巴结切除术与挽救性放疗/放化疗治疗食管鳞状细胞癌根治性切除后颈部淋巴结复发的比较. Ann Surg Oncol. 2015; 22(2): 624-9.五)Tsuchida E, et al: 使用低剂量连续输注 5-氟尿嘧啶的同步放化疗治疗食管鳞状细胞癌术后区域淋巴结复发. Esophagus. 2005; 2(1): 25-31.6)Zhu YL, et al: A retrospective evaluation of radiotherapy for treatment of local esophageal squamous cell Cancer Rejection after Initial Complete Surgery. J Investig Med. 2013; 61(1): 34-9.7)Baxi SH 等人:初次手术后局部复发性食管癌的挽救性放化疗:回顾性综述. J Med Imaging Radiat Oncol. 2008; 52(6): 583-7。8)Shioyama Y 等人:手术后复发性食管癌的放射治疗:临床结果和预后因素. Jpn J Clin Oncol. 2007;37(12):918-23。9)Jingu K, et al: 放射治疗联合奈达铂(顺-二氨-糖铂)和 5-氟尿嘧啶治疗术后局部复发性食管癌的结果. BMC Cancer. 2006; 6: 50.十)Yamashita H 等人:食管癌术后局部复发的抢救放疗。Dis Esophagus. 2005;18(4):215-20。11)Ichida H 等人:食管癌肝和/或肺转移的术后复发模式和肝和/或肺切除术. World J Surg. 2013; 37(2): 398-407。12)Hiyoshi Y, et al: 手术切除对食管癌根治术后复发的临床意义. Ann Surg Oncol. 2015; 22(1): 240-6.
第十一章 姑息医学
包起来
姑息治疗是所有癌症领域都应进行的医学治疗,应考虑维持和改善生活质量的治疗方法。但是,如何做到这一点的决定取决于各个机构,是一个需要进一步评估的领域。所有医务人员必须掌握姑息治疗相关的知识和技能。
一般说明
根据世界卫生组织(2002 年)的说法,姑息治疗是“对面临与危及生命的疾病相关问题的患者和家庭的疼痛以及身体、心理社会和精神问题的早期和准确评估和解决。它是一种预防和减轻疼痛的方法并提高生活质量 (QOL)。” 2014 年,第 2 次防癌推进基本计划将“从癌症确诊时推进姑息治疗”确定为优先课题1 )。以上是所有癌症患者共同的,作为日常医疗的一部分进行。・社会工作者和物理治疗师需要提供团队医疗服务。对于癌痛,推荐基于日本姑息医学会“癌痛药物治疗指南”的方法2)。
食管癌从诊断时起,常因食管狭窄引起吞咽困难和营养不良、误吸和瘘管引起的咳嗽、肿瘤引起的胸痛等,导致生活质量下降。即使在以治愈为目标的治疗的情况下,重要的是结合治疗以从早期缓解症状并维持/改善 QOL3,4 )。
在晚期食管癌患者的姑息治疗中,食管狭窄导致的吞咽困难和营养不良、气道狭窄或气道瘘引起的症状、远处转移引起的恶病质、高钙血症等症状尤其成问题。其中,放疗、放化疗、食管支架置入、气管支架置入、食管绕道手术等姑息治疗有时用于改善食管狭窄症状、气道狭窄症状、瘘管引起的症状5. , 6 ) 。(第七章放射治疗,第八章多学科治疗2.放化疗:见)
关于旨在改善不可切除食管癌吞咽困难的治疗方法,2014 年 Cochrane 数据库系统评价发现,自膨式食管金属支架比塑料支架和其他方法更有效、更直接。7)。然而,有必要记住,支架插入可能会导致并发症、降低生活质量和插入后疼痛。除食管支架置入外,据报道,腔内照射、激光照射、热疗和乙醇注射可作为食管梗阻的治疗方法。腔内照射虽然在即刻解除梗阻方面不如食管支架有效,但并发症发生率低,维持梗阻效果好,有望延长生存期,改善生活质量。支架插入7) . 然而,日本很少单独进行腔内放射治疗(参见第 VII 章放射治疗)。
食管气道瘘患者由于反复误吸和肺炎而导致生活质量下降,但有报道显示自膨式食管覆膜支架置入以及在某些情况下使用气管支架进行双支架置入的疗效8。)。
对于在根治性放化疗或放疗后无法进行根治性手术的严重狭窄患者,如果判断食管支架置入困难或危险,则构建营养瘘管以过渡到家庭治疗。可使用普通内窥镜进行的经皮内窥镜胃造口术是有效的,可在严重狭窄患者的多模式治疗之前进行 9 )。对于即使使用小直径内窥镜也难以通过的严重狭窄患者,或者对于有腹部手术史而难以经皮内窥镜胃造口术的患者,可在开腹手术下进行胃造口术或空肠造口术。
此外,气道阻塞引起的呼吸骤停和主动脉穿孔引起的大量呕血等致命情况也是参与食管癌治疗的医务人员经常遇到的事件。在大多数情况下,挽救生命是困难的,事先向家人作出充分的解释很重要。患者及其家属被迫生活在对猝死的恐惧中,不能忽视对双方的心理支持和精神关怀。
参考
1)厚生劳动省:促进癌症控制的基本计划。http://www.mhlw.go.jp/bunya/kenkou/gan_keikaku.html2)日本姑息医学会癌症疼痛治疗指南委员会编:癌症疼痛药物治疗指南 2014 年版。金原出版社,2014。3)Freeman RK 等人:不可切除食管癌患者的姑息治疗。Surg Clin North Am. 2012;92(5):1337-51。四)Fuji,Yasushi:姑息治疗和姑息医学。由 Hiroyuki Kuwano 编辑,食管外科最新专家。pp289-98,中外医疗,2010。五)Schweigert M 等人:食道癌——概述。Nat Rev Gastroenterol Hepatol.2013;10(4):230-44。6)Amdal CD 等人:评估食管癌患者姑息性放疗和化疗的患者报告结果:系统评价. Acta Oncol. 2013; 52(4): 679-90。7)Dai Y 等:食管癌吞咽困难的干预措施. Cochrane Database Syst Rev. 2014;30(10):CD005048。8)Hürtgen M 等人:恶性气管食管瘘的治疗。Thorac Surg Clin. 2014;24(1):117-27。9)Margolis M 等人:食管癌患者多模式治疗前经皮内窥镜胃造口术. Ann Thorac Surg. 2003;76(5):1694-7。
临床问题
CQ34–1是否应在食管癌姑息性放射治疗前推荐放置食管支架?
证据强度C。对于不适合根治性治疗的食管癌,我们强烈建议在姑息性放疗之前放置食管支架。(同意率80% [16/20])
CQ34–2对于可能治愈的食管癌,是否建议在根治性(化学)放疗前放置食管支架?
证据强度D.对于可能治愈的食管癌,强烈建议不要在确定性(化学)放射治疗之前放置食管支架。(同意率80% [16/20])
评论
作为该CQ的文献检索结果,PubMed:182篇,Cochrane:117篇,Ichushi:87篇。在初步和二次筛选后,我们对两项随机对照试验和四项观察性研究进行了定性系统评价。
近年来,两项随机对照试验1、2)显示了食管支架置入后放疗通过支架置入改善早期吞咽困难和维持放疗效果的疗效。支架置入后接受放射治疗(第1组)是放射支架,目前在日本无法使用)。与唯一组相比,吞咽困难得到改善,生存期延长,并发症没有增加已显示。观察性研究3-5)表明吞咽困难的改善和生存率的延长是可以预期的,而其他研究显示没有差异,但在所有研究中,支架置入后放疗会增加不良事件。据报道,不会。然而,这些报告中的辐射剂量为 30 Gy2 )、40 Gy 或更多4 )诸如此类的因素有很多,在解释结果时需要谨慎。此外,食管气管(支气管)瘘可纳入靶点,也可不纳入靶点,瘘管患者支架置入后放疗的疗效和安全性未知。应该注意的是,这些研究的许多受试者被认为是姑息治疗的受试者,没有明确的治疗指征,并且没有确定治疗的可能性。此外,在日本,用于恶性食管狭窄的食管支架可以在保险医疗范围内进行。部门负责人发布了“修订胃肠支架使用注意事项”的通知6 ),以及警告栏包括食管、胃十二指肠和结肠支架在内的胃肠道支架的说明书增加了以下内容: 还需要注意增加的声明,“小心判断有明显癌症侵袭的患者放置支架的适应症,因为有报道称安置地点有穿孔。” 对于无法治愈的食管癌导致的食管狭窄,应在向希望早期改善经口摄入的患者充分说明风险后进行支架置入。
考虑到利弊之间的平衡、证据的程度和患者的意愿,CQ34-1的建议是“食管癌姑息性放疗前放置食管支架,不适合根治性治疗。我强烈建议这样做。”
另一方面,日本食管疾病学会(Japan Esophageal Society)2003 年报告的一项问卷调查显示,患有食管狭窄或瘘管但仍有根治可能的晚期食管癌(多为 cStage II 或 III)患者然而,在放疗前和放疗期间放置支架时,经常观察到致命的不良事件,如瘘管形成和伴随的胃肠道出血7 )。可缓解,改善预后,应避免早期置入支架。” 此后,日本没有报道否认这一事实的研究结果,认为也应采用该指南。患者可能希望在早期阶段改善吞咽困难,但最好在充分解释后推荐明确的治疗。但近年来欧美尝试对可切除的局部晚期食管癌伴食管狭窄进行术前放化疗,主要是通过放置塑料支架来改善营养。推荐,因为它的安全性和安全性尚未明确,并且在某些情况下不良事件使根治性食管切除术变得不可能8 ),因此目前在日本未使用。
上述情况表明,在日本,在仍有可能进行根治性治疗的情况下,弊大于利。我们强烈建议不要在靶向(化学)放射之前放置食管支架。”
参考
1)Zhu HD 等人:传统支架与装载 (125) 碘种子的支架治疗不可切除的食管癌:一项多中心、随机 3 期试验。Lancet Oncol. 2014;15(6):612-9。2)Javed A 等人:姑息性支架联合或不联合放疗治疗无法手术的食管癌:一项随机试验。J Gastrointest Cancer. 2012;43(1):63-9。3)Liu N, et al: 放射性自膨式支架对不可切除的食道癌患者有很好的缓解作用,但如果他们之前接受过放射治疗,则应谨慎使用。Ann Thorac Surg. 2014; 98(2): 521-6。四)姜学军, 等: 晚期食管癌的内镜支架置入和同步放化疗: 病例对照研究. World J Gastroenterol. 2012; 18(12): 1404-9.五)Rueth NM 等人:食管支架置入术和放射治疗:缓解症状性恶性吞咽困难的多模式方法。Ann Surg Oncol. 2012;19(13):4223-8。6)2012 年 11 月 7 日 PFSB 通知第 1107-1 号和 PFSB 通知第 1107-1 号,由厚生劳动省药品和食品安全局安全处长和医疗器械评估处长共同签署办公室,评估部门相关使用说明的修订”
https://www.pmda.go.jp/files/000148167.pdf7)Nishimura Y 等人:食管支架插管后放疗治疗晚期食管癌的严重并发症:日本食管疾病学会的问卷调查。Int J Radiat Oncol Biol Phys. 2003;56(5):1327-32。8)Jones CM 等人:是否应在新辅助治疗前使用食管支架来治疗等待食管切除术患者的吞咽困难?最佳证据主题 (BET)。Int J Surg. 2014;12(11):1172-80。
CQ35放疗或放化疗后仍有严重狭窄且无法根治性切除时,是否建议放置食管支架?
证据强度D.对于放疗/放化疗后残留严重狭窄且无法根治性切除的患者,是否使用食管支架取决于证据的强度、患者对经口摄入的渴望强度以及支架的存在。由于放置引起并发症的风险,目前无法确定推荐的水平。如果有强烈的经口摄入欲望,要置入食管支架,需要对并发症进行充分说明。(同意率50% [10/20])
评论
作为该CQ的文献检索结果,PubMed:182篇,Cochrane:117篇,Ichushi:87篇。在初步和二次筛选后,我们对一项荟萃分析和三项观察性研究进行了定性系统评价。
当放疗或放化疗后残留狭窄严重且无法根治性切除的患者置入食管支架时,会出现吸入性肺炎、食管气道瘘1 )和致命性出血) 然而,2010 年报告的一项荟萃分析中的亚组分析发现,既往放化疗不影响支架置入的发病率、置入程序导致的死亡或缩短的总生存期。3 )。然而,该荟萃分析基于一项比较自扩张支架置入与其他治疗效果的随机对照试验,并未比较放疗后置入支架的利弊。另一方面,在日本,食管狭窄的食管支架置入可以在保险医疗的范围内进行。 发布4),以及警告栏胃肠道支架(包括食管、胃十二指肠和结肠支架)的说明书增加了以下内容:支架置入前接受过放化疗的患者,以及(2)有明显癌症侵袭的患者置入支架,应慎重确定适应症,因为有报道称放置地点有穿孔。”已添加说明。
基于利弊平衡、证据水平以及已完成化疗或放化疗但不能完全治愈的患者口服摄入的意愿强度,指南审查委员会的共识建立会议进行了讨论。结果,意见分别在 50% 和 50% 之间分裂,他们说他们“弱建议做”和“弱建议不做”。因此,目前无法确定此 CQ 的推荐级别。
在这种情况下,如果患者有强烈的经口摄食愿望,应充分说明置入食管支架可能导致严重并发症,并充分考虑每个病例的利弊平衡。
参考
1)Lecleire S 等人:在食道癌患者中姑息性插入金属支架后,既往放化疗与更高的危及生命的并发症发生率相关。Aliment Pharmacol Ther. 2006;23(12):1693-702。2)Qiu G, et al: 既往放疗对食管癌恶性吞咽困难自膨式金属支架 (SEMS) 后致命并发症的影响. Dis Esophagus. 2013; 26(2): 175-81.3)Sgourakis G 等人:自膨胀支架在食管和胃食管交界处癌症姑息治疗中的应用:结果的荟萃分析和荟萃回归分析。Dig Dis Sci. 2010;55(11):3018-30。四)2012 年 11 月 7 日 PFSB 通知第 1107-1 号和 PFSB 通知第 1107-1 号,由厚生劳动省药品和食品安全局安全处长和医疗器械评估处长共同签署办公室,评估部门相关使用说明的修订”
https://www.pmda.go.jp/files/000148167.pdf
第十二章 Barrett 食管和 Barrett 癌的治疗
包起来
具有巴雷特黏膜的食管称为巴雷特食管1 , 2)。Barrett's 黏膜是一种从胃连续延伸到食道的柱状上皮,可以通过内窥镜检查确认,不需要特殊柱状上皮化生的组织学确认1,3-8 )。Barrett 黏膜的诊断需要识别食管胃交界处。组织学上,Barrett 黏膜具有双重结构,包括 (1) 柱状上皮下方黏膜层中的食管腺管或黏膜下层中的适当食管腺,(2) 柱状上皮中的鳞状上皮岛,以及 (3) 下方黏膜肌层柱状上皮。观察到这些发现中的任何一个1 )。巴雷特氏癌被定义为在巴雷特氏黏膜中产生的腺癌1 )。早期癌、浅表癌和晚期癌的定义与食管癌相同,但将深层黏膜肌层视为原始黏膜肌层1 )。巴雷特氏癌的治疗是根据食管鳞状细胞癌在其占据的部位进行的1 )。目前,内镜下切除适用于局限于固有层的壁侵犯(EP [保留在上皮内(非侵入性病变)]、SMM [仅限于浅表黏膜肌层]和 LPM [未到达深层黏膜肌层]),但积累病例是必要的。
参考
1)日本食管学会编:食管癌治疗的临床和病理规则,第 11 版。金原出版社,2015 年。2)Naef AP 等:柱状下食管:具有恶性倾向的获得性病变。报告 140 例 Barrett 食管伴 12 例腺癌。J Thorac Cardiovasc Surg. 1975;70(5):826-35。3)Armstrong D:评论文章:Barrett 食管和柱状化生内镜诊断的一致性。Aliment Pharmacol Ther. 2004;20 Suppl 5:40-7,讨论 61-2。四)Sharma P 等人:巴雷特食管内窥镜分级系统的开发和验证:布拉格 C & M 标准。胃肠病学。2006;131(5):1392-9。五)Spechler SJ 等人:Barrett 食管的历史、分子机制和内窥镜治疗。胃肠病学。2010;138(3):854-69。6)Takubo K, et al: 不同国家食管胃疾病定义的差异:食管胃交界处的内镜定义、巴雷特腺癌的前兆、巴雷特食管的定义、黏膜腺癌或重度不典型增生的组织学标准消化. 2009; 80(4): 248-57。7)Riddell RH 等人:Barrett 食管的定义:重新思考的时间——肠化生是否已死亡?Am J Gastroenterol. 2009; 104(10): 2588-94。8)日本胃肠病学会编:胃食管反流病 (GERD) 临床实践指南修订版第 2 版。南科多,2015。
临床问题
CQ36–1您是否建议筛查 Barrett 食管?
证据强度D.不推荐筛查 Barrett 食管。(同意率95% [19/20])
CQ36–2您是否建议对 Barrett 食管进行监测?
证据强度D.不建议对 Barrett 食管进行监测。(同意率80%[16/20],第二次投票决定[第一次60%[12/20],第二次80%[16/20]])
评论
一般来说,拾取巴雷特食管称为筛查,监测称为对检测到的巴雷特食管的随访。
作为该CQ的文献检索结果,PubMed:276篇,Cochrane:152篇,Ichushi:168篇。其中,28篇文章多次检索重复,包括7篇附加文章在内的575篇文章被纳入初筛。二次筛选后,共纳入64项研究(7项荟萃分析、18项随机对照试验、4项队列研究、13项病例对照研究、12项横断面研究、1项回顾性观察研究)。对研究进行定性系统评价、6 篇评论、2 篇指南和 1 篇研究设计报告。
对以下项目进行了系统评价:(1)筛查对象,(2)筛查方法,(3)监测的必要性,(4)监测对象,(5)监测方法,以及(6) ) 监视间隔。
其中,只有 5 项随机对照试验1-5)共聚焦激光内窥镜在 (5) 监测方法中具有明显优势的证据。当激光共聚焦内镜与正常观察结合使用时,可以获得额外的效果1 ),并且在一项比较靶向活检与共聚焦激光和随机活检的研究中,发现病变检测的准确性高于随机活检。4 , 5 ) . 证据级别很高,但可用的设施有限。
目前,一项随机对照试验(BOSS)主要在英国进行,以客观评估监测的意义并确定合适的监测方法,但结果要等到2023年。此外,其中许多不适合日本的实际情况,很有可能很难根据该系统评价提出建议。
由于难以对(1)中的筛查对象进行随机对照试验,西方指南根据巴雷特食管的危险因素确定筛查对象。巴雷特食管和巴雷特腺癌的危险因素包括胃食管反流病、中心性肥胖、白种人和男性、家族史和吸烟,但酒精不是。美国胃肠病学会 (ACG) 最近发布的指南建议患有慢性反流症状(如胃灼热或胃酸反流)超过 5 年或每周超过一次,或年龄超过 50 岁、白种人和筛查的男性有性肥胖、吸烟史、有巴雷特食管或食管腺癌家族史,并有上述两种或两种以上危险因素的患者应考虑。其他共识报告 (BOB CAT) 和英国指南报告了类似的发现,但巴雷特食管的长度被列为另一个风险因素。
关于巴雷特食管在日本的筛查,GERD指南(日本胃肠病)建议对有症状的患者,特别是有持续性胃食管反流症状的患者进行上消化道内镜检查,以排除器质性疾病。学会)。另一方面,在无症状或持续症状的患者中,作为胃癌筛查的一部分进行的上消化道内窥镜检查往往是发现巴雷特食管的诱因,目前的情况是进行管内镜检查时发现巴雷特食管。在日本,与欧美相比,短段巴雷特食管(SSBE)很常见,长段巴雷特食管(LSBE)非常罕见。目前不能强烈推荐用于检测 Barrett 食管的上消化道内窥镜检查,因为尚不清楚筛查是否能降低死亡率并且具有成本效益。
尽管在 (3) 中没有足够的证据表明需要监测,但西方指南推荐监测,因为它可以早期发现 Barrett 食管癌6-10) 。对于 (4) 中需要监测的受试者,SSBE 中发育异常和 Barrett 食管癌的发生率明显低于LSBE11 ) ,但在 SSBE12 )中也可能检测到 Barrett 食管癌,仅LSBE 不足以治疗发育不良。不仅应该对 SSBE 进行监测,还应该对 SSBE 进行监测。欧美指南根据有无发育异常来评估风险,但证据不足。至于(5)监测方法,根据西雅图协议的随机活检是欧洲和美国的标准做法。此外,在一项关于 Barrett 食管癌定位的研究中,发现 Barrett 食管口腔侧的癌症多于肛门侧,这表明增加口腔侧活检的数量可以提高诊断准确性。在日本,色素内窥镜和影像增强内窥镜比欧洲和美国更受欢迎,并且有许多报道证明了它们的用处。关于(6)中的监视间隔,监视间隔根据发育异常的有无而改变。美国 ACG 指南建议内镜检查,包括活检,如果不存在发育异常,每 3 至 5 年一次,如果怀疑发育异常,则每年一次。
据报道,SSBE 的致癌率为 0.19%/年,而在欧洲和美国,LSBE 的致癌率为 0.33-0.63%/年。日本巴雷特腺癌的发病率尚未阐明,但由于LSBE的发病率较低,推测其低于欧美。在日本,有时会诊断出很短的巴雷特食管,并且需要监测的病例数量很多。Barrett's 腺癌也是从 SSBE 发展而来的,因此对 Barrett's 食管进行监测并在早期发现 Barrett's 食管癌非常重要。然而,关于日本巴雷特食管监测的死亡率降低或成本效益的证据很少,现阶段不能强烈推荐监测。此外,关于适当的监测方法,日本进行的靶向活检或欧美推荐的随机活检是否更有效,目前还没有调查。因此,目前不能推荐任何监测协议。
好处是能够在筛查期间发现 Barrett 食管,并在监测期间对 Barrett 食管癌进行早期诊断。危害是内窥镜检查的常见并发症和手术费用。虽然有症状的患者可以在保险范围内治疗,但无症状患者不能在保险范围内。患者可能更喜欢巴雷特食管癌的早期诊断,但预计这种诊断并不常见且相对具有成本效益。
考虑到利弊、证据水平和患者偏好之间的平衡,建议是“弱推荐筛查巴雷特食管”和“弱推荐监测巴雷特食管”。
参考
1)Sharma P 等人:使用基于探针的共聚焦激光内窥镜检查实时增加 Barrett 食管中肿瘤组织的检测:国际多中心、前瞻性、随机、对照试验的最终结果. Gastrointest Endosc. 2011; 74(3): 465 -72。2)Bajbouj M 等人:基于探针的共聚焦激光显微内镜检查与标准四象限活检在巴雷特食管瘤形成评估中的比较。内窥镜检查。2010;42(6):435-40。3)Wallace MB 等人:多中心、随机、对照试验共聚焦激光显微内镜评估巴雷特食管黏膜消融或切除 GI 瘤形成后残留化生。Gastrointest Endosc. 2012;76(3):539-47 e1。四)Dunbar KB 等人:Barrett 食管和内窥镜下不明显的 Barrett 瘤形成中的共聚焦激光内窥镜检查:一项前瞻性、随机、双盲、对照、交叉试验. Gastrointest Endosc. 2009; 70(4): 645-54。五)Canto MI, et al: In vivo endomicroscopy Improvement detection of Barrett's esophagus-related neoplasia: a multicenter international randomised controlled trial (with video). Gastrointest Endosc. 2014; 79(2): 211-21.6)Corley DA 等人:巴雷特腺癌的监测和生存:基于人群的研究。胃肠病学。2002;122(3):633-40。7)van Sandick JW 等人:Barrett 食管内镜活检监测对 Barrett 癌的病理分期和临床结果的影响。Gut. 1998;43(2):216-22。8)Fountoulakis A 等人:Barrett 食管监测对食管癌临床结果的影响.Br J Surg. 2004;91(8):997-1003。9)Bright T 等人:Barrett 食管内窥镜检查的结果。ANZ J Surg. 2009;79(11):812-6。十)Wong T 等人:Barrett 的监测确定患有早期食管腺癌的患者。Am J Med. 2010;123(5):462-7。11)Weston AP 等:短段 Barrett 食管的前瞻性长期内镜和组织学随访:与传统长段 Barrett 食管的比较。Am J Gastroenterol. 1997;92(3):407-13。12)Sharma P 等人:短段 Barrett 食管发育不良:前瞻性 3 年随访。Am J Gastroenterol. 1997;92(11):2012-6。
CQ37您是否建议对 Barrett 食管进行内镜治疗?
证据强度B.(1)对于Barrett食管伴黏膜内腺癌,我们强烈建议内镜治疗仅限于黏膜内腺癌。(同意率100% [20/20])证据强度B.(2) 强烈建议不要对巴雷特食管本身进行内镜治疗,以防癌变。(同意率80% [16/20])
评论
作为对该 CQ 的文献检索的结果,PubMed:157 篇文章,Cochrane:64 篇文章,Ichushi:157 篇文章和 10 篇来自其他人的文章进行了初步筛选。二次筛选后,我们对 2 项荟萃分析、11 项随机对照试验、1 项前瞻性观察研究和 2 项回顾性观察研究进行了定性系统评价。
据报道,氩等离子体凝固 (APC) 1)、光动力疗法 (PDT) 2)和射频消融(射频消融,RFA)是有用的。在一项比较 PDT 和 APC3-5 )的研究的荟萃分析6) 中,据报道,PDT 与 APC 一样,可用于 Barrett 食管的消失或缩短,但其不良事件发生率显着更高,例如光敏性。是 关于RFA,在欧洲和美国,市场上有可以进行圆周烧灼的设备,并且已经进行了许多研究。据报道,RFA 可以高速率消除肠化生并7)抑制致癌作用)。
APC、PDT 和 RFA 也被报道用于确定 Barrett 食管的内镜治疗是否可以抑制 Barrett 食管的发展。巴雷特食管重度不典型增生(HGD)或巴雷特食管癌内镜治疗后,余下巴雷特食管行APC并随访,组间比较,无复发期明显延长经历了APC9 )。然而,本研究的病例数较少,而在一个病例数较多的研究中,有报道称APC虽然缩短了Barrett食管,但无法抑制HGD的发生10 )。另一方面,据报道,PDT 11 )和 RFA 7、12 )可将致癌风险降低约 50%。特别是关于RFA对Barrett食管低度异型增生(LGD)的影响,我们比较了近年RFA组和随访组的HGD和Barrett食管癌发生率,发生率为1.5。 % 和随访组 26.5%,据报道 RFA 可以显着抑制致癌作用 13 )。
基于上述研究显示RFA对Barrett食管LGD影响的研究结果,英国胃肠病学会修订了201314年发布的指南,并将RFA对Barrett食管LGD的推荐等级改为A.pull up . 另一方面,尽管最近发布的澳大利亚指南介绍了这些结果,但不推荐用于 LGD 的 RFA,因为长期结果仍然未知 15 )。
如上所述,据报道 PDT 和 RFA 可用于抑制 Barrett 食管向 Barrett 腺癌的进展。RFA 被认为是好的。然而,所有这些研究都针对已经发生发育不良的患者,其长期结果尚未明确。
所有指南都推荐治疗 HGD,尽管证据不足。内镜切除术 (ER) 16)和 RFA 7 , 12)已被引用为治疗方法,内镜黏膜下剥离术 (ESD) 的有用性也有报道,尽管这是一项回顾性研究)18,。17
HGD 对应于日本组织病理学诊断中的黏膜内腺癌。尽管与西方国家一样,日本积极开展黏膜内腺癌的内镜治疗,但日本并未对伴有 LGD 的 Barrett 食管或不伴有异型性的 Barrett 食管进行内镜治疗。一个因素是无法使用欧美使用的RFA设备,食道正在接受仔细的随访。除了这种情况,作为巴雷特食管内镜治疗的一个注意点,即使巴雷特食管可以缩短,除非完全消除,否则无法消除致癌风险。6),并且目前在日本不推荐对没有非典型导管的巴雷特食管本身进行内镜治疗。此外,对于无 LGD 或异型性的 Barrett 食管的内镜治疗是否有助于长期预后和死亡率尚不十分清楚。
将内镜治疗局限于黏膜内腺癌的一个好处是它可以治疗巴雷特食管的黏膜内腺癌。伤害是内镜治疗的常见并发症。患者可能需要治疗,因为可以治疗黏膜内腺癌。治疗可在保险医疗范围内进行。
避免内镜治疗巴雷特食管本身的好处包括避免潜在的不必要或不充分的内镜治疗以及通过内镜治疗植入非典型导管的可能性,可以避免跌倒的风险。危害在于不提供可能降低癌症风险的治疗。内镜治疗无异型性巴雷特食管和伴有LGD的巴雷特食管的远期预后尚不清楚,患者现阶段似乎并不想要。医疗保险不包括治疗,其成本效益未知。
考虑到利弊的平衡、证据的程度和患者的意愿,建议:(
1)巴雷特食管黏膜内腺癌的内镜治疗仅限于黏膜内腺癌。(2)强烈建议
不要进行内镜对巴雷特食管本身进行治疗,以防止癌变
。 ”
参考
1)Bright T 等人:抗反流手术后,氩等离子凝固与内窥镜监测对巴雷特食管的随机试验:晚期结果。Ann Surg. 2007;246(6):1016-20。2)Ackroyd R 等人:发育不良 Barrett 食管的光动力疗法:一项前瞻性、双盲、随机、安慰剂对照试验。Gut. 2000;47(5):612-7。3)Hage M 等人:5-氨基乙酰丙酸光动力疗法与氩等离子凝固治疗 Barrett 食管消融:随机试验.Gut. 2004;53(6):785-90。四)Kelty CJ 等人:Barrett 食管的内窥镜消融:光动力疗法与氩等离子体凝固的随机对照试验. Aliment Pharmacol Ther. 2004;20(11-12):1289-96。五)Ragunath K 等人:异型性巴雷特食管的内镜消融比较氩等离子体凝固和光动力疗法:一项评估疗效和成本效益的随机前瞻性试验。Scand J Gastroenterol. 2005;40(7):750-8。6)Rees JR 等人:Barrett 食管的治疗。Cochrane Database Syst Rev. 2010;20(1):CD004060。7)Shaheen NJ 等人:Barrett 食管异型增生的射频消融术。N Engl J Med. 2009;360(22):2277-88。8)Orman ES 等人:Barrett's Esophagus 射频消融术的疗效和持久性:系统评价和荟萃分析。Clin Gastroenterol Hepatol. 2013;11(10):1245-55。9)Manner H 等人:内窥镜切除后残留 Barrett 上皮的消融:氩等离子体凝固与监测的随机长期随访研究(APE 研究)。内窥镜检查。2014;46(1):6-12。十)Sie C 等人:Argon 等离子凝固消融与 Barrett 食管的内窥镜监测:两项随机试验的晚期结果。内窥镜检查。2013;45(11):859-65。11)Overholt BF 等人:用 porfimer 钠光动力疗法消融 Barrett 食管重度不典型增生:国际、部分盲法、随机 III 期试验。Gastrointest Endosc. 2005;62(4):488-98。12)Shaheen NJ 等人:射频消融在 Barrett 食管伴发育不良中的耐久性。胃肠病学。2011;141(2):460-8。13)Phoa KN 等人:Barrett 食管和低度不典型增生患者的射频消融与内窥镜监测:一项随机临床试验。JAMA. 2014;311(12):1209-17。14)Fitzgerald RC 等人:英国胃肠病学会关于巴雷特食管诊断和管理的指南。Gut. 2014;63(1):7-42。15)Whiteman DC 等人:澳大利亚巴雷特食管和早期食管腺癌诊断和管理临床实践指南。J Gastroenterol Hepatol. 2015;30(5):804-20。16)Moss A 等人:Barrett 高度不典型增生和早期食管腺癌的内镜切除术:具有长期治疗益处的基本分期手术。Am J Gastroenterol. 2010;105(6):1276-83。17)Kagemoto K 等人:内镜黏膜下剥离术治疗浅表性 Barrett 腺癌的临床结果. Gastrointest Endosc. 2014;80(2):239-45。18)Chevaux JB 等人:内镜黏膜下剥离治疗浅表性巴雷特瘤的患者的临床结果。内窥镜检查。2015;47(2):103-12。
CQ38是否应该推荐药物治疗来预防 Barrett 食管的癌症?
证据强度C。我们强烈建议不要使用 COX2 抑制剂和他汀类药物等非甾体抗炎药来预防 Barrett 食管癌。(同意率100% [20/20])
评论
作为对该 CQ 的文献检索的结果,PubMed:157 篇文章,Cochrane:64 篇文章,Ichushi:157 篇文章和 7 篇来自其他人的文章进行了初步筛选。二次筛选后,我们对四项荟萃分析、一项随机试验、一项病例对照研究和六项观察性研究进行了定性系统评价。
药物治疗包括从巴雷特食管到巴雷特食管的质子泵抑制剂 (PPI) 1-3 )、阿司匹林4-7) 、非甾体抗炎药 (NSAID) 1、4、8 )和他汀类药物6、8-10 ) 。据报道,它对腺癌的进展有抑制作用。荟萃分析还报告了 COX2 抑制剂的抗癌作用 11 )。
如前所述,虽然有药物预期有防癌作用,但都是观察性研究,而meta分析也是观察性研究的研究,所以证据并不充分。最近发表的一项病例对照研究发现,PPI、阿司匹林、非甾体抗炎药或他汀类药物都不能预防巴雷特食管癌的发展,12)需要进一步调查。
尽管 PPI 并非旨在预防癌症,但它们可有效对抗与巴雷特食管相关的反流症状,并且通常被使用。
目前正在进行一项关于阿司匹林和 PPI 的癌症预防作用的大型随机对照试验 AspECT,但结果要等到 2019 年。
好处是它可以防止巴雷特食管的致癌作用,但证据水平很低。非甾体抗炎药,包括 COX2 抑制剂和阿司匹林可能会导致胃肠道黏膜损伤和随后的胃肠道出血,这些都不在保险范围内。
考虑到利弊之间的平衡、证据的程度和患者的偏好,建议是“我们强烈建议不要使用 NSAIDs,如 COX2 抑制剂或他汀类药物来预防 Barrett 食管癌。” .
参考
1)Nguyen DM 等人:Barrett 食管患者的药物使用和肿瘤形成的风险。Clin Gastroenterol Hepatol. 2009;7(12):1299-304。2)Kastelein F 等人:质子泵抑制剂降低 Barrett 食管患者肿瘤进展的风险。Clin Gastroenterol Hepatol. 2013;11(4):382-8。3)Singh S 等:Barrett'soesophagus 患者的抑酸药物和食管腺癌风险:系统评价和荟萃分析。Gut. 2014;63(8):1229-37。四)Corley DA 等人:阿司匹林/非甾体抗炎药与食管癌的保护性关联:系统回顾和荟萃分析。胃肠病学。2003;124(1):47-56。五)Rothwell PM 等人:每日服用阿司匹林对癌症长期死亡风险的影响:随机试验中个体患者数据的分析。柳叶刀,2011;377(9759):31-41。6)Beales IL 等:Barrett 食管患者定期使用他汀类药物和阿司匹林与降低食管腺癌发病率有关。Eur J Gastroenterol Hepatol. 2012;24(8):917-23。7)Sivarasan N 等人:阿司匹林在食管腺癌化学预防中的作用:一项荟萃分析。J Dig Dis. 2013;14(5):222-30。8)Kastelein F 等人:非甾体抗炎药和他汀类药物对 Barrett 食管患者具有化学预防作用。胃肠病学。2011;141(6):2000-8;测验 e13-4。9)Kantor ED 等人:使用他汀类药物和 Barrett 食管患者患食管腺癌的风险。Cancer Epidemiol Biomarkers Prev. 2012;21(3):456-61。十)Singh S 等人:他汀类药物与食管癌风险降低有关,特别是在 Barrett 食管患者中:系统评价和荟萃分析。Clin Gastroenterol Hepatol. 2013;11(6):620-9。11)Zhang S, et al: Cyclooxygenase inhibitors use is associated with the risk of esophageal adenocarcinoma in patients with Barrett's esophagus: a meta-analysis. Br J Cancer. 2014; 110(9): 2378-88。12)Masclee GM 等人:非甾体抗炎药、他汀类药物、低剂量阿司匹林和 PPI,以及 Barrett 食管患者发生食管腺癌的风险:一项基于人群的病例对照研究。BMJ Open. 2015;5(1): e006640。
第十三章 附录
附表1 病变部位
1 食道定义
食道是从食道入口到食道胃交界处。食管入口与环状软骨下缘水平重合。关于食管胃结合部EGJ的判定方法将在后面叙述(食管癌治疗规定第11版第36页)。
2 食管的分割
食管分为颈段食管Ce、胸段食管Te和腹段食管Ae。食管以下咽部Ph和食管胃交界处为界。食管胃交界区进一步分为食管E和胃G(图1)。笔记)颈段食管(Ce):从食管入口到胸骨上缘胸段食管(Te):从胸骨上缘到食管裂孔上缘上胸段食管(Ut) 上胸段食管:从胸骨上缘到隆突下缘胸段中段(Mt): 下段胸段食管(Lt)的上半部分胸段下段食管:胸骨下段的胸内食管隆突下缘至食管胃交界处的下半部腹食管 (Ae):腹食管(食管裂孔至食管胃交界处的上边界)
注) 食管胃交界处上下 2 cm 的区域定义为食管胃交界区。腹部食道Ae也包括在内。
(摘自日本食道学会:临床和病理食道癌治疗规则,第 11 版。)

附表2 肿瘤浸润深度(T)

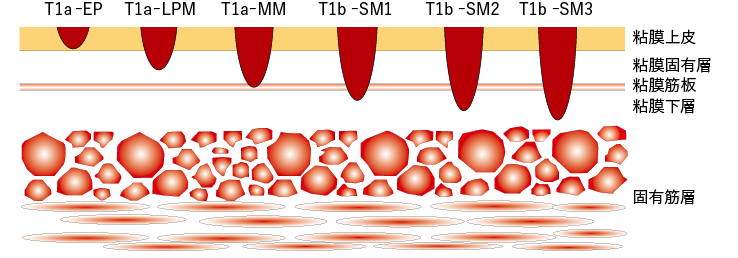
注1)早期癌:原发灶局限于黏膜壁的食管癌称为早期食管癌。有无淋巴结转移。
示例:早期癌症:T1aNXMX笔记2)对于 Barrett 食管腺癌
T1a-SMM 癌局限于浅表黏膜肌层
T1a-LPM 癌未到达深层黏膜肌层
T1a-DMM 癌侵犯黏膜深层肌层注3)浅表癌:到达粘膜下层的癌称为浅表癌。有无淋巴结转移。
示例:浅表癌:T1NXMX注4)常规常用的深度子分类大致对应如下。
M1:T1a-EP,M2:T1a-LPM,M3:T1a-MM,SM1:T1b-SM1,SM2:T1b-SM2,SM3:T1b-SM3注5)在内镜下切除的标本中,将粘膜下层分成三等份的距离是未知的,侵入下层的病变称为T1b-SM2。注6)应明确癌侵犯的器官,如心包、主动脉、腔静脉、气管、肺、膈肌、胸导管、喉返神经和奇静脉。
示例:T4a(肺)注7)若淋巴结转移已侵犯食管以外的器官,则按T4处理,按“T4(转移淋巴结数—侵犯器官)”的顺序描述。
示例:T4b(No. 112aoA-Aorta)
(日本食道学会编:食道癌的临床和病理规则,第11版。引述,部分修改)
附录 3 区域淋巴结命名

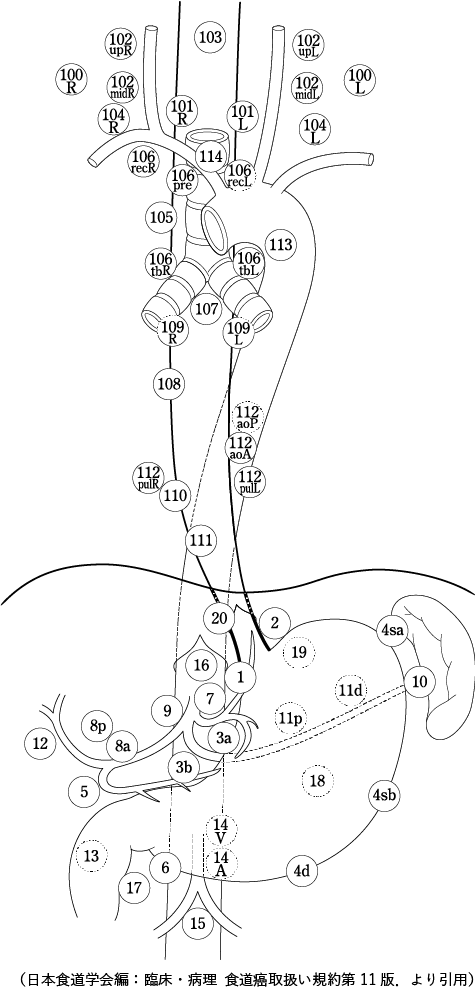
附录 4 淋巴结组按占用部位分类
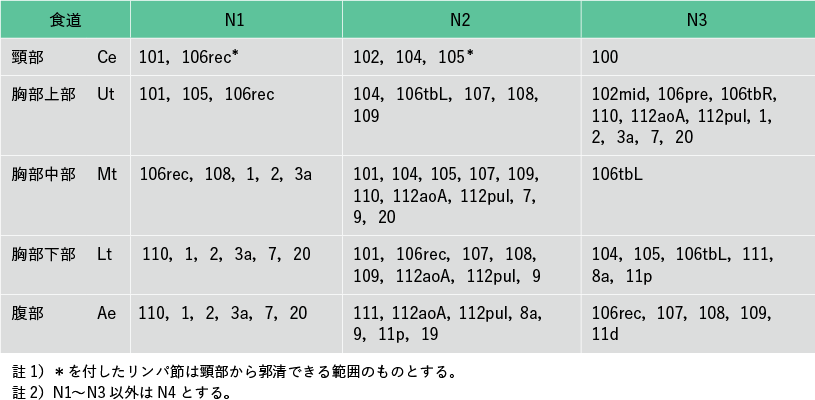
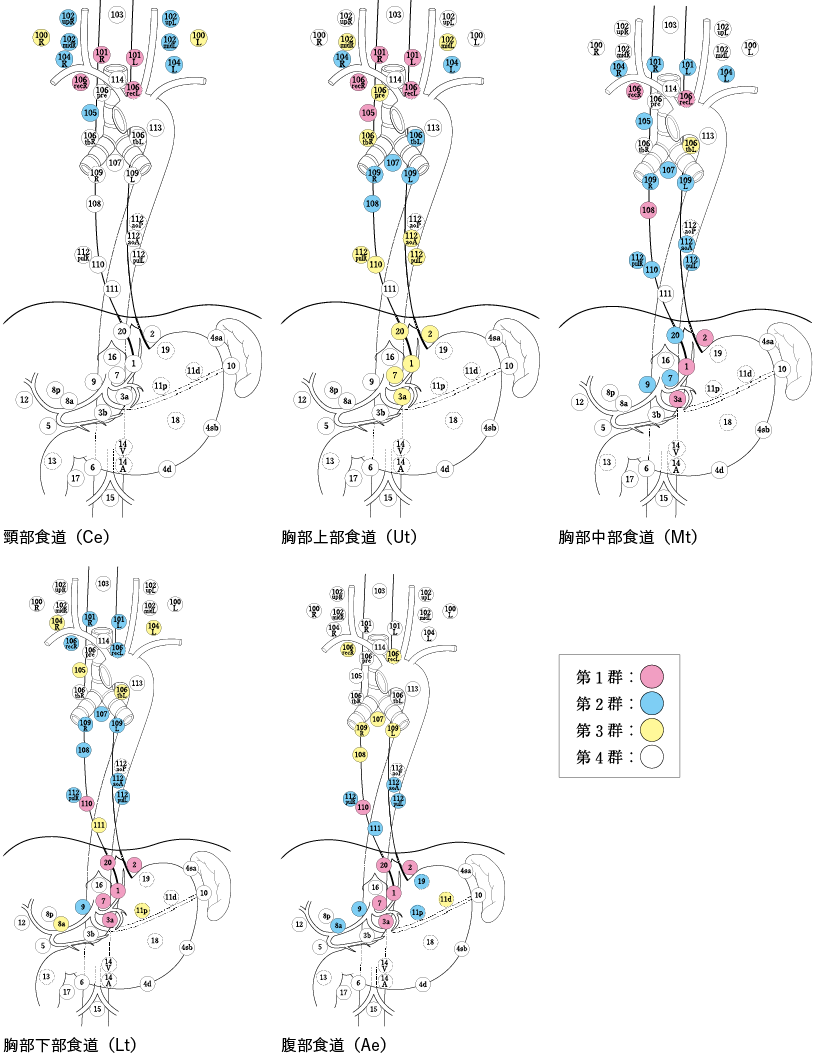
(摘自日本食道学会:临床和病理食道癌治疗规则,第 11 版。)
附录 5 TNM 分类(1997:第 5 版)

附录 6 TNM 分类(2002:第 6 版)

附录 7 TNM 分类(2009:第 7 版)
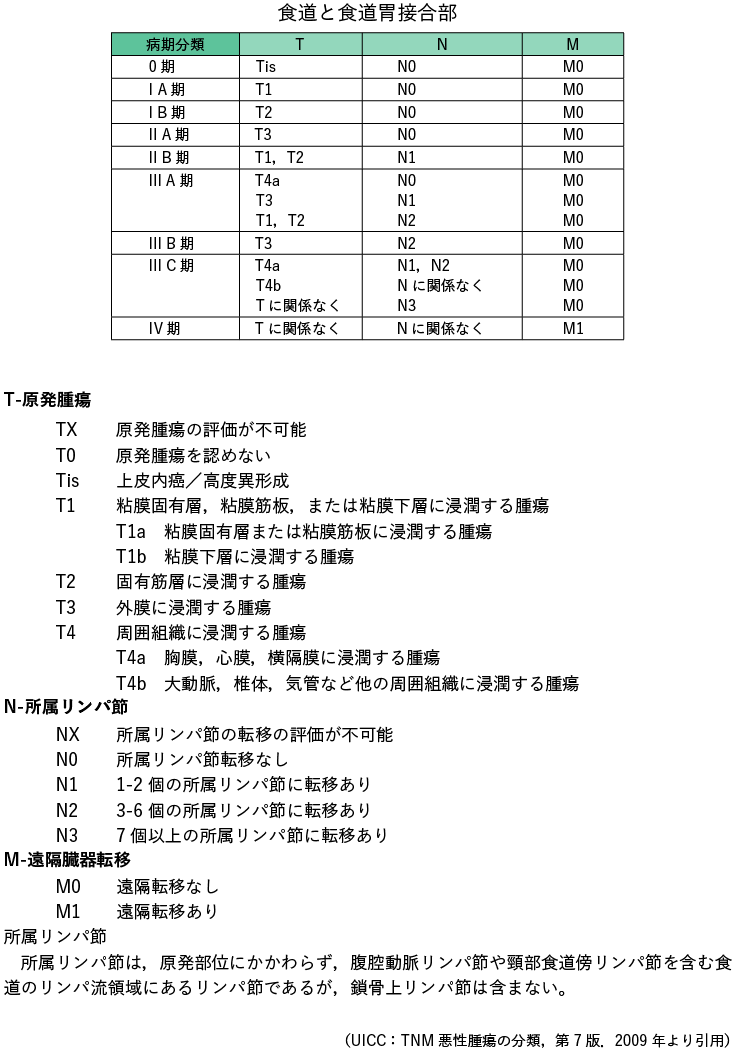
附8 淋巴结清扫
3个领域:从三个通路在每个部位进行淋巴结清扫:颈部、胸部和腹部。笔记)2个领域:每个部分的淋巴结清扫从胸部和腹部两条通路进行。
从颈部和腹部两条通路在每个部位进行淋巴结清扫。
从颈部和胸部两条通路在每个部位进行淋巴结清扫。1个区域:从颈部、胸部或腹部通路之一进行局部淋巴结清扫。
注)颈部淋巴结清扫为双侧进行,包括No.101和No.104。
(摘自日本食道学会:临床和病理食道癌治疗规则,第 11 版。)
附录 9 食管癌生存曲线
1 内镜治疗
2例手术切除
3 按临床分期
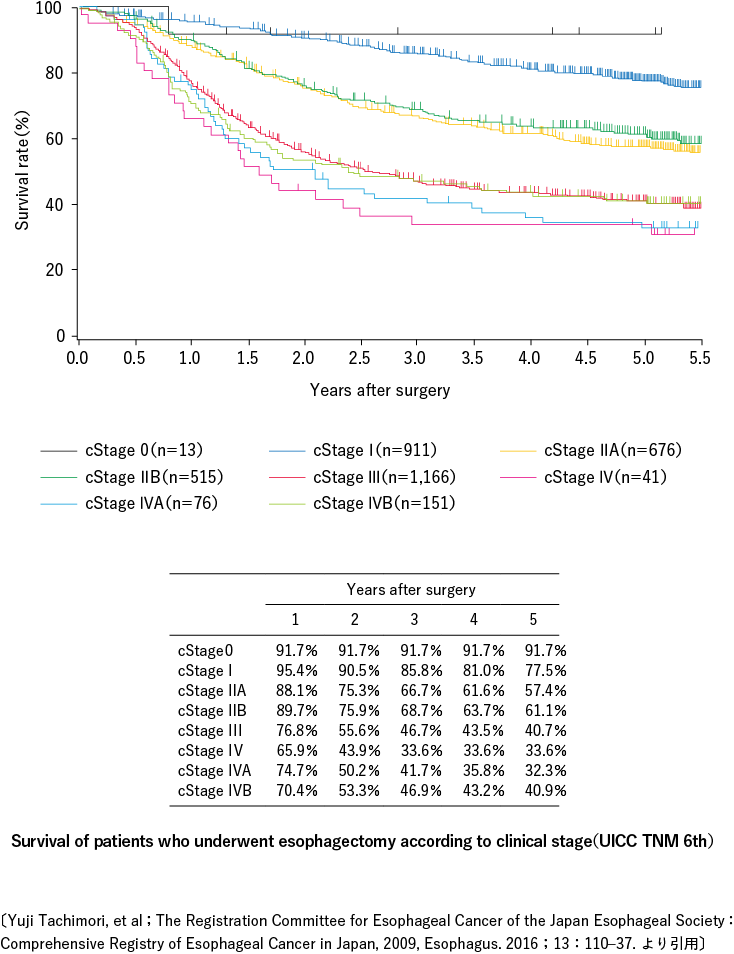
原文链接:http://www.xxwk.net/archives/3171