摘 要
目的:接受完全切除的早期非小细胞肺癌 (NSCLC) 患者继续表现出复发和死亡的高风险。新辅助方案的出现为这些患者带来了新的希望。本研究旨在进一步证明新辅助化学免疫疗法的疗效。
材料与方法:对 2018 年 1 月至 2020 年 12 月在上海肺科医院接受新辅助派姆单抗或纳武单抗联合化疗的患者进行了一项真实世界的观察性研究。主要终点为主要病理缓解(MPR),次要终点为客观缓解率(ORR)、病理完全缓解(pCR)、无病生存期(DFS)和毒性。
结果:共有 76 名患者被分析并分为派姆单抗(n = 42)和纳武单抗组(n = 34),中位随访时间为 12.2 个月。大多数患者 (92%) 患有 III 期疾病,其中 41 名 (54%) 和 29 名 (38%) 患者最初诊断为临床 IIIA 期和 IIIB 期。50 (66%)、21 (28%) 和 5 (6%) 名患者分别接受了两个、三个和四个周期的新辅助治疗,ORR 达到 75%。他们都没有出现因为无法忍受的不良事件而减少初始剂量或延迟的情况。分别有 49 名 (64%) 和 28 名 (37%) 患者实现了 MPR 和 pCR。RNA 测序显示 MPR 与具有三级淋巴结构 (TLS) 的细胞毒性免疫细胞的浸润增加有关。组织学评估强调了 B 细胞在 TLS 中的定位。42 名 (69%) 在基线时患有临床 N2 疾病的患者被降级为病理性 N0(39 名患者)或 N1(3 名患者)。III 期患者的一年 PFS 率为 91%。两组之间未观察到基线特征和治疗结果的差异。
结论:进一步验证了可切除NSCLC新辅助化学免疫治疗的可行性,MPR率高,不良事件可控。
引 言
非小细胞肺癌(NSCLC)占新诊断肺癌病例的 85%,并且仍然是全球癌症死亡的最重要原因。根据国际肺癌研究协会(IASLC)的报告,大约 50% 的 NSCLC 患者存在局部疾病(I 期和 II 期)和局部晚期疾病(III 期)。对于大多数可切除的肿瘤,建议尽可能进行完全手术切除,然而,可切除的 NSCLC 的总生存期 (OS) 随着分期的进展显着降低。尽管先前进行了治愈性手术,但大多数患者最终会出现术后复发。提高早期和局部晚期 NSCLC 的中位生存时间是目前胸部肿瘤学中最重大的挑战之一。
抗程序性死亡 1 (PD-1) 和程序性死亡配体 1 (PD-L1) 单克隆抗体极大地改变了局部晚期 NSCLC 的治疗模式。一线派姆单抗联合化疗在转移性 NSCLC 中显示出显着的疗效,且不会对 EGFR 敏感/ALK 改变,无论程序性死亡配体 1 (PD-L1) 表达如何,都具有可控的安全性和耐受性。与杜瓦鲁单抗联合免疫检查点抑制剂 (ICI) 策略已成为局部晚期不可切除 NSCLC 患者同步放化疗后的护理标准(基于 PACIFIC 试验报告的生存获益)。此外,已发表的研究初步阐明了抗 PD-1/PD-L1 单药治疗或其与化疗联合用于新辅助治疗的可行性,特别是对于可切除的局部晚期 NSCLC .在 LCMC3 试验中,两个周期的阿特珠单抗新辅助方案报告的主要病理缓解 (MPR) 率为 21%。另一项包含 21 名 I-IIIA 期 NSCLC 参与者的单臂试验在手术前接受两个周期的纳武单抗也报告了 MPR 率为45%。采用纳武利尤单抗和化疗联合治疗的 NADIM 试验在新辅助治疗后的 MPR 率高达 85%,12 个月和 24 个月的 PFS 率分别为 95.7% 和 77.1%。
从理论上讲,与辅助ICI方法相比,手术前存在肿瘤抗原可能会促使更强、更持久的抗肿瘤免疫反应,从而对微转移性疾病产生更积极的疗效。尽管如此,仍需要更多的证据。在此,我们报告了派姆单抗或纳武利尤单抗加化疗在潜在可切除 NSCLC 的初治和驱动突变阴性患者中的可行性、安全性和抗肿瘤活性。
材料与方法
2.1 病例特征
2018 年 1 月至 2020 年 12 月在上海肺科医院 (SPH) 接受新辅助派姆单抗或纳武单抗联合化疗的 NSCLC 患者符合本研究的条件。新辅助帕博利珠单抗或纳武利尤单抗联合化疗的主要标准是局部晚期疾病,包括 IIIB 期的 T3-4 和 N2 疾病,以及负驱动突变。此外,我们还包括在第一次评估后不能耐受手术的早期 NSCLC 患者。新辅助化学免疫疗法是在获得多学科会诊同意后实施的,其中包括肺科医师、肿瘤科医师、放射科医师和胸外科医师。接受其他新辅助疗法治疗或参加任何临床试验的患者未参加该研究。
2.2.研究设计
这项单中心回顾性研究得到了上海市肺科医院伦理审查委员会和机构审查委员会(IRB 编号:L21-224)的批准。IRB 放弃了知情同意,因为这是一项使用常规收集数据的非干预性研究。所有患者均接受常规的基线肿瘤诊断和分期,包括胸部计算机断层扫描(CT)、正电子发射断层扫描计算机断层扫描(PET/CT)、脑磁共振成像(MRI)、支气管内超声侵入性纵隔淋巴结分期。患者接受的新辅助治疗方案如下:派姆单抗(200 mg)或纳武单抗(360 mg)联合铂类化疗,在21天周期的第1天静脉给药。主治医师决定使用哪种免疫检查点抑制剂和治疗周期。根据实体瘤疗效评估标准(RECIST1.1版),在两个周期的新辅助治疗后和术前评估肿瘤的放射学反应。术前评估方法包括胸部 CT 扫描或 PET/CT 扫描、MRI 脑成像、支气管内超声侵入性纵隔淋巴结分期、心肺功能和体能状态评估。为了更深入地了解新辅助化学免疫疗法的潜在机制,对来自派姆单抗队列 (MPR:9, Non-MPR:7) 的 16 个手术肿瘤样本进行了 RNA 测序 (RNA-seq) 和免疫组织化学分析。RNA-seq的分析过程可以在补充方法上找到。
2.3病理学评估
根据肿瘤大小和受影响的淋巴结对手术标本进行重新分期。对原发性肿瘤进行切片,并重新评估每个肿瘤载玻片的活肿瘤细胞百分比。然后计算每个病例的活肿瘤细胞的平均百分比。主要病理缓解 (MPR) 定义为通过测量切除的原发性肿瘤中残留存活肿瘤的百分比,在原发性肿瘤床中存活的肿瘤细胞不超过 10%。对有病理改变的患者的整个原发性肿瘤床进行组织学检查。完全缓解(pCR),定义为所有载玻片中都没有活的肿瘤细胞。此外,没有任何治疗相关反应特征的肿瘤床被归类为无反应(NR)。与治疗相关的坏死或纤维化组织的存在而活体肿瘤细胞 > 10 % 被标记为部分缓解者 (PR)。
2.4研究终点
主要终点是 MPR。次要终点是客观缓解率(ORR)、pCR、无病生存期(DFS)和安全性。手术前根据 RECIST 1.1 标准评估 ORR。DFS定义为从开始新辅助治疗到疾病进展、复发或死亡的时间,以先到者为准。新辅助方案的安全性通过不良事件通用术语标准 (CTCAE) 5.0 版进行评估。
2.5统计分析
患者的特征是人口统计学和临床变量,例如年龄、性别和 Charlson 合并症指数。对分类变量使用 Pearson 卡方检验和对连续变量使用独立 Wilcoxon 秩和检验评估有关患者特征和围手术期结果的差异。使用逻辑回归模型估计区间 (CI)研究 MPR、优势比 (OR) 及其 95% 置信度的预测因子。PFS 使用 Kaplan-Meier 方法确定。使用 SPSS 22.0 版(IBM,纽约,美国)进行统计分析。所有统计检验都是双边的,显着性水平为 p < 0.05。
结 果
3.1病例特征
在这项研究中,总共确定了 76 个连续病例。患者的人口统计学和临床特征见表 1。患者主要为男性(72, 95%),病理证实为鳞状细胞癌(49, 65%)。大多数患者被诊断为 III 期 NSCLC(IIIA:41, 54%;IIIB:29, 38%)和 N2 期(59, 78%)。50 名患者(66%)接受了两个周期的新辅助治疗,21 名(28%)接受了三个周期,剩下的 5 名(6%)接受了四个周期。最后一次新辅助治疗和手术之间的中位间隔时间为 35 天(IQR:30-40)。在 65 个样本中检测到 PD-1 的表达。化疗方案见表 S1。总体来说,派姆单抗组和纳武单抗组之间没有发现显着差异。
3.2高效性及安全性
所有患者均获得R0切除。48 例 (63%) 行单孔胸腔镜手术 (U-VATS),19 例 (25%) 行前外侧开胸手术。只有两名患者经历了从电视胸腔镜手术 (VATS) 到开胸手术的转换。如图 1 所示,在新辅助治疗之前,有 25 例手术被认为是全肺切除术。最后,其中9例接受了袖状肺叶切除术(36%),6例接受了肺叶切除术(24%)。5 名患者在新辅助治疗后仍接受了左肺切除术(表 S2)。
根据 RECIST 1.1 标准,57 名 (75%) 患者达到部分缓解,19 名 (25%) 患者疾病稳定 (SD)。新辅助治疗期间无患者出现疾病进展(PD),疾病控制率为100%。此外,在 49 例患者(64%)中观察到 MPR,其中 28 例有完全的病理缓解(图 2)。通过放射学评估,5 名和 3 名 SD 患者分别实现了 MPR 和 pCR。此外,在 27 名非 MPR 患者中,有 17 名肿瘤出现 PR。42 名临床 N2 病患者在新辅助治疗后降期为 N1 或 N0 病(表 2,表 S3)。最常见的术后并发症是长时间漏气和肺炎,未报告围手术期死亡率(表 S4)。此外,在派姆单抗和纳武单抗组之间没有观察到术后并发症方面的差异。在 MPR 组中可以观察到更多的鳞状细胞癌 (p = 0.008) 和 PR (p = 0.019) 病例(表 S5)。此外,这些关联在逻辑回归模型中得到验证(表 S6)。临床分期 (p = 0.790)、淋巴结分期 (p = 0.361) 和吸烟状态均与 MPR 率 (p = 0.638) 无关。除了较低的 MPR 率外,在 SD 和 PR 患者之间没有观察到显着差异(表 S7)。由于无法忍受的不良事件(AE),没有患者不得不减少初始剂量或停止治疗。最常见的 3 级 AE 是中性粒细胞减少症。在新辅助治疗期间未观察到新的或意外的治疗相关 AE。
MPR 和 pCR 的回归床主要以细胞死亡的特征(多核巨细胞和胆固醇裂隙)为特征(图 1)。此外,退行床内有不同比例的密集的淋巴浆细胞、淋巴样聚集物、增厚的血管和新生血管。此外,我们还发现了罕见的三级淋巴结构 (TLS) 和致密的浆细胞,伴随着增生性纤维化和来自残余床的伤口愈合/组织修复的新血管形成,这些在无缓解者的标本中不存在或很少存在。此外,激活的 B 细胞相关基因(包括 PI3、GAL 和 IL6R)在实现 MPR 的患者与未实现 MPR 的患者之间存在显着差异(图 3,表 S8-9)。此外,与非 MPR 相比,被认为促进癌细胞凋亡的差异表达基因(DEG)在 MPR 队列中也显着富集,例如 p53 信号通路(图 S1)。此后,我们使用单样本基因集富集分析(ssGSEA)对肿瘤免疫微环境进行了更集中的研究。通过分析,在 MPR 患者中再次观察到 B 细胞特征的富集。同时,一系列活化的免疫杀伤细胞高表达,表明B细胞可能与其他免疫亚群一起作用。值得注意的是,免疫组织化学分析进一步阐明 CD20+ B 细胞定位于肿瘤床的 TLS,同时与 CD8+ T 细胞共定位(图 3C)。与其对应组相比,MPR 组中 CD20+ B 和 CD8+ T 细胞的密度也更高(表 S8)。
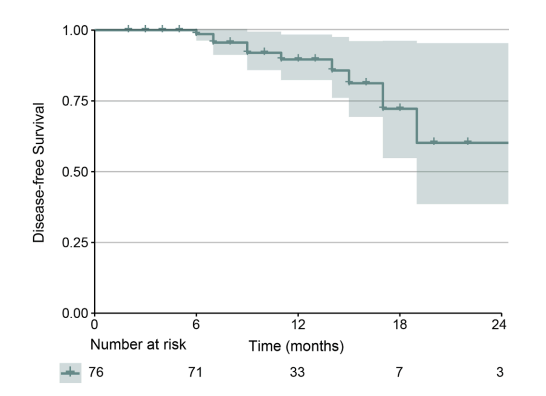
从新辅助治疗的第一天起,中位随访时间为 12.2 个月(四分位距:9.7-15.5)。11例患者术后复发,其中5例发生淋巴结转移(图4)。两名患者在残余肺中出现疾病复发。派姆单抗和纳武单抗联合组之间未发现显着差异(图 S2)。由于样本量适中且随访时间相对较短,因此未阐明复发的危险因素。
3.3特殊缓解案例
一名患者在新辅助治疗期间出现了新的磨玻璃结节(GGN)(图 S3),并通过楔形切除术切除。尽管原发肿瘤达到了 pCR,但该淋巴结被诊断为微创腺癌,未显示任何反缓解特征。此外,一名患者在新辅助治疗后被评估为无缓解者。治疗前出现的 GGN 持续稳定,没有任何进展。此外,我们在 10 例手术后淋巴结阳性的患者中发现了原发肿瘤和淋巴结转移之间完全不同的反应,其中 7 例实现了 MPR,3 例在原发肿瘤中实现了 pCR。
引 言
可切除 NSCLC 的新辅助免疫治疗很有吸引力,因为原发肿瘤可作为抗原来源,用于肿瘤特异性 T 细胞的扩增和激活以及微转移的全身监测。我们的研究是对新辅助帕博利珠单抗或纳武利尤单抗加化疗用于可切除 NSCLC 患者的回顾性真实世界评估。与历史新辅助化疗相比,联合治疗产生显着更高的 MPR 率 (49/76, 64%),并显示出可耐受的安全性。这种功效不受已知临床参数的影响,例如 PD-L1 表达状态。此外,大多数患者在新辅助化学免疫治疗后肺功能仍未受损。
在新辅助环境中,NSCLC 化疗的历史数据相对较低(MPR ~20% 和 pCR ≤ 4%)。许多新辅助免疫治疗 Ib/II 期临床试验报告了有希望的结果,以及一系列大规模和随机 III 期试验临床试验正在进行中。新辅助治疗中抗 PD-1/PD-L1 单药治疗的临床活性已报道早期非小细胞肺癌的 MPR 率为 21% 至 45%。此外,NEOSTAR 试验使用与单药治疗相比,新辅助治疗中的纳武利尤单抗加易普利姆玛显示出增强的病理缓解。与化疗联合后,MPR 率显着提高至 36-85%。使用纳武单抗加化疗的 NADIM 试验报告了惊人的结果。新辅助治疗后 MPR 率为 85%,12 个月时 PFS 为 95.7%(95% CI:83.7-98.9%),24 个月时 PFS 为 77.1%(95% CI:59.9-87.7)。有趣的是,新辅助化学免疫疗法的可观的有效性也得到了中国先前真实世界研究的证实。然而,使用派姆单抗联合化疗的 NEOMUN 试验的初步结果报告,13 例 MPR 仅为 27%。由于基于现有的试点研究,组合新辅助方案的疗效仍然存在争议,因此还需要更多的证据。除了小样本试验,CheckMate-816试验是第一个报道的III期新辅助化学免疫治疗临床试验。与新辅助化疗相比,三周期纳武利尤单抗联合化疗使 MPR 率提高 4 倍(36.9% vs 8.9%,p < 0.05),pCR 率提高 10 倍(24.0% vs 2.2%,p <0.001)。在 AE 和围手术期结果中未发现显着差异。然而,没有达到无事件生存期(EFS)的中位数。此外,世界各地正在进行许多正在进行的大规模 III 期试验,例如 AEGEAN 和 KEYNOTE-671 试验。
与之前的试验相比,我们的研究报告了与 NADIM 试验相似的 MPR 率,69% 的 N2 期疾病患者有淋巴结降期。与之前的临床试验一致,我们观察到 MPR 组的鳞状细胞癌患者多于非 MPR 组(69% vs 31%,p = 0.008),这可能是因为鳞状细胞癌发生更大的基线坏死。值得注意的是,先前的临床试验证明,MPR 患者的中位 DFS 明显长于非 MPR 患者。尽管由于我们研究的样本量适中和随访时间较短,我们无法观察到类似的结果。III 期患者的一年 DFS 率为 91%(n = 31/34),高于历史数据。
就具体方案和治疗周期数而言,各种研究采用了不同的新辅助免疫治疗策略。一般普遍接受2-4个周期。由于免疫治疗的延迟活性,更多的治疗周期和更长的术前间隔时间被认为产生更好的益处。一般在两个周期治疗后对患者进行评估,如果在我院进一步治疗后认为手术可行性有所改善,则继续治疗。本研究的中位间隔时间为 35 天,与之前报道的结果一致。
新辅助治疗通常在现实环境中针对患有局部晚期疾病的患者进行。此外,免疫治疗迅速缩小原发肿瘤,限制了实现适当切除所需的手术范围。尽管如此,新辅助免疫治疗的实施由多学科会诊进行评估,因为在手术过程中经常观察到与治疗相关的粘连和纤维化,这可能会增加完全切除困难。尽管存在技术上的困难,但我院大部分手术都是通过单孔胸腔镜手术完成的。没有患者死于术后并发症。20 例袖状肺叶切除术或肺叶切除术伴支气管成形术的患者中只有 2 例(10%)出现严重的术后并发症。一名患者患有呼吸功能不全的血胸,另一名患者患有呼吸功能不全的肺炎。与我们之前的结果一致,袖状肺叶切除术的主要并发症发生率为9.7%。即使在复杂的手术中,新辅助治疗也没有引起更多的主要术后并发症。
实现 MPR 的原发性肿瘤的免疫成分与未实现 MPR 的肿瘤不同。我们观察到增强的 TLS 与激活的免疫细胞的浸润。与先前的研究一致,观察到 CD20+ B 细胞位于 TLS 内。对黑色素瘤施用 ICI 的研究报告了在响应组中类似的增强的 TLS 浸润。TLS 被推测在支持局部和全身抗肿瘤反应中是必不可少的。ICI 的应用可能已诱导具有免疫记忆表型的效应 T 细胞的肿瘤浸润。此外,新辅助化疗还提高了乳腺癌中 TLS 的密度。我们的研究结果支持,在新辅助方案中,是 B 细胞引发了有利于免疫治疗和化学疗法联合治疗的积极作用。然而,TLSs的特异性免疫学特征和B细胞的特异性功能尚未完全确定,这可能反映了免疫治疗药物的潜在机制。
ICI 疗法能否有效控制转移性 NSCLC 患者的同步 GGN 尚不清楚。一项针对 37 例同步 GGN 的单中心回顾性研究报告称,晚期肺腺癌中的同步 GGN 可能对免疫治疗或联合治疗不敏感。与先前的结果一致,局部晚期疾病患者的新辅助化学免疫治疗不能消除同步 GGN。事实上,在我们的研究中,新辅助治疗期间出现了一种新的 GGN。浸润前肺腺癌倾向于不突破基底膜并阻止肿瘤抗原释放到微环境中。理论上,缺乏对有效肿瘤抗原的识别和呈递可能导致对免疫治疗的抵抗。
我们的研究有一些局限性。首先,由于研究的回顾性,我们的治疗效果估计可能会因患者选择偏倚而受到混淆。本研究仅纳入新辅助治疗后接受手术的患者。一些临床因素,如患者性别和治疗周期,不能很好地控制。与此同时,新辅助治疗前的肿瘤样本也没有得到妥善收集和储存。最突出的限制是它是一项样本量有限的单中心研究。许多问题仍需要调查,例如辅助治疗的疗效和安全事件。然而,我们的研究提出了新辅助免疫治疗对患者的有希望的疗效,值得进一步研究。第三,观察时间较短,未分析远期总生存率。因此,未来有必要进行大规模的临床试验。
结 论
总之,我们的研究表明,派姆单抗或纳武利尤单抗与化疗的组合作为可切除 NSCLC 的新辅助治疗显示出可观的疗效。该方案未发现不可接受的安全信号。此外,我们发现 TLS 中的 B 细胞在 MPR 队列中显着增加。我们的研究结果需要在随机临床试验中得到进一步证实,包括正在进行的 III 期 KEYNOTE-671 试验 (NCT03425643) 和 CheckMate77T 试验 (NCT04025879)。
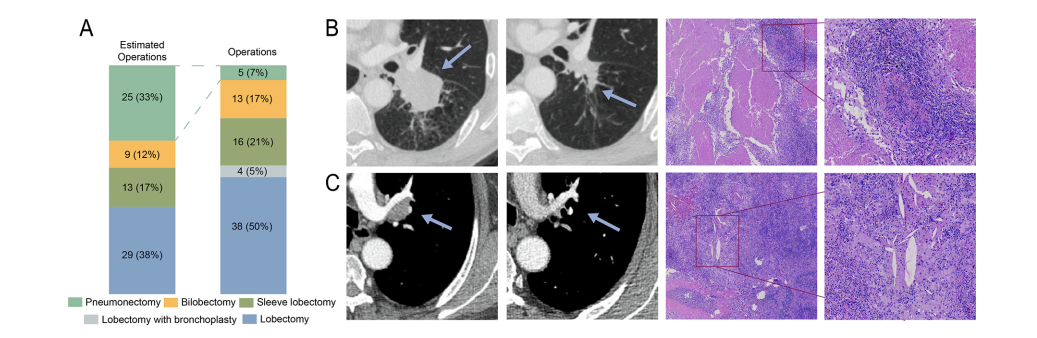
图 1. 新辅助免疫治疗联合化疗的放射学和病理学反应模式。
(A) 新辅助治疗前后的手术可行性。通过多学科会诊评估给药前的手术方法。
(B) 69 岁男性非吸烟者 IIIA 期 (T2bN2M0) 鳞状肺癌患者在 4 个周期治疗前后的胸部计算机断层扫描 (CT) 成像。在新辅助治疗之前,全肺切除术被认为适合该患者。手术前进行的扫描显示缩小了 67%(箭头)。该患者接受了袖状肺叶切除术,原发肿瘤 100% 病理消退。在右行中,显示的是肿瘤标本(苏木精和伊红,HE)染色的代表性切片,原始放大倍数 ×40 和 ×100)。回归床的特征是具有激活特征的密集免疫浸润[三级淋巴结构 (TLS) 和密集的肿瘤浸润淋巴细胞 (TIL) 浸润],以及细胞死亡的特征。
(C) 66 岁男性 IIIB 期 (T4N2M0) 鳞状肺癌患者在 2 个周期治疗前后的胸部 CT 成像。该患者在新辅助治疗前被认为是全肺切除术。手术前进行的扫描显示缩小了 53%(箭头)。该患者接受了肺叶切除术,原发肿瘤 100% 病理消退。右行显示的是肿瘤标本的代表性切片(HE染色,原始放大倍数×40和×100)。细胞死亡特征(胆固醇裂隙、间质泡沫巨噬细胞)在回归床中很明显。
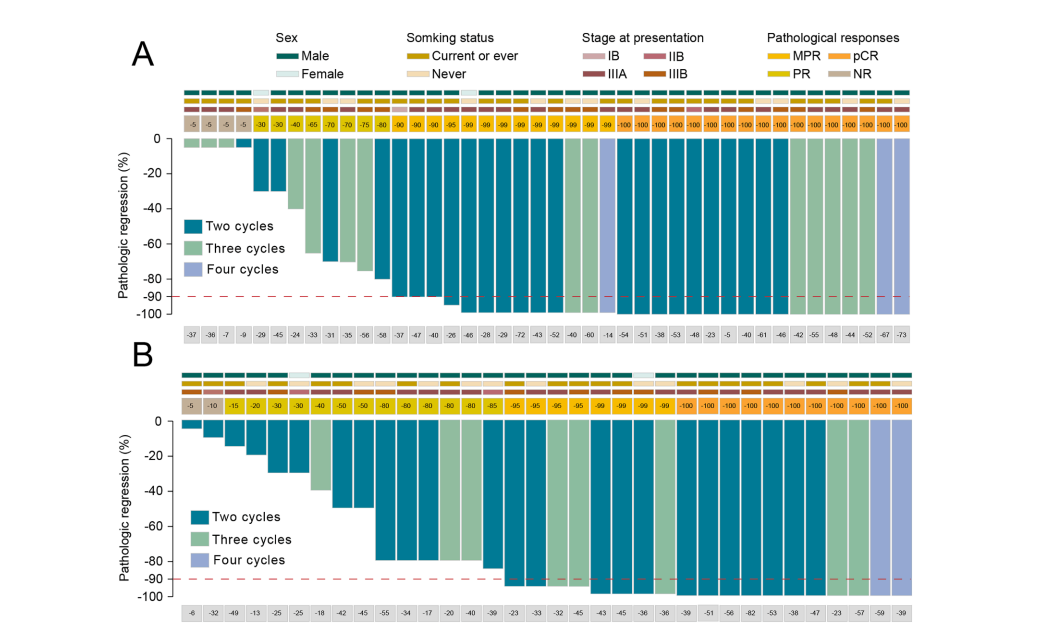
红色虚线表示主要病理缓解的阈值(90% 回归)。临床和病理特征包括性别、吸烟状况、临床分期和术前放射学反应(根据实体瘤反应评估标准,RECIST)。
MPR,主要病理缓解;pCR,病理完全缓解;PR,部分缓解;CR,完全缓解;SD,疾病稳定;NA,不可用。
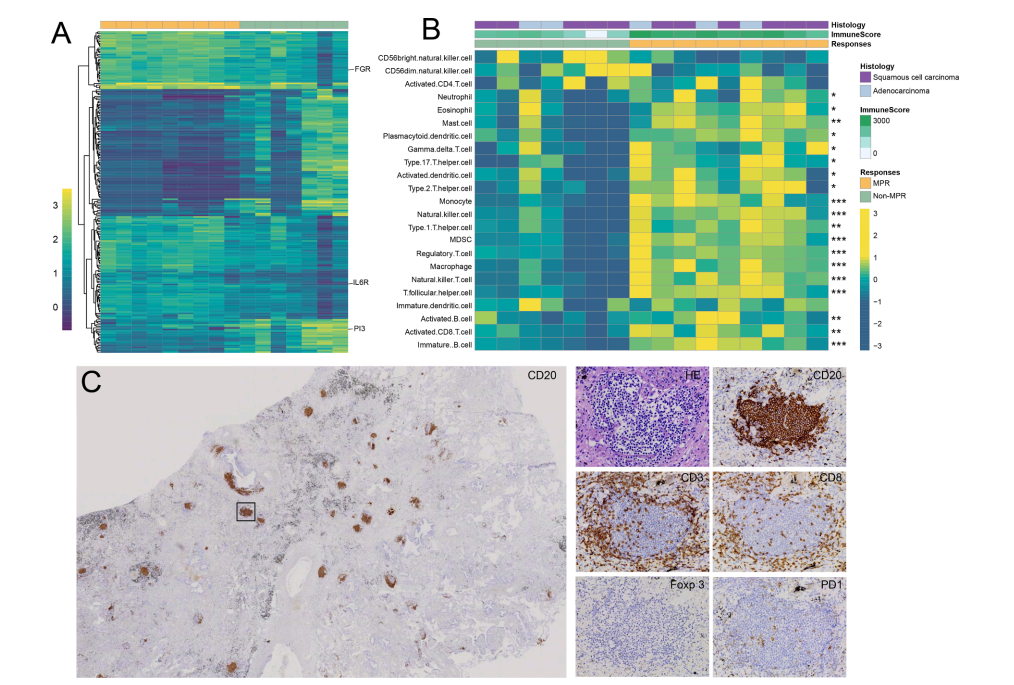
(A)在 RNA-seq 分析(MPR 与非 MPR)中对 DEG 进行有监督的层次聚类。
(B) 通过缓解 (MPR 与非 MPR) 对肿瘤样本进行监督聚类,显示 ssGSEA 免疫评分。
(C) 新辅助治疗后缓解者中 TLS 的 CD20 染色的代表性图像。
MPR,主要病理缓解;TLSs,三级淋巴结构;*, p < 0.05; **, p < 0.01; ***;p < 0.001。

原文链接:http://www.xxwk.net/archives/757