——摘要——
非小细胞肺癌是全球最常见的癌症之一,5年生存率约为20%。尽管免疫治疗似乎只对一部分患者有效,但已经证明了其在非小细胞肺癌患者中长期和持久的反应。更全面地了解潜在的肿瘤生物学可能有助于识别那些可能达到最佳结果的患者。肿瘤微环境(TME)分析已被证明有利于解决基本的肿瘤-免疫细胞相互作用。多重免疫组化和分子条形码技术的进展引发了非小细胞肺癌基因和蛋白质谱的最新进展。这里,我们回顾了用于分析非小细胞肺癌组织样本的空间分析技术的最新进展,以获得非小细胞肺癌的新见解和治疗选择。空间转录组学与高级影像学的结合可能有利于对非小细胞肺癌组织生物学的深入了解,这可能是预测治疗反应的有力工具。
1.1肺癌
肺癌是美国和全球癌症死亡的主要原因。小细胞肺癌和非小细胞肺癌是肺癌的两种主要组织学亚型,其中非小细胞肺癌占所有病例的76%。基因组图谱的进展已经确定了肺癌的分类模式。肿瘤突变、重排和基因表达谱可以用通过特异性试剂或免疫检查点抑制剂(ICIs)靶向治疗。在过去十年中,ICIs扩展了非小细胞肺癌的治疗选择。然而,似乎只有一部分患者获得持久和长期的益处。因此,需要预测性生物标志物来识别那些可能对免疫疗法有反应的人。使用针对程序性细胞死亡1 (PD-1)和程序性死亡配体1 (PD-L1)的抗体的研究表明,PD-L1肿瘤比例评分(TPS)可以作为预测哪些患者对ICIs反应最佳的指标,这表明需要对非小细胞肺癌患者进行PD-L1 TPS检测。此外,研究表明,在接受PD-1/PD-L1抗体的患者中,非同义肿瘤突变率较高与临床结果改善相关。
1.2晚期非小细胞肺癌的免疫检查点抑制剂治疗
抗PD-1治疗的随机临床试验显示,已经接受标准护理治疗的转移性非小细胞肺癌患者组具有很强的抗肿瘤活性。研究发现,与二线多西他赛相比,使用PD-1抑制剂纳武利尤单抗(nivolumab)可以提高伴有鳞状和非鳞状组织病变的晚期肺癌患者的总存活率(OS)。对患者生存率的最新分析显示,接受纳武利尤单抗(nivolumab)治疗的鳞状和非鳞非小细胞肺癌患者的中位OS均高于接受多西他赛治疗的患者。因此,美国食品药物管理局(FDA)批准纳武利尤单抗(nivolumab)作为晚期非小细胞肺癌的治疗方案。
PD-L1在非鳞癌和鳞癌之间的表达差异提供了一个早期的迹象,即PD-L1的表达可能不是一个理想的预测性生物标志物。帕博利珠单抗(Pembrolizumab)是一种PD-1抑制剂,在Keynote-001研究发现既往治疗的NSCLC患者的客观应答率(ORR)为19.4%后获得批准应用。此外,在Keynote-010 研究中的帕博利珠单抗(Pembrolizumab)的II/III期试验显示,在接受帕博利珠单抗治疗时,TPS≥1%(PD-L1表达至少为1%)的患者比多西他赛有更好的OS。帕博利珠单抗在PD-L1 TPS至少为50%的患者中也更有效。PD-L1在肿瘤浸润性免疫细胞和肿瘤细胞表面的表达似乎与临床反应有关。PD-L1抑制剂帕博利珠单抗的I期临床研究显示,PD-L1的高表达与临床反应有关。在POPLAR和OAK试验之后,阿特珠单抗被批准用于在以铂为基础的化疗期间或之后进展的非小细胞肺癌转移性疾病患者。在POPLAR试验中,以前接受过阿特珠单抗或多西紫杉醇治疗的晚期非小细胞肺癌患者比阿特珠单抗单臂上的OR较长,这与免疫细胞或肿瘤细胞中PD-L1的表达有关。在OAK试验中,阿特珠单抗显著改善了接受过至少一种铂类化疗的晚期非小细胞肺癌患者的OS。重要的是,无论是免疫细胞还是肿瘤细胞中PD-L1高表达的患者都有最大的益处。ATLANTIC试验(Durvalumab的开放标签II期试验)发现,在既往接受过治疗的晚期NSCLC患者中,ORR和肿瘤表面PD-L1的表达之间存在关联。尽管如此,一些PD-L1低表达/无PD-L1表达的患者有ORR,表明PD-L1可能不是一个理想的预测性生物标记物。
1.3免疫检查点抑制剂(ICI)治疗非小细胞肺癌的一线治疗
在一线背景下的几个研究中对ICI治疗效果进行了调查。在PD-L1 TPS为≥50%的未经治疗的晚期非小细胞肺癌患者中,比较帕博利珠单抗治疗和以铂为基础的化疗的患者的生存情况。与标准化疗的患者相比,帕博利珠单抗被证明可以提高患者中位无进展生存期(PFS)和OS。纵向上也观察到了类似的结果,接受帕博利珠单抗治疗的患者的OS比化疗组要好。即使在151名化疗患者中有82名从化疗组转移到帕博利珠单抗治疗组后,也能看到这一益处。研究还发现,帕博利珠单抗要是作为一线治疗的单药,必须仅限于TPS在50%或更高的患者。CheckMate026研究中的纳武利尤单抗(nivolumab)没有这一发现,这是一项在PD-L1 TPS为≥1%的未经治疗的晚期非小细胞肺癌患者中比较纳武利尤单抗(nivolumab)和以铂为基础的化疗治疗效果的三期临床研究。根据初步疗效和探索性分析,PD-L1 TPS≥5%的患者和PD-L1 TPS≥50%的患者在PFS或OS方面均无显著差异。总而言之,帕博利珠单抗仍然是FDA批准的唯一用作一线单一药物的ICI。
1.4 .PD-L1表达
PD-L1免疫组织化学(IHC)检测是FDA批准的第一个ICIs辅助诊断检测。这个检测允许估计PD-L1膜表达强度的肿瘤细胞的百分比。目前,有四种FDA批准的肺癌PD-L1检测方法:22C3、28-8、SP263和SP142。已经对肿瘤和免疫细胞进行了几项研究,以比较这些PD-L1表达检测的敏感性和重复性。其中,由国家综合癌症网络、蓝图项目赞助的一项研究显示,克隆SP142的灵敏度低于其他检测方法。FDA已经批准了由Agilent技术公司开发的22C3药物Dx试验,作为帕博利珠单抗的辅助诊断,而其他的检测已经被批准作为补充。这些检测的预测性能是有限的,已经证明,在有些没有肿瘤PD-L1表达的患者中也观察到了临床益处,而有一些患者,即使肿瘤PD-L1表达水平高,也不能从ICIS中受益。因此,PD-L1表达状态本身不足以预测哪些患者将受益于帕博利珠单抗作为晚期非鳞状非小细胞肺癌的一线单药治疗。对1586名肺腺癌患者进行了一项研究,以了解PD-L1的表达和有针对性的进行下一代测序(使用纪念斯隆·凯特林-可操作癌症靶标的集成突变分析[MSK-IMPACT])[27]。研究发现,PD-L1在不同器官中的表达分布和预测价值不同,淋巴结中PD-L1的表达较丰富,而骨骼中PD-L1的表达主要为阴性。TP53、MET和KRAS突变与PD-L1高表达有关,EGFR和STK11突变与PD-L1阴性相关。总体而言,我们得出结论,PD-L1的表达与ICIS反应的相关性在不同的组织之间是不同的。此外,不同基因的突变可能会影响PD-L1的表达及其对ICIS应答的预测价值。
1.5.肿瘤突变负荷(TMB)
肿瘤突变负担(TMB)是对在肿瘤样本中发现的体细胞突变数量的评估。这项检测在免疫肿瘤学中的应用是基于这样一种理解,即非同义突变的数量增加会导致产生独特的肿瘤新抗原,这些抗原被适应性免疫细胞检测。这种关联已经在诸如Checkmate-026、Oak和Poplar等回溯性研究以及回溯性非试验队列中被发现。目前,这些发现表明,在ORR或PFS方面,而不是在OS方面,具有临床优势。在高度突变的肿瘤中,已经观察到突变负荷与抗PD-1/PD-L1抗体的反应之间的关系,这些肿瘤已被证明在DNA修复基因如MLH1、PMS2、MSH2和MSH6中存在突变。CD8+T细胞浸润增多是这些肿瘤最显著的特征。在一项确定TMB疗效的研究中,1662名接受ICIS治疗的晚期癌症患者和5371名未接受ICI治疗的晚期癌症患者接受了靶向NGS(MSK-IMPACT)治疗。研究结果表明,较高的体细胞TMB(在每种组织学中最高的20%)与患者较好的OS之间存在联系。实体癌的高TMB临界值如下:乳腺癌5.9 MT/Mb、HNSCC 10.3 Mb、NSCLC 13.8 Mu/Mb、黑色素瘤30.7 Mb和结直肠癌52.2 Mb/Mb
1.6.肿瘤微环境(TME)
肿瘤是复杂的细胞环境,由相互连接的不同类型的细胞组成[36]。肿瘤周围有多种细胞类型和因素有助于肿瘤的起始、生长和扩散。TME是由起源于恶性间质、内皮细胞和免疫细胞的细胞毒性或细胞保护性信号通路形成的。TME包含多种与肿瘤生长有关的细胞和血管化组织,要么是血管,要么是淋巴血管,以及免疫浸润和细胞外基质(见图1)。肿瘤与其微环境的相互作用影响肿瘤的生长、侵袭和对治疗的抵抗力。已发现几个因素影响TME,包括肿瘤类型、TMB和免疫细胞浸润。对TME异质性进行全面和深入的分析对于确定患者的最佳治疗策略至关重要,特别是在接受ICIS治疗的患者中,肿瘤的免疫识别程度是一个重要的考虑因素。无论是在转录水平还是在翻译水平,大量肿瘤分析都不能揭示TME的空间分辨表现。多路IHC、成像和条形码技术的最新进展通过解决细胞的空间位置以及TME的组成和功能表型,为更好地理解TME铺平了道路。肿瘤中的T细胞浸润被认为为有效的免疫治疗提供了一定程度的免疫识别。因此,免疫环境(类型、密度和位置)以及免疫特征(如免疫细胞的表型和功能特征)被用来更好地了解免疫细胞和肿瘤之间的相互作用,潜在地导致抗PD-1/PD-L1抗体的预后生物标志物的发现。虽然传统的IHC方法允许肿瘤的空间轮廓,但当使用批量组织基因组方法分析肿瘤细胞时,这一选择往往被放弃。此外,不存在对实际细胞比例、细胞异质性或更深层次的空间分布的描述。空间和免疫成分,以及细胞状态,有助于识别TME中的微生态。确定TME内免疫环境的特征也为了解免疫成分和状态(激活/抑制)如何影响治疗反应铺平了道路。为了满足这一要求,需要同时成像和组织采样来分析空间免疫细胞和肿瘤组织。
| 2.肺癌的空间成像技术 |
了解组成TME的复杂细胞类型以及它们如何相互作用有助于了解恶性原发和继发肺癌[45,46]。原发性和继发性肺肿瘤的治疗失败和耐药性表明,这些细胞在肿瘤间和肿瘤内表现出广泛的异质性。因此,了解细胞类型与其形态和病理特征之间的分子关系至关重要。自20世纪90年代末以来,随着基因组杂交原位测序方法的发展,空间生物学领域得到了迅速发展,特别是在最近五年。从使用激光捕获显微切割分离目标区域到多重原位捕获蛋白质/基因,该领域发展迅速。最近的研究强调了使用不同的转录/蛋白质组学方法,如单细胞测序、质谱和多重免疫荧光来阐明肺癌TME的重要性。虽然空间技术在肺部肿瘤中的应用仍处于早期阶段,但新兴的研究将帮助我们更多地了解这些异质肿瘤(表1)。这些组学方法使分子定义的细胞类型可视化以及rna和蛋白质标志物的同时鉴定成为可能,为肺癌的定性开辟了新的途径。最近,空间分辨转录学被“自然方法”评为年度最佳方法。随着这项技术在肿瘤学研究中迅速获得吸引力,最近的文献研究对各种技术如何编码空间信息提供了普遍性解释。
2.1 多路错误-鲁棒荧光原位杂交(MERFISH)
多路错误-鲁棒荧光原位杂交(MERFISH)是一种在单细胞水平上对单个RNA分子进行成像的技术。单个RNA物种首先被分配给错误-鲁的条形码,然后用寡核苷酸标记,每个寡核苷酸代表一个条形码,最后,顺序的单分子FISH成像被用来读出这些条形码。它不仅提供了RNA表达的定量测量,而且还确定了单个RNA分子在新鲜冰冻组织中的空间定位,使其具有高精度和高检测效率。这些特性为生物过程带来了新的见解,包括细胞极化、细胞迁移、细胞分裂过程中细胞命运的决定以及局部翻译。因此,使用这项技术,可以同时绘制、计数和成像单个细胞中数以千计的RNA物种,还可以在原位描绘调控网络和识别细胞类型。然而,这项技术目前仅限于1001个mRNA分子。
2.2 10x基因组学 Visium空间基因表达
Visium是一种空间转录学技术,它可以使用捕获探针的草坪来分析组织[39]。利用数以千计的条形码mRNA捕获点,可以对新鲜冰冻的样品进行检测,因此,它可以用全转录组的分辨率来量化基因的表达。除了识别不同的细胞群外,该技术还能够证明TME中细胞功能、表型和位置之间的关系,同时保留组织的空间背景。因此,Visium具有特殊的临床应用,例如研究肿瘤的异质性和组织形态,发现新的生物标记物,以及确定对治疗干预措施的反应。第一步包括小心地将组织样本放置在载玻片的捕获区域上。在组织固定和渗透之后,RNA被释放并与捕获探针结合,从而捕获基因表达数据。然后,合成cDNA,收集结合的遗传数据并进行空间分析。这项技术有一些局限性,比如对新鲜组织的需要,以及当前对优化工作流程的需要。每张幻灯片都有四个捕捉区域,每个区域包含5000个条形码位点,每个区域都有数百万个探针。因此,创建数千个单独位置的转录图谱很简单;然而,条形码区域可能包含多个细胞。FFPE和单细胞兼容性预计将与他们即将推出的Visium HD技术相结合。
2.3 NanoString生物公司的GeoMxTM数字化空间分析系统(GeoMx Digital Spatial Profiler)
NanoString生物公司的GeoMxTM 数字化空间分析系统是一种非破坏性的技术,可以用来深入分析2RNA/蛋白质表达。DSP平台采用寡核苷酸检测技术,可以对新鲜、冷冻或固定组织样本中的RNA和蛋白质进行多路定量,空间分辨率低至几个细胞。在组织制备之后,样品与可视化标记(例如,泛细胞角蛋白、CD8和CD3)孵育,并与寡核苷酸标记结合。之后,使用一组用户定义的感兴趣区域(ROI)来描绘组织架构。最后,通过紫外线(UV)曝光从离散区域释放寡核苷酸标签,并进行计数/测序以生成分析物丰度的空间分辨轮廓。DSP提供了几个优点,例如用户定义的ROI分析和多光谱成像。通过使用紫外光切割信号,DSP还可以消除化学剥离的需要,这是其他多色IHC技术的一个缺点DSP平台被认为是目前临床诊断中的应用的单染色IHC方法的有价值的附加物。它能使高复数和高通量的RNA/蛋白质空间图谱成为可能。根据Monkman等人的研究,在NSCLC患者中,他们发现与肿瘤相比,TME中CD3、CD4、CD27、CD45、CD45RO、CD68、CD163和Vista显著富集。与TME相比,正常邻近组织中纤维连接蛋白、CD34、IDO1、ARG1、LAG3和PTEN表达丰富。此外,该研究还发现,OS的改善与肿瘤隔室中表达CD3、CD34和ICOS的细胞的存在之间存在联系。此外,Zugazagoitia等人确定了非小细胞肺癌对ICIS反应的预测性生物标志物。这项研究将DSP技术应用于免疫疗法治疗的非小细胞肺癌患者的样本,并量化了组织间的多种免疫参数,包括肿瘤、白细胞、巨噬细胞和非免疫基质。他们发现了18个与空间结果相关的标记物,其中在白细胞中测量的CD4和CD56,以及在间质中测量的CD56是与临床结果相关的预测标记物,包括PFS和OS。其中一个挑战是实现单细胞分辨率兼容性,这是目前正在用空间分子成像仪(SMI)开发的。
2.4 NanoString空间分子成像仪(SMI)
NanoString SMI是一个集成系统,包括成熟的环原位杂交化学、高分辨率成像读出仪器以及交互式数据分析和可视化软件。NanoString的SMI技术能够直接从单个细胞中分析成百上千个RNA或蛋白质,在形态完整的组织样本中具有亚细胞分辨率。SMI结合了高丛分析和高分辨率成像的能力,使研究人员能够量化和可视化组织切片中的目标蛋白质和基因表达。样品制备包括标准的原位杂交处理步骤,允许使用病理学实验室标准玻片,以及不需要cDNA合成或扩增。SMI依赖于高度复合的原位杂交化学以及直接的单分子成像和计数。单个细胞中RNA或蛋白质靶标的检测是通过将靶标与用独特条形码系统标记的特定探针或抗体杂交来完成的。然后使用循环循环的荧光标记报告探针成像来执行条形码读出。在细胞中,每个RNA或蛋白质看起来都是一个单独的点,可以通过计算成像点的数量来进行数字量化。SMI技术不使用反转录、扩增或酶,从而实现了高检测效率和无偏量化。综上所述,预先设计的高达1000个复合体的面板、低拷贝数基因的精确检测、亚细胞分辨率的三维映射以及具有空间背景的单细胞生物标记物的量化是SMI技术的一些显著特征(参见图2)。
2.5 Ultivue公司 InSituPlex技术
多重染色高空间分辨率的无偏差组织生物标记物分析法
使用InSituPlex DNA条形码和抗体染色技术,Ultivue可实现组织生物标志物的空间轮廓分析以及细胞表型的全玻片多路复用。该平台实施精细的染色过程以保持组织样本的完整性。InSituPlex技术可以识别单个细胞中广泛细胞成分的各种标记,包括细胞核、细胞质和质膜。这些特征通过对标志物的阳性检测,使组织的免疫表型更加准确和深入。使用条形码线性放大技术,这项技术可以监测不同的标记到标记和细胞到细胞的表达水平,并增加用于成像的杂交位点的数量。除了高性能的组织多路复用,该平台还能够量化生物标记物的共定位和共表达。为了使肿瘤样本可视化,必须对它们进行脱蜡和提取,然后经过染色、扩增和检测三个步骤。样本与条形码抗体的混合物孵育,每个抗体都有一个独特的DNA序列。在目标同时扩增之后,它们与互补的荧光DNA探针结合,然后准备用于成像。Ultivue平台的不同之处在于,检索、染色、放大和检测的每个步骤只执行一次,整个过程大约需要5.5小时,尽管缺少预先存在的载玻片扫描仪可能会阻碍分析的进展。Humphries等人。用Ultivue观察数字图像分析(DIA)和多重免疫荧光技术能否提高PD-L1诊断试验的准确性。在这项研究中,他们发现使用DIA进行PD-L1表达分析与人工评估有显著的一致性,敏感性为86.8%,特异性为91.4%。此外,研究发现使用多重技术在PD-L1+/细胞角蛋白+或PD-L1-/细胞角蛋白+肿瘤巢中可以很容易检测到PD-L1+/CD68+巨噬细胞。
2.6.抗体索引联合检测(CODEX)
抗体索引联合检测(CODEX)是一个多重荧光显微镜平台,它使用DNA偶联抗体分析组织切片中的40个目标分子。CODEX技术通过使用单个初始染色步骤和之后的多个成像步骤,以及去除抗体结合条形码来加快这一过程。它还可以防止组织降解,这是其他循环免疫荧光(CycIF)方法的缺点。DNA偶联抗体使用互补的荧光DNA探针进行可视化,然后伴随成像、探针剥离、洗涤和重新渲染。这个平台被用来识别组织中的单个细胞,以及发现新的细胞类型和细胞间的相互作用。因此,CODEX在空间环境中的单个细胞单元级别提供多路复用标记检测,从而允许对TME进行更深入的检查。
2.7 成像质谱(IMC)
成像质谱(IMC)是一种使用金属偶联抗体的质谱细胞术方法。IMC可以用亚细胞空间分辨率测量多达50个标记的表达。在冰冻切片和FFPE组织切片中已经证实了IMC。首先在组织切片上用几种抗体附着在稳定同位素上进行标记。然后用激光系统切割这些部分,以产生直径为1μm的管段。在雾化和电离之后,使用飞行时间质量分析仪对每一段的金属同位素含量进行定量。基于每个点的同位素丰度生成伪彩色和空间分配的图像。IMC与传统的免疫荧光(IF)方法的不同之处在于它没有自发荧光、光谱重叠和信号衰落。通过生成空间信息,IMC提供了细胞子集和细胞间相互作用的更精确视图。此外,IMC还可以用来显示细胞核、细胞质和膜等不同细胞室中的蛋白质,这可能会导致新的生物标记物的发现。然而,这项技术存在一些局限性,包括样品制备和数据处理/分析耗时,以及抗体成本较高。
2.8 Hyperion成像系统
Hyperion成像系统是一种抗体导向的IMC平台,具有高度多路复用的成像能力。使用标准染色方法,该系统能够识别与生物样品中蛋白质结合的金属标记抗体。该平台还可以同时量化生物样本中的多达37个蛋白质标记,例如固定组织切片或液体活组织检查。该平台将细胞图谱与空间背景相结合,允许亚群图谱和组织内相邻细胞相互作用的调查。Hyperion是一种结合了激光消融技术和飞行时间(TOF)质谱技术的系统。精确定向的激光束被用来收集浸渍有金属标记的Maxpar抗体的蛋白质标记物。然后使用CyTOF技术引导这些金属标签进行检测。样品首先被烧蚀和雾化。通过氩气和氦气流动,产生的气溶胶羽流被转移到Helios 感应耦合等离子体(ICP)炬。载玻片被放置在消融室的底座上,来自载玻片的图像由照相机捕捉。通过腔体的光学部件,系统发射激光束。激光束聚焦在1μm的光斑上,烧蚀金属标记的抗体染色蛋白,产生气溶胶羽流。羽流是激光束照射到样品载玻片上所产生的物质。这些羽流被引导到Helios ICP火炬,以便在等离子体中蒸发、雾化和电离。最后,TOF质量分析仪使用质量差而不是波长差来测量样品中每个羽流中的每一种同位素的数量,这对应于一次激光发射。
2.9 多路复用离子束成像(MIBI)技术
多路离子束成像(MIBI)技术是在二次离子质谱(SIMS)的基础上发展起来的。SIMS的工作原理是在样品表面对初级离子束进行光栅扫描,然后释放报告离子,然后使用TOF探测逐个像素地记录这些离子。与激光器相比,离子束允许在很大范围内调整分辨率,例如在MIBIScope的情况下,分辨率可调至280 nm到1µm。一旦释放,报告离子就会以超音速从样品到达探测器,从而实现快速采集和卓越的灵敏度。因此,这项技术能够量化蛋白质表达,对免疫浸润进行表型分析,并分析组织结构。MIBI也可以应用于所有常见的样本类型,例如FFPE和新鲜冰冻组织[87]。使用标准的IHC染色方案,用金属标记抗体对组织样本进行染色。也可以在进行高分辨率成像之前获得低分辨率测量扫描。在成像过程中,样本不会被破坏,可以保留以供进一步研究或分析。MIBI生成TIFF图像,可以在MIBItracker中快速轻松地查看这些图像,或将其导出以便在其他软件中进行进一步分析。因此,可以在单个染色和成像步骤中可视化40多个标记。MIBIscope目前被美国国家癌症研究所(NCI)确认为临床试验中唯一的多重成像分析。
| 3.结论 |
为了开发更有效的非小细胞肺癌治疗方法,需要更好地了解与原发和转移性肺癌肿瘤异质性相关的复杂性。空间图谱技术的进步使下一代数字病理学成为可能,揭示了对肿瘤异质性、耐药机制和可能预测治疗结果的潜在生物标记物的新见解。这些进步导致了肿瘤评估的数字化,从评分到可量化的细胞计数,以及具有空间分辨率的细胞表达数据,使得人们能够更深入地了解TME中的细胞参与者、免疫状态和细胞激活。空间图谱技术能够全面分析组织表达、形态和蛋白质或基因表达,以及以往无法获得的对肿瘤的生物学洞察力,从而更好地了解肿瘤与免疫细胞的相互作用。虽然目前的技术大多数可以分解到几个细胞,但我们预计正在开发单个细胞和亚细胞的分辨率。我们预计,这些免费技术的发现可能会导致与非小细胞肺癌免疫治疗反应相关的预测性细胞表型和信号的发展。
图1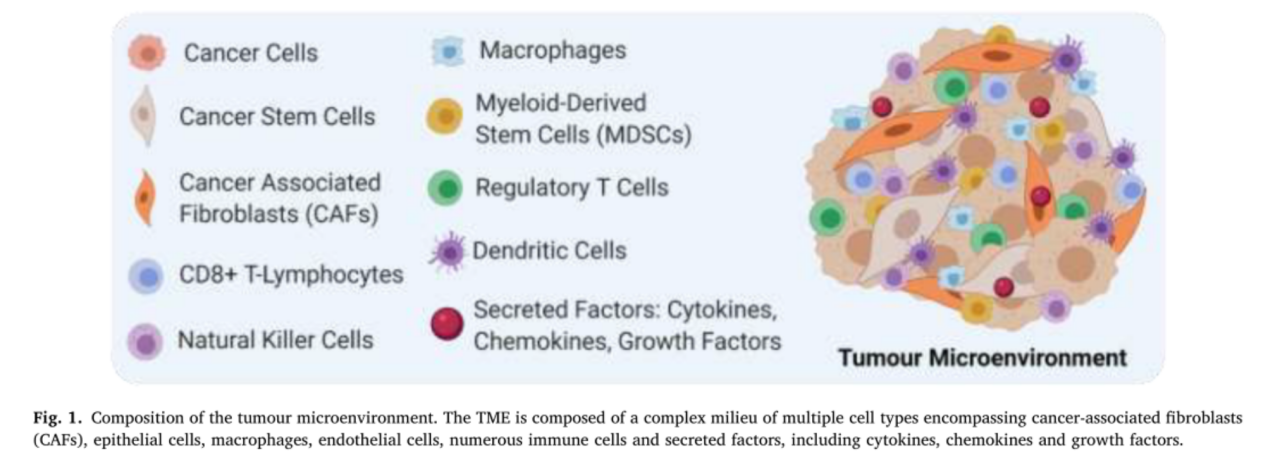
图2
表1.空间转录图谱技术综述。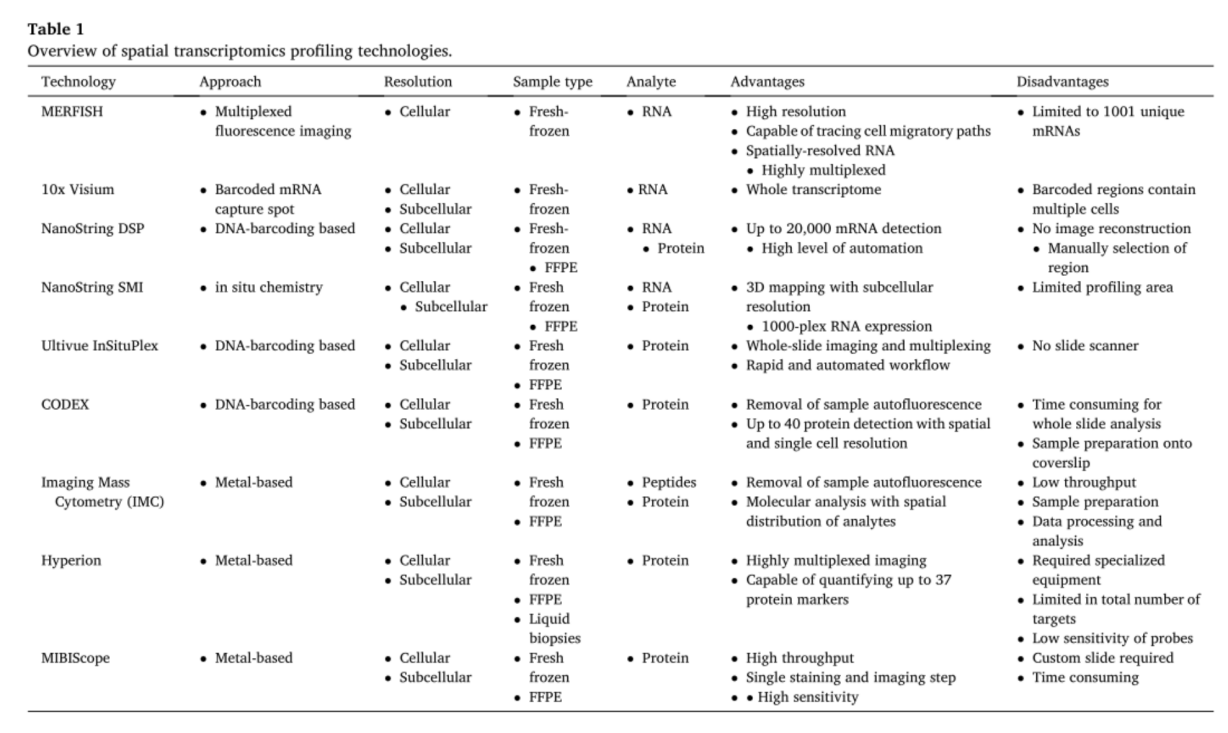
翻译:吴思凯 审校:王子民
原文链接:http://www.xxwk.net/archives/1056