摘要
背景:肺腺癌的分级系统尚未建立。IASLC病理学会评估了一套与预后相关的组织学标准,旨在建立浸润性肺腺癌的分级系统。
设计:进行了一项涉及多个浸润性肺腺癌队列的多机构研究。一组284例I期肺腺癌被用作研究队列,以确定与患者预后相关的组织学特征(无复发生存期(RFS)和总生存期[OS])。采用ROC曲线分析筛选出最佳模型,并在独立队列中进行验证(n=212)和测试(n=300,包括I-III期患者)。用Kappa统计量评估模型的可重复性。
结果:最佳模型(RFS的AUC=0.749,OS的AUC=0.787)是以高级别为主的组织学模式的组合,后者的临界值为20%。该模型包括:1级:以贴壁为主的肿瘤;2级:腺泡或乳头状为主的肿瘤,两者的高级别模式均不超过20%;3级:任何具有20%或以上高级别模式(实体、微乳头和/或复合腺体)的肿瘤。在验证(RFS和OS的AUC值分别为0.732和0.787)和测试队列(RFS和OS的AUC值分别为0.690和0.743)中也看到了类似的结果,证实了模型的预测价值。观察者间一致性良好(k=0.617)。
结论:基于主要和高级别模式的分级系统有助于浸润性肺腺癌预测预后。
引言
肿瘤分级一直是病理学评估的传统组成部分,并为许多器官系统的治疗和患者管理提供指导[1-5]。然而,对于浸润性肺腺癌的分级系统还没有达成共识。2015年世界卫生组织(WHO)对肺腺癌的分类[6]发现与预后相关,并将肺腺癌分为三个预后组,即低级别(以贴壁为主)、中级别(腺泡或乳头为主)和高级别(实性或微乳头为主)组。也有人建议,根据主要模式的分类和分层可以预测辅助化疗的反应[7]。
肺腺癌在组织学上是异质性的,呈现出多种模式和比例的组合。当仅按主要类型分类时,腺泡亚型是最常见的(约占40-50%),预后多样[8-12]。除了五种主要的组织学模式外,肺部还发现了其他几种模式,在其他器官的腺癌中也发现了这种模式[13]。这些类型包括筛状(定义为有筛孔样的肿瘤细胞巢)和融合腺体(定义为形态不佳的融合腺体,无间质,或呈带状结构,边界不规则,单细胞浸润间质)。2015年WHO分类承认肺腺癌中的筛状型,但决定不创建一个新的亚型,而是将其描述为肺腺泡亚型的高级别模式的一部分[6],这些复杂的腺体模式(高级别腺泡)已经发现与高有丝分裂率、肿瘤坏死和淋巴管浸润有关[14,15]。此外,目前的证据一致认为,这些复杂的腺体模式与高级别组织学类型(实性和微乳头状)的预后很差[11,14-19]。然而,由于缺乏对这些模式的认识,可能导致肿瘤分类的不确定性和较差的重复性,因为一些研究人员可能已经将这些模式归类为中级(腺泡)或高度分级(实性)。因此,重要的是要识别这些“非传统模式”,并将它们与常规的腺泡模式分开归类为复杂腺体。
最近的研究建议包括许多其他病理特征,如次级组织学类型[20]、核分级[21-23]、有丝分裂分级[22-24]、是否存在通过气隙扩散(STA)[25-29]和坏死[30,31]列为主要的模式分类,以改进分级方案。所有这些其他的组织学特征都被证明具有预后价值,然而,大多数研究将这些特征作为一个单个参数进行评估,没有考虑到肺腺癌的异质性。目前还没有系统的方法来评估和将多个建议的预后因素纳入分级系统。通过分级系统补充肺腺癌的分类将有助于定义预后人群,并为肺腺癌患者的预后分层提供一条共同的途径,这些患者可能受益于不断变化的管理和治疗方案的变化。
因此,IASLC病理学委员会进行了一项系统的研究,以评估一系列被描述为预后指标的组织学特征,并建立一个已切除的浸润性肺腺癌的分级系统。
材料与方法
研究队列
评估了一项涉及多个明确注释的已切除肺腺癌队列的多机构研究。所有病例均按第8版AJCC癌症分期手册[1]进行分期,并进行至少5年的随访。这项研究包括了四个独立的数据集。每个数据集收集均获得各自机构审查委员会(IRB)的批准。美国数据集是根据HIPPA的规定收集的。
一个由284例I期病例组成的队列(New York University Langone Health, NY, USA)被用作研究队列,用于评估构建分级系统所使用的最佳参数。研究结果在212例I期病例(Massachusetts General Hospital, MA, USA)和另一组300例I-III期病例(Brigham and Women’s Hospital, MA, USA and St Vincent’s Hospital, Melbourne, Australia)中得到验证。表1显示了所有队列的人口统计信息。
组织学评价
研究和验证队列中的病例由提交的病理学家(ALM,MMK)审查,并评估下列组织学参数。测试队列中的案例未专门针对本研究进行审核,因为它们代表了提供者机构(LMS,PAR)的历史集合。
1. 根据当前的WHO肺肿瘤分类[6],在所有研究和验证队列病例中,对所有存在的模式进行半定量估计,并以5%的增量递增进行全面的组织学分型[6]。包括了WHO确定的所有五种模式,以及筛状腺和融合腺(复合腺体模式)等非传统模式,总计100%。图1说明了复杂腺体模式。原位腺癌、微浸润性腺癌、多灶性腺癌、浸润性粘液腺癌(IMA)和其他变异型腺癌均被排除在本研究之外。
2. 核分级的确定如前所述[21-23]。1级:圆形,规则的细胞核,染色质均匀分散,无明显核仁,大小可达淋巴细胞的2-3倍;2级:圆形,轻度不规则,极小的多形核,无明显核仁,大小可达淋巴细胞的2-3倍;3级:多形核,突出的核仁,大于淋巴细胞大小的5倍(补充图1)。
3. 有丝分裂分级如前所述[22,23],即1级:0-1个有丝分裂图/10高倍视野;2级:2-4个有丝分裂图/10高倍视野;3级:≥5个有丝分裂图/10高倍视野。
4. 细胞学分级定义为低级别:细胞多形性低,细胞体积小;高级别:细胞多形性高,细胞体积大(补充图1)。
5. 热点判定:鉴于肺腺癌的异质性,在“热点”(最高级别的区域)记录细胞核分级、有丝分裂分级和细胞学分级,并记录相应的热点组织学模式。
6. 如先前报道[25]所定义的那样,通过空气空间(STAS)传播的肿瘤细胞在主要肿瘤边缘以外的空气中形成微乳头状簇、实体巢或单个细胞。STAS被记录为存在或不存在。
7. 肿瘤内坏死也被记录为存在或不存在。
模型建设
由于主要模式用于腺癌的分类,并按预后分组显示一致的分层,因此主要模式被用作模型的基础。此外,就如何最好地代表组织学特征以实现最佳预后判断,对几种方法进行了评估和比较。组织学模式评估为“加权平均”,即所有模式的比例乘以其复发风险比之和,该比率分别来自于衡量复发时间与主要模式之间的相关性的Cox比例模型的系数得出;“二元模式”,其中组织学模式被视为存在或不存在,但与其比例无关,但根据先前建立的分级分配编号(1:贴壁;2:腺泡/乳头状腺;3:实性、微乳头/复合腺体)和“数字”,其中考虑了该模式的数值比例。
不同的研究已经应用不同的百分比截断值来定义预测不良患者预后所需的高级别模式的量[31-34]。因此,我们试图确定提供最佳区分性能的高级模式的百分比。用Youden‘s指数选择高级别模式百分比的最佳分界值,以获得≥85%的阳性预测值。我们使用复发和死亡作为结果,并比较了两者的临界值。最后,评估其他组织学特征(核分级、有丝分裂分级、细胞学分级、STAS和坏死)的作用。
统计分析
1.模型构建
描述性统计量以连续变量的标准差为均值,以分类变量的频度为比例。两样本t检验和卡方检验比较两组间的连续变量和分类变量。分别计算初诊至首次复发或死亡的无复发生存率(RFS)和总生存率(OS)。最后一次随访的时间用于接受审查的患者。COX比例风险回归用于预测研究队列中的复发情况。候选预测因子是组织学特征和临床特征,包括年龄、性别和病理分期。模型是通过评估每个预测变量的重要性和最小化Akaike的信息标准来选择的。通过回归系数加权的选定模型预测因子的线性组合被定义为风险得分,并应用于队列人群。我们通过确定复发和死亡的受试者工作特征(ROC)曲线下面积(AUC)值来评估预后的识别能力。此外,与AUC相似的一致性指数(C-index)被用来分别表示预测RFS和OS的辨别能力。值为0.5表示该模型没有判别能力,值为1.0表示该模型具有良好的判别能力。采用两侧P值<0.05建立统计学意义。所有数据使用R版本3.5.1进行分析。
2. 生存分析
使用Kaplan-Meier曲线绘制生存曲线,用log-rank检验确定IASLC分级系统和基于模式的OS和RFS主要分级系统中不同等级之间的差异。使用R版本3.6.1对数据进行分析。P<0.05被认为是显著的。
再现性评估
使用Aperio扫描仪(Leica Biosystem)扫描23例含肿瘤的H&E染色切片。5名观察者对整个图像(WSI)进行了远程病理学检查。每例WSI数为1-5张图片。采用Fleissκ统计量测量观察者间一致性的可靠性。评分协议被评估为完全一致或多数一致。总一致性被定义为三个级别的所有观察员之间的一致。多数协议被定义为至少5名观察员中有3名的确切得分协议。协会(协议)强度分类如下:1.00:完全一致;0.80-0.99:几乎完全一致;0.60-0.79:实质性一致;0.40-0.59:中度一致;0.200.39:轻度一致;0.0-0.19:较差一致;<0:无一致[35]。
结果
组织学评估和临床特征-研究队列
主要组织学模式的分布如表1所示。组织学特征(核、细胞学、有丝分裂分级和STAS)与组织学模式和热点评价有很强的相关性。高级核级别、更多的有丝分裂图形和存在STAS与高级别的组织学类型有关,而中低级别的组织学类型主要表现为低或中等有丝分裂率和核级别(p<0.001)(补充图2)。在没有高级别模式成分的肿瘤中未记录到STAS。26例出现坏死,均发生在高级别为主的肿瘤中。低级别细胞学主要表现为贴壁型、腺泡型、乳头型和微乳头型(85%),而实性和复杂腺体型仅占15%。同样,高级别细胞学主要为实性和复杂腺体型(85%),而腺泡型、乳头型和微乳头型中占14%,贴壁型中占1%。
分级模型的构建--组织学模式的作用
补充表1说明了研究队列中组织学特征与复发率的关系。
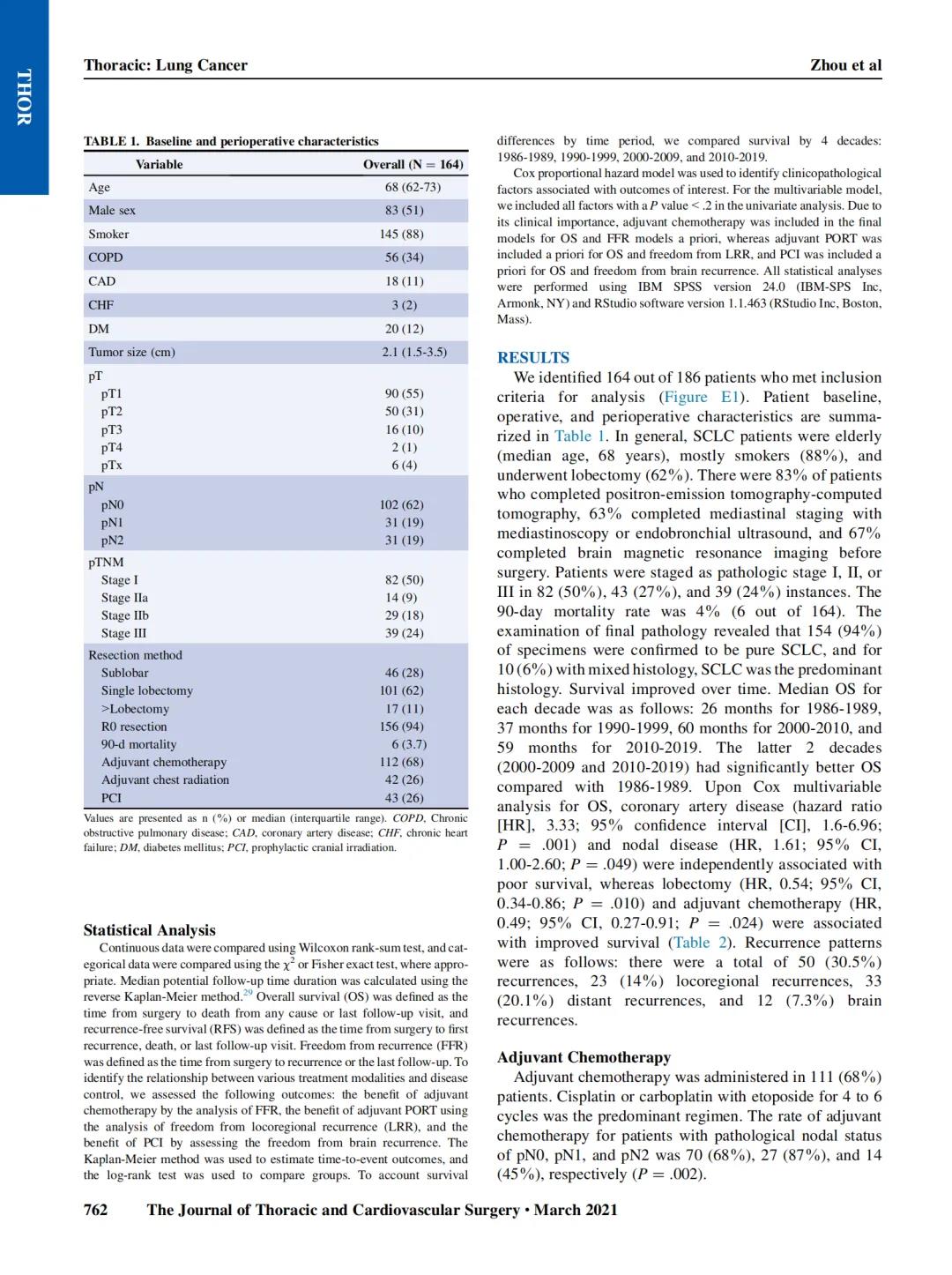
仅具有患者特征(年龄、性别和临床分期)的模型的预后判别能力以复发的AUC值为0.685,死亡的AUC值为0.673来表示。为了改善AUC曲线,增加了组织学特征。这包括仅将主要模式、两个最主要模式的组合、主要模式和高级模式,以及所有模式的加权平均、二进制或数字组合作为变量添加到模型中。结果列于表2。仅将主要模式引入临床特征可改善模型的预后分层,复发和死亡的AUC值分别为0.719和0.729,但曲线的最大增量来自两个最主要模式的组合(RFS的AUC=0.765,OS的AUC=0.760)和主要和高级别模式(AUC值分别为0.749和0.741)。
与两个最主要的或主要+高级模式的组合相比,将所有模式以加权平均或二元模式的形式添加到模型中具有同等的预测性。由于两个表现最好的模型(两个最主要的和最主要+高级别)的AUC差异在统计学上没有差异,因此决定专注于后者,因为对于倾向于根据最差的分化模式进行分级的病理学家来说,这更实用。所有其他可能的组合都未进一步评估。
接下来,我们评估了影响模型性能所需的高级别(实性、微乳头和/或复合腺体)模式的最小百分比。低于10%的临界值是无效的(敏感度100%,特异度0%),10%的临界值导致敏感度为47%,特异度为76%。对于高级别模式,20%的临界值是提供曲线灵敏度和特异度最佳组合的值(分别为64%和68%)。对于高级别模式,应用20%的临界值,复发和死亡的AUC值分别为0.749和0.787。
其次,我们询问其他组织学特征是否可以改进该模型。不同的组织学特征,无论是单独的还是组合的,我们都测试了它们对AUC的影响。所有的组织学特征都没有显著改善新参考模型的AUC(表3)。
根据结果,提出了一种新的分级系统(IASLC分级系统,表4)为:
级别1:高分化腺癌=以贴壁型为主的肿瘤,不具有或少于20%的高级别模式(实性型、微乳头型和/或复杂腺体型)。
级别2:中分化腺癌=以腺泡或乳头型为主的肿瘤,不具有或少于20%的高级别模式。
级别3:低分化=任何具有20%或以上高级别模式的肿瘤
验证集
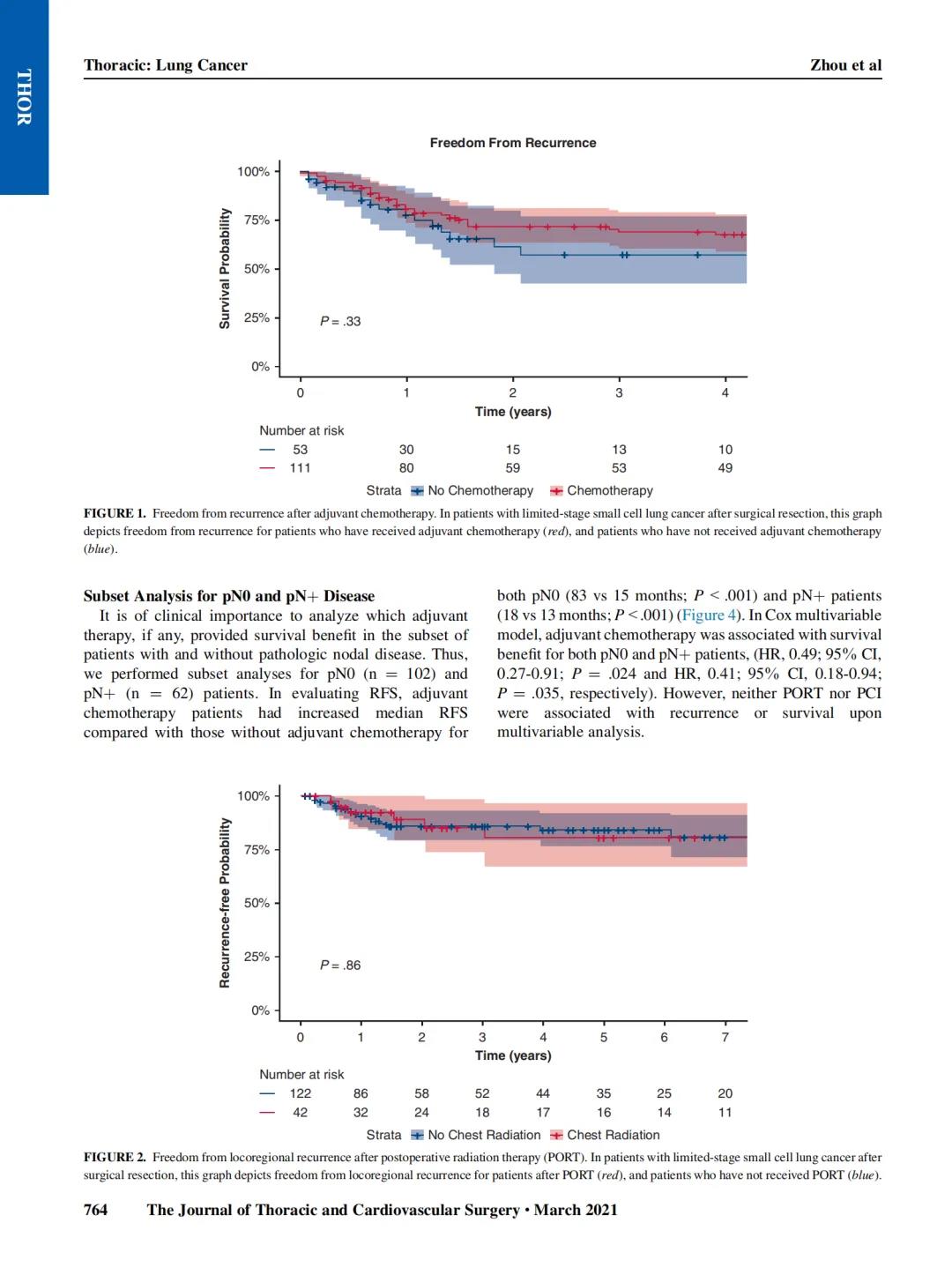
在验证队列中进行了类似的分析,其中中位复发时间为1407(778-1984)天,死亡时间为1995(1772-2225)天。所有组织学参数均与复发有关:主要组织学类型(p=0.05)、核分级(p=0.01)和细胞学分级(p=0.0002)、有丝分裂分级(p=0.004)和存在STAS(p=0.03)(补充表2)。
与研究队列相似,主要+高级别模式的组合(AUC=0.732)是复发的最佳指标。组合或单独添加任何其他组织学特征均未显示出模型的改善(补充表3)。
测试队列
该模型在300例I-III期腺癌队列中进行了测试。在这个队列中,中位复发时间为570天(306-1200天),死亡时间为1195天(660-1998天)。该模型在测试队列中显示出类似的表现,复发的AUC值为0.690(0.629-0.751),C-index为0.704,死亡的AUC值为0.743(0.688-0.797),C-index为0.729(补充表4)。
将IASLC最终模型(表4)的预测能力与测试队列中主要模式分级系统的预测能力进行了比较。无论是在整个队列(I期到III期)和I期队列中,较高的分级与两种分级系统的RFS降低相关;然而,与基于模式的主要分级系统相比,使用IASLC分级系统比主要的基于模式的分级系统在3个级别之间的生存分层更明显(整个队列中p<0.0001 vs. p=0.00013,在I期队列中p=0.0093 vs. p=0.044)(图2)。在OS上看到了类似的表现。在整个和I期队列中,分级越高,两种分级系统的OS越低(整个队列分别为p=0.00011和p<0.0001,I期队列分别为p=0.0053和p=0.011)。
可重复性评估
五名审查员审查了代表23个病例的WSI。审查者间总符合率为52%(12/23),主要符合率为47%(11/23),k值为0.617(SE=0.0478;95%CI=0.5238-0.7095)。大多数的不一致记录在1级和2级之间(6/23,26%),一些审查者将腺泡型腺癌类型归类为贴壁型腺癌,而另一些则将其归类为乳头状腺癌。2级和3级(5/23,22%)的结果不一致主要是由于观察到高级别模式所占比例的差异。综上所述,Fleissκ检验结果基本一致,两组审查者之间几乎完全一致(补充表5)。
讨论
我们的结果表明,基于组织学模式的分级系统是预测浸润性肺腺癌预后的有力指标。考虑到它直接建立在当前的分类系统上,可以很容易地和可重复地应用于实践中。所提出的IASLC分级系统考虑了肿瘤内结构模式的异质性和相对比例,从而为预后人群提供了统一说明,从而为评估肺腺癌的疗效和预后的研究铺平了道路。
根据提议的分级系统,任何≥20%高级别模式的肿瘤都应该被归类为低分化肿瘤,因为这些肿瘤表现出比那些具有主要高级别模式的肿瘤更具侵袭性。所提议的分级系统提供了比仅使用主要模式的预后分组更好的预后分组。
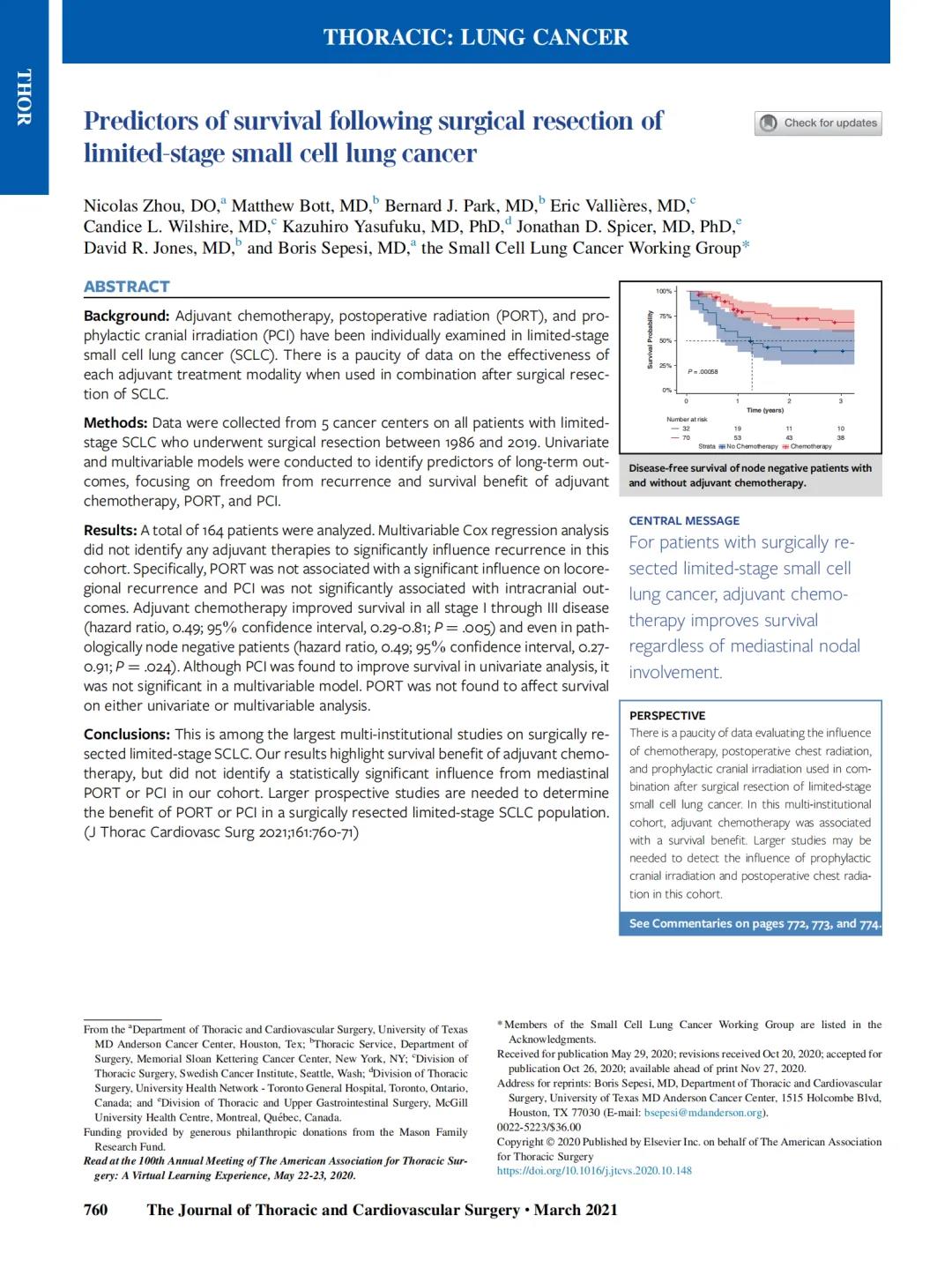
这项研究的优势在于使用了来自不同机构的几个独立的数据集,从而减少了机构和病理学家的偏倚。该模型是使用一个标注良好的数据集创建的,其中测试了几个可能的备选方案,然后在另一个标注良好的数据集中进行了验证,其中对研究数据集中评估的相同参数进行了测试和确认。最终模型在第三个数据集上进行了测试。后者与其他数据集不同,没有为这项研究专门审查,而是代表了贡献机构的历史记录。该模型在所有数据集中表现相似的事实支持了它的可行性。值得注意的是,肿瘤的组织学特征作为预测预后的工具是有限的。在我们的研究中,在所有评估的数据集中,最佳的AUC略高于0.7。在其他出版物中也发现了类似的观察和结果。例如,Sica等人[20]提出了一种基于模式的分级系统,并发现使用一致性概率估计而不是AUC的最佳估计为0.65(95%CI为0.57-0.73)。同样,Liu DH等人[30]提出了一个综合T分期、组织学类型和坏死的模型,该模型的AUC值也达到了0.717。这表明肿瘤的其他非组织学特征可能会增加复发的可预测性。一些研究人员提出了一种基于细胞周期基因表达的分子分级系统来预测I-II期肿瘤的复发[36-38];然而,在这些研究中没有组织学评估的参考。希望将来的研究能够将IASLC分级系统纳入其研究中,以期找出能够改善疾病复发或死亡预测的其他生物标志物。
有趣的是,据报道在预测I期腺癌复发方面具有预后意义的其他组织学特征并未为此处提出的模型增加价值。我们的结果表明,大多数组织学特征,如核和细胞学分级,STATS和有丝分裂分级与主要或非主要的模式组织学类型有关。虽然在这项研究中未评估淋巴浸润,但据报道它与高级别的模式有关[39,40]。同样值得注意的是,提议的分级系统尚未在包括浸润性粘液腺癌在内的各种腺癌变体中得到验证。需要进一步的研究来评估该模型在这些特殊肿瘤中的适用性和性能。
这项研究的另一个重要结论是建立了高级别模式的分界点,因为文献中的许多报告都提供了高级别模式作为复发决定因素的相互矛盾的百分比。在这项研究中,20%的临界值为AUC提供了最佳的敏感性和特异性。值得提到的是,Sica等人提出,与其他组织学类型相比,实性或微乳头型为20%的肿瘤已经具有显著的转移潜能[20]。
在多个病理学家之间进行组织学模式评估的可重复性可能是具有挑战性的[41]。在目前的研究中,我们已经显示出两组审查者(总共10对病理学家)在评估23例kappa值从0.79到0.89(平均kappa值:0.84±0.04)之间的分级几乎完全一致。值得注意的是,大多数不同的分级归因于贴壁性和乳头状型的差异(1级和2级),其次是高级别模式的比例差异。因此,改进贴壁型和浸润性模式的定义可能会提高可重复性[42]。
综上所述,本研究提出了一种新的浸润性肺腺癌分级系统。该分级模型是实用的,并基于模式识别,这使得它可以在常规病理学实践中快速实施,因为它不需要病理学家学习额外的技术。该模型提供了一种新的肺腺癌预后分组,可在来自不同机构的多个数据集中重现。希望这个分级系统能为临床实践中的病理学家和评估腺癌预后和/或预测标记物的研究人员提供一种统一标准,并允许对组织异质性肿瘤进行更全面的比较。最后,这个分级系统并不是要取代目前的肺腺癌分类,而是作为补充。


原文链接:http://www.xxwk.net/archives/1067