摘要
诊断肺神经内分泌肿瘤(NEN)可能是困难的,是一项具有挑战性的临床决策。在这篇综述中,我们讨论了一些关键的临床和病理问题以及信息分子标记:1) 对于根治性切除的低级别nen(类癌),什么是首选的预后参数,例如总生存期或无复发间期? 2)WHO分级结合Ki-67增殖指数和OTP、CD44等分子标志物是否能改善低级别nen的预后? 3)活检标本的典型/不典型类癌诊断在局部和转移疾病中的价值是什么?活检标本诊断困难,最近观察到转移性类癌由典型到不典型和高级别NEN的有丝分裂率增加,可进一步使诊断复杂化。4)大细胞神经内分泌癌(LCNEC)和小细胞癌(SCLC)的形态学分离与分子标志物(RB1/Rb基因/蛋白或转录因子NEUROD1、ASCL1、POU2F3或YAP1(NAPY))预测系统治疗结果的相关性是什么?5)是否需要额外的诊断标准来准确区分活检标本中的LCNEC和非小细胞癌?由于样本量有限,神经内分泌形态学可能会缺失,从而导致漏诊LCNEC。对LCNEC基因组研究和标记物研究的评估表明,Napsin-A和神经内分泌标记物的组合可能会有所帮助。因此,为了改善临床实践,我们应该考虑调整我们的NEN分类,纳入适用于活检标本的预后和预测标记物,以告知治疗结果。
引言
在现行的世界卫生组织(WHO)2021分类(第五版)中,肺神经内分泌肿瘤(NENS)包括四种肺肿瘤类型,它们具有一些形态学和蛋白表达的免疫组织化学(IHC)特征。但具有不同的生物学行为:典型类癌(TC)是生长缓慢的低度恶性肿瘤,很少转移;非典型类癌(AC)是中等生长和中度恶性肿瘤;大细胞神经内分泌癌(LCNEC)和小细胞肺癌(SCLC)是高度恶性、快速生长和转移的恶性肿瘤。在所有肺癌中,TC(1-2%)、AC(0.2%)和LCNEC(1-3%)的发病率呈上升趋势,而小细胞肺癌(SCLC)的发病率则呈下降趋势(13%)。由于这种低发病率,类癌和LCNEC被称为孤儿病。
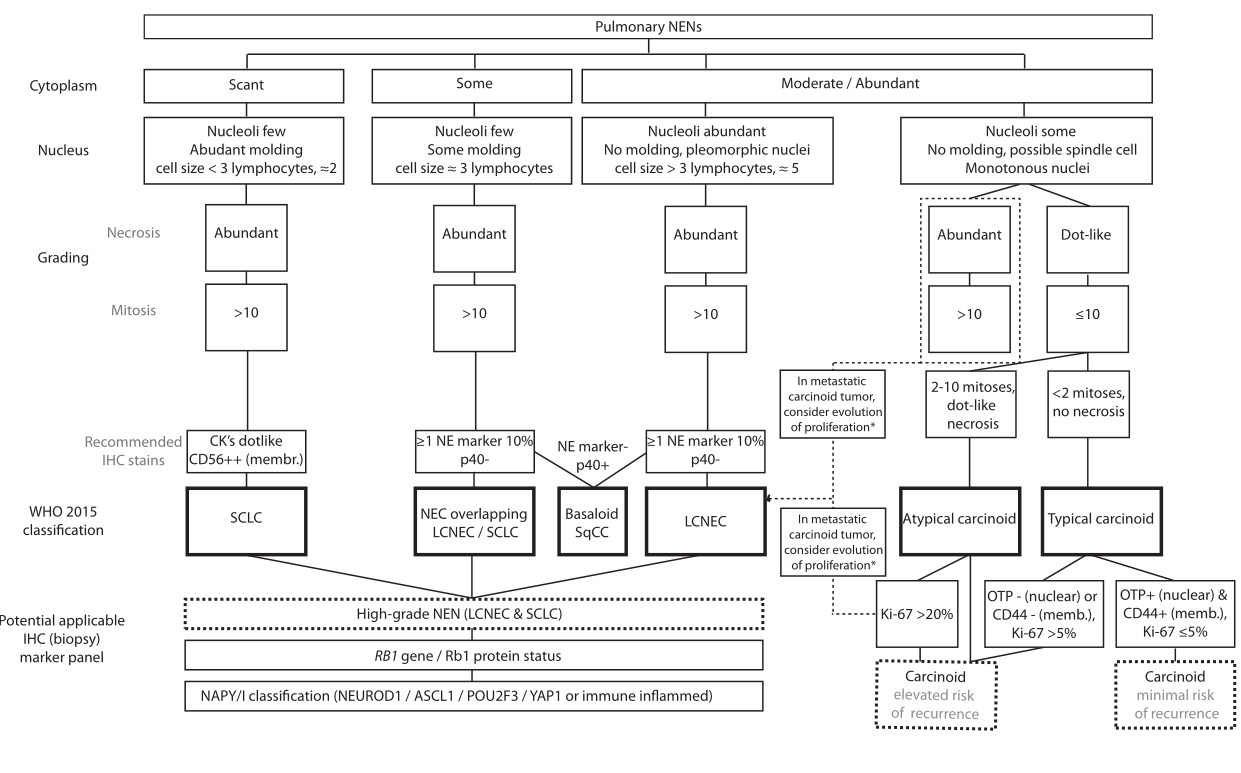
目前用于肺nen的诊断算法是基于20世纪90年代早期鉴别LCNEC的形态学标准,以及更早鉴别类癌和SCLC的形态学标准。虽然已知这些标准有一些局限性,但自1999年采用世界卫生组织第三版分类以来,诊断算法基本上没有改变。因此,应用目前的WHO分类可能导致重要的临床难题。在这篇综述中,我们重点讨论了五种这样的临床-病理困境及其潜在原因,并讨论了使用(联合)潜在的分子标记物来解决这些临床需求,以求更好的患者管理(如图1所示)。
问题一:对于根治性切除的低级别nen(类癌),首选的预后参数是什么?
通过对死亡率不同的预后亚组的分析,建立了WHO 2021肺NEN分类。解剖切除局部病变后,TC患者5年和10年的中位总生存率(OS)分别约为94%(研究的中位数,范围为83-100%)和89%(范围60-100%),而无病生存率(DFS)分别为95%(83-100%)和90%(73-95%)。AC OS分别为76%(50-92%)和51%(38-74%),DFS分别为67%(44-87%)和45%(24-71%)。远处疾病复发发生在1-6%的TC患者和14-29%的AC患者。此外,临床预测复发的因素还有淋巴管受累和肿瘤大小。欧洲神经内分泌肿瘤协会(ENETS)建议对所有类癌患者进行长达15年的长期随访,而北美神经内分泌肿瘤协会(NANETS)建议对所有AC患者进行长期随访,仅对患有N1-3的TC患者或肿瘤>3 cm、肿瘤切缘接近或肿瘤多灶性的患者进行长期随访。重要的是,虽然罕见,但即使是早期(I-II)TC也可能随着时间的推移而出现远处疾病的复发。在低级别NENS中,OS和DFS之间仅有轻微差异,因为两种生存定义都包括死亡(任何原因)作为事件,另外DFS还包括局部/远程复发。然而,复发并不常见,大多数患者死于其他原因。因此,为了获得最具临床相关性的信息,术后低度恶性肿瘤(类癌)的分类应主要根据无复发间隔(RFi)将诊断亚组分开,无复发间隔(RFi)将复发而非死亡定义为一个事件。另一种方法是使用竞争风险分析,因为这种方法特别适合于长期随访中发生的罕见事件。这种方法可以应用于排除长期随访中复发风险低的所有患者。
问题二:WHO分级结合Ki-67增殖指数和分子标志物是否能提高低级别nen(类癌)的预后预测?
先前的研究之所以可能在早期发现在术后会出现远处疾病复发的TC患者,其中一个原因是这种肿瘤很可能是非典型的,但最初并没有被识别出来。使用世界卫生组织2021标准对手术标本的典型与AC的观察者间变异范围从中度kappa为0.60-0.76(符合3/5病理学家,n=20类癌)到最小符合值kappa为0.32(5/5病理学家,n=114类癌)。仅使用有丝分裂计数(不包括坏死)的评估再次显示中位数kappa仅为0.21。AC的分类尤其困难,因为在诊断谱的一端与TC频繁重叠,而在另一端与LCNEC/SCLC重叠。有丝分裂在HE切片上的分布不均,区分有丝分裂图形与凋亡小体和固缩核的标准不同,可能会阻碍对有丝分裂的识别。此外,典型与AC的观察者间差异受逐步分类所需的较低有丝分裂频率的强烈影响,因此每一次计数都是必不可少的。因此,迫切需要额外的工具来评估预后和改善观察者间的差异。
对核蛋白MIB-1/Ki-67的IHC表达的评估为病理学家提供了一个除了形态学参数之外的辅助工具,该蛋白由处于细胞周期活跃期的细胞上调。在2014年的综述中,广泛讨论了Ki-67分级在肺癌中的作用,平均Ki-67增殖指数(PI)在TC中为2-4%,在AC中为9-18%。一些研究表明,Ki-67PI在多因素分析中除了世卫组织目前的分类外,还具有更高的预后价值,而其他研究则没有。两项关于无复发生存率的研究表明,在TC或(任何)AC诊断中,Ki-67PI分界值>5%是(局部)复发的预测因子。有丝分裂数(<2,>2-47和>47)与坏死率(无,<10%和>10%)和Ki-67PI(<4%,>4-<25%和>25%)相结合的三级分级系统显示不同亚组之间预后的显著差异。不幸的是,疾病复发和观察者间变异的预后价值并未被探讨。然而,使用这样的分级方案可能会让病理学家更好地区分AC和LCNEC诊断交界处的病例。
有几种技术可以用来评估Ki-67PI。与数字计数相比,眼球法在病理学家之间的观察者间变异较小,而人工(2000个细胞)提供了与数字计数类似的结果。当比较肺部NEN配对活检-切除标本时,数字分析(2000个细胞)提供了与评估2mm2肿瘤组织、整个活检或包括热点区域的2000个细胞相当的结果。活检标本上热点的单一应用显示出比相关切除标本更低的Ki-67 PI。最近的NEN世卫组织共识小组建议在0.4mm2的热点上评估Ki-67。
在世卫组织2021年分类中,Ki-67 PI的测定在肺NENs分级中没有诊断作用,因为有报道称分离典型和AC的临界值重叠,并且观察到Ki-67 PI和有丝分裂分级之间的共线性。尽管如此,ENETS和NANETS指南建议在手术和活检标本中始终包含Ki-67 PI,因为这可能提供超出世卫组织标准的额外预后信息。
近年来有几项研究评估了类癌疾病的分子特征。对肺神经内分泌肿瘤进行了广泛的概述。重要的是,在肺类癌中没有发现驱动突变。最常见的分子畸变是多发性内分泌肿瘤1型(Men-1)基因的突变(5%),这与较差的预后有关。少数复发和未复发类癌的基因表达分析证实了染色体重排,并发现标记met、tes和stk39在复发病例中高度上调,尽管这些基因尚未得到证实。
基于基因和蛋白质表达谱,转录因子正介同源盒基因(OTP)被认为是区分侵袭性和非侵袭性肺类癌的一种推定分子标记。除了前列腺和卵巢的偶发性NENs外,OTP蛋白在肺类癌中几乎是唯一表达的。相比之下,OTP在SCLC和LCNEC中很少表达,RNA测序数据的机器学习分析显示,组织病理学分类中OTP水平高的SCLC/LCNEC被重新分类为类癌。细胞核OTP IHC染色结合膜CD44染色,是一种参与细胞间相互作用的细胞表面糖蛋白,是无复发生存率的有力预测指标,在诊断不一致的病例中有价值。对类癌的多重组学分析预测,OTP是区分三个不同队列的类癌的一个独特亚类。低OTP表达与MEN1基因突变相关,这在一个独立的类癌队列中得到证实。由于针对OTP蛋白的抗体目前只能作为多克隆抗体用于IHC染色(HPA039365和HPA059342,Atlas抗体),进一步的研究需要开发和诊断出稳定的单克隆抗体。图2A显示了Ki-67和OTP/CD44蛋白染色的典型病例,图3显示了它们在诊断方法中的潜在应用的流程图。
问题三:活检标本上的典型/非典型类癌诊断对局部和转移性疾病有什么价值?
与传统建议的肺叶切除术或全肺切除术相比,低级别神经内分泌肿瘤的一个重要临床问题是,最近的外科趋势倾向于保留实质的切除术(如肺段切除术),因为它可以降低发病率。典型类癌可以考虑采用伴有系统淋巴结清扫的肺段切除术。对于AC,可以获得的数据稀缺,一些数据表明OS较低,局部复发率较高(楔形和肺段切除术)。然而,为了确定手术类型,需要在术前诊断准确性上明确区分典型/AC。
评估世界卫生组织2021肺类癌活检标本标准准确性的研究很少。两项关于肺神经内分泌肿瘤的研究表明,活检中有丝分裂数和坏死的存在可能被低估。我们和其他人已经表明,活检标本诊断类癌缺乏诊断准确性。在肺神经内分泌肿瘤活检标本配对分析中(n=48),以Ki-67PI>20%为界值,可100%区分低级别(类癌)和高级别(类癌)肿瘤。然而,Ki-67PI不能用于分离典型/不典型类癌。此外,在LCNEC Ki-67中,PI可能<20%,在分析较老的组织样本时建议谨慎。因此,世界卫生组织2021年建议将未切除标本中的类癌诊断为“未作特殊规定的类癌”。因此,术前活检诊断通常不足以支持手术范围的确定。到目前为止,成像技术和基于血液的标记似乎没有额外的帮助,需要为此目的进行进一步的评估。因此,临床医生需要更多的术前工具来帮助识别先验预测RFI高的患者,这些患者可能受益于保留实质的切除术。特别是在此,可应用于活检的分子标记,如Ki-67PI、OTP和CD44的组合,可能会有所帮助。
具有9个有丝分裂/2mm 2的肺NEN被分类为AC,而具有相似形态但具有12个有丝分裂/2mm 2的肿瘤目前属于高级别LCNEC/SCLC。由此产生的分类差异可能导致不同的全身治疗(例如,依维莫司vs铂-依托泊苷化疗),尽管这些肿瘤的基础生物学很可能相当相似。这一观点得到了最近一些研究的支持,这些研究基于对原发性和转移性类癌的增殖率(即高Ki-67PI(>20%)或有丝分裂>10/2mm2)的评估,以及对基因组变化的评估,观察了类癌向高级别NEN的时间演变。此外,LCNEC的形态特征与类癌相似,但增殖率较高(>10个有丝分裂/2mm2)。分子研究表明,这些肿瘤更有可能表现为类癌,而不是“真正的”LCNEC,尽管可能存在一个单独的AC-LCNEC簇。关于增殖率增加的类癌的术后结果,有报道称远处疾病复发的频率相对较高,而且与LCNEC相比,OS略长,具有可比性。因此,在手术治疗局部疾病的情况下,除了更频繁的随访外,这一分类的附加价值似乎有限。
对于转移性类癌和具有类癌形态的LCNEC,观察随时间递增的Ki-67PI可能支持一种不同的治疗方法。在转移性疾病中,从语义上区分典型和AC可能不那么重要,但仍然需要将(分子)类癌特征与系统治疗的反应联系起来。最近描述了一种使用Ki-67PI作为治疗分层的方法(Ki-67PI<10%可用生长抑素类似物,Ki-67PI>10%但<20%可用mTOR抑制剂/肽受体放射核苷酸治疗(PRRT),Ki-67PI>20%可用化疗方案)。到目前为止,一项回顾性研究评估了增殖增加(有丝分裂>10或Ki-67PI>20%)的转移性类癌的疗效,结果表明,这些肿瘤对依维莫司和PRRT也有反应,但对铂-依托泊苷的反应较小。解释治疗后活检标本时应谨慎,因为治疗可能会错误地导致Ki-67PI值降低。国家综合癌症网络(NCCN)指南建议根据形态学分级(即典型与非典型)来确定类癌的系统治疗,尽管前面提到了将WHO标准应用于活检标本时的诊断警告。ESMO指南包括形态学分级和“临床进展缓慢与快速进展的类癌”,而ENETS/NANETS建议根据形态学分级结合“低增殖指数与高增殖指数”进行分类,但不提供明确的界限。因此,基于Ki-67PI的治疗策略需要前瞻性的验证,并需要包括先前与类癌治疗反应相关的其他标记物。例如生长抑素受体2型(SSTR2),其表达与PRRT的反应相关,以及pRb和p53。
问题四:从形态学上区分LCNEC和SCLC的相关性以及分子标志物预测治疗结果的价值是什么?
世卫组织2021年分类基于外科切除标本的形态学评估,将高级别NENs分为LCNEC和SCLC。然而,将LCNEC和SCLC分开的必要性可能存在争议。考虑到在大多数新诊断的患者中,这些具有播散性肿瘤的侵袭性,临床医生和病理学家通常需要在活检或细胞学标本上建立诊断。描述LCNEC的初始报告中没有提供支持LCNEC与SCLC分离的预后或治疗差异。尽管如此,还是观察到了一些重要的不同之处。一般来说,LCNEC更多地被认为是模仿非小细胞肺癌的局部疾病。因此,与小细胞肺癌相比,LCNEC可能更常接受根治性手术治疗。在人群基础上,这导致LCNEC相对于SCLC的OS较长,尽管并不是在所有的研究中都发现这一点,而且LCNEC和SCLC的OS在最近的一项比较辅助化疗的III期试验中是相似的。在III期非小细胞肺癌(不能手术)中,同步放化疗是辅助免疫治疗(Duvalumab)的标准治疗方案,对于小细胞肺癌限制性疾病,同步放化疗联合预防性头颅照射(Pci)是有效后的标准治疗方案。到目前为止,III期(不能手术)LCNEC疾病的最佳治疗尚不清楚,可以给予或不使用PCI的放化疗,并且Durvalumab的作用还存在争议。在Ⅳ期,LCNEC的OS与SCLC相似。然而,与小细胞肺癌相比,LCNEC似乎对化疗的敏感性较低,因此对LCNEC的化疗方案也有不同的建议。铂-依托泊苷(SCLC)化疗方案和铂-紫杉烷/吉西他滨(NSCLC)方案均被认为是合适的化疗方案。已有研究表明PD-L1在LCNEC和SCLC中低表达。在小细胞肺癌中,一线免疫疗法联合铂-依托泊苷对OS有温和但显著的益处,是治疗的标准。关于LCNEC免疫治疗的研究很少,已有三个回顾性系列报道显示反应温和,需要进一步评估。
不幸的是,在过去的十年中,只有三个评估系统治疗的LCNEC特异性临床试验被报道。造成这一现象的主要原因是患者收益低和病理修正后的失败率高。后者可能是由于采用现行标准对活检标本进行的LCNEC的复杂诊断所致。
区分LCNEC和SCLC的困难众所周知,kappa评分平均在0.4左右,这是由于重要的观察者间差异和生物学相似性造成的。形态计量学分析显示,SCLC和LCNEC的细胞大小有显著重叠,这表明至少有一个区分这些实体的重要标准(即细胞大小)在某种程度上是任意的。此外,小细胞肺癌的细胞学特征在更大的组织样本中可能是异质性的;因此,小细胞肺癌的部分细胞可能具有更大的细胞尺寸,并且一些小细胞肺癌合并非小细胞癌,从而使评估变得复杂。考虑到上述临床病理问题,使用目前的WHO诊断标准对LCNEC和SCLC进行纯粹的形态学分离似乎不能提供一个可重复的和临床相关的分类,特别是在应用于活检标本时。根据分子亚型的最新发现,结合经典形态学特征对高级别NEN进行分类,可能会提供一种临床相关的解决方案。
对SCLC和LCNEC的基因组和转录组分析也表明与TP53和RB1的共同(双等位)失活有重要的重叠,就像最近综述的那样。在LCNEC中,RB1/TP53失活的SCLC亚型具有低神经内分泌基因表达谱,低ASCL1和高Noch基因表达(称为IILCNEC型)。约40%的LCNEC具有非小细胞肺癌常见的分子改变(即KRAS/STK11/Keap1突变),ASCL1和神经内分泌标志物(称为I-LCNEC)高表达。有趣是,这些I-LCNEC通常有一个功能正常的野生型RB1基因。在高级别NENs中,不同的化疗反应与RB1基因状态相关,但并不是所有的研究都是如此。Rb1基因的野生型状态以及pRb蛋白在LCNEC中的表达与NSCLC常用的化疗方案(即铂-吉西他滨/紫杉烷)的疗效相对较好有关,而另有报道具有RB1突变(即SCLC型)的LCNEC可能对铂类药物更敏感。Rb1野生型高级别Nens可能对CDK4-6抑制治疗敏感,因为CDK4/6在这些肿瘤中高表达,通过抑制将导致活跃的pRb。然而,这一假设需要在体内肿瘤模型和临床试验上进行验证。Rb蛋白(未磷酸化)可以通过单克隆抗体(如4H1细胞信号、13A10徕卡生物系统、3C8 GeneTex)的IHC染色进行简单的评估,也适用于活检标本的评估。Rb在小细胞肺癌中的保留表达率约为10%(0-23),而在LCNEC中的保留表达率为35%(28-56)
最近,基于广泛的转录图谱鉴定了主要调控基因NEUROD1、ASCL1、POU2F3和YAP1(Napy),对小细胞肺癌进行了分子分类。这些子类型可以实现个性化治疗。大多数小细胞肺癌受ASCL1、NEUROD1或ASCL1/NEUROD1联合调控,神经内分泌基因(INSM1、CHGA和SYN)高表达。在蛋白质水平上,对napy分类的评估似乎更为复杂。在(联合)SCLC肿瘤中,69%为ASCL1显性,17%为NEUROD1显性,7%为POU2F3显性,所有标志物均为阴性,未发现独特的YAP1亚型。对于ASCL1驱动的SCLC,最相关的亚型特异性治疗是DLL3受体靶向治疗,其开发I期试验正在进行中(NCT03319940和NCT03392064)。NeUROD1亚型的特征是MYC基因的过度表达,对MYC IHC表达的探索性评估预示着用Aurora激酶A抑制剂治疗的复发小细胞肺癌的无进展生存率得到改善。少发的POU2F3和YAP1驱动的小细胞肺癌似乎神经内分泌基因表达较低。POU2F3调节的SCLC可能对需要进一步评估的Aurora激酶A和PARP抑制剂等敏感。Rb1野生型SCLC与YAP1的表达相关,两者均与化疗反应差有关。YAP1还与一种免疫炎症亚型相关,该亚型可能受益于免疫治疗。因此,YAP1的值是不清楚的,因此这个亚型的炎性(I,Napi)而不是(Y,Napy)的名称可能更准确。重要的是,小细胞肺癌的这些‘Napy/I’亚型可能表现出部分由ASCL1向NEUROD1和/或YAP1/炎症亚型转变的动态转变(空间和时间)。我们有兴趣进一步研究Napy分类是否也适用于具有临床意义的LCNEC。
最终,基于分子特征(即,pRb/napy(或napi)状态)的IHC分类可能使与活检的特定治疗敏感性相关的转移性高级别NEN的分类成为可能(图2B)。这种方法将克服在评估高级别NEN活检标本时遇到的一个主要的临床病理诊断问题。
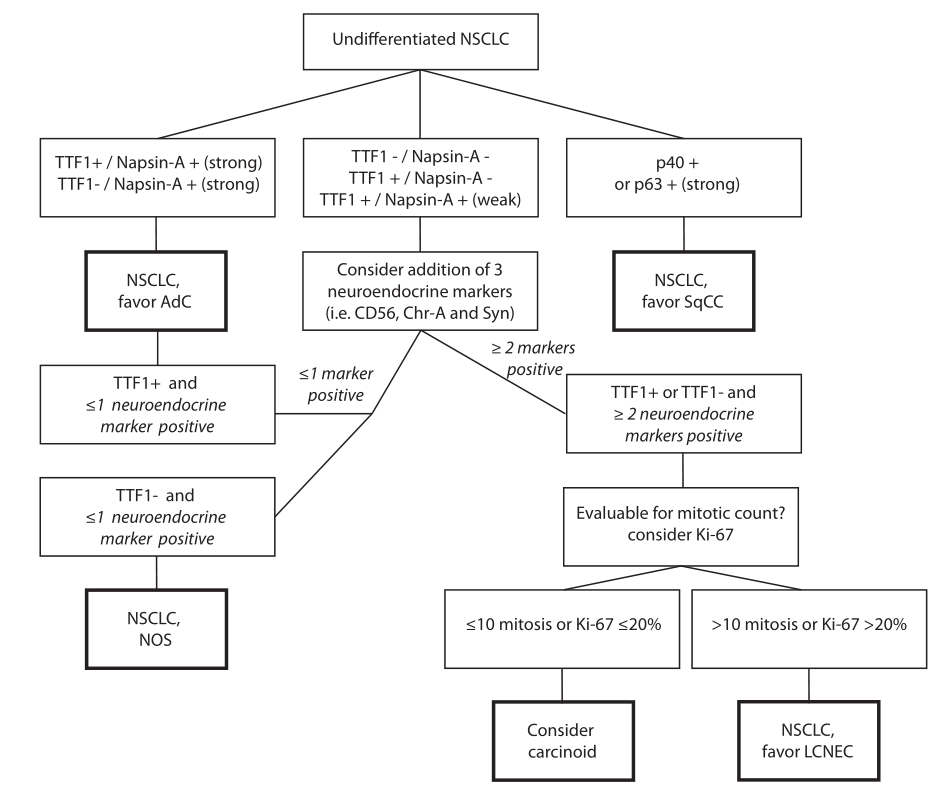
问题五:是否需要额外的诊断标准来准确区分活检标本中的LCNEC和NSCLC?
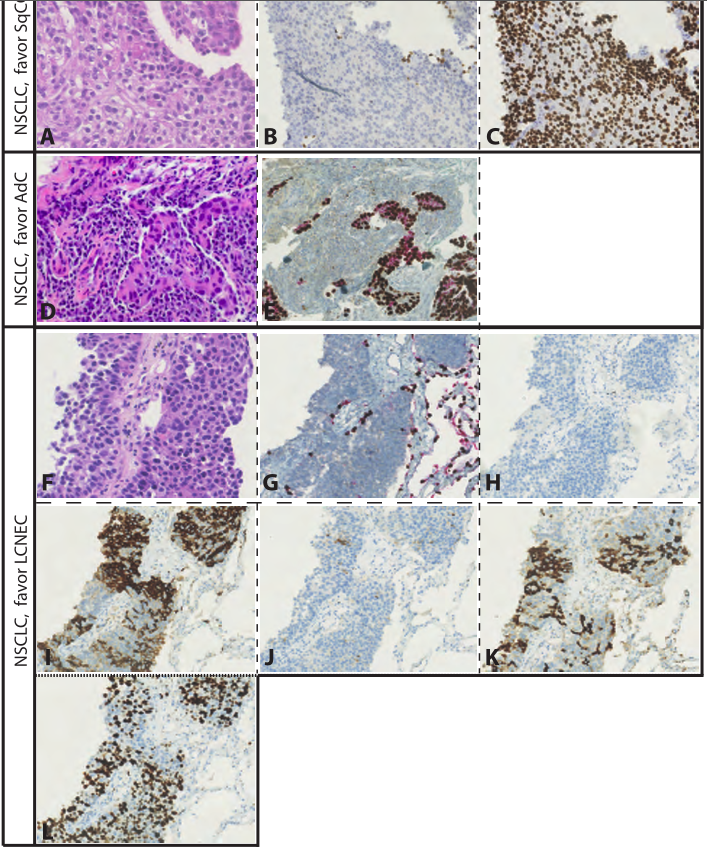
从临床角度看,将局部晚期和转移性非小细胞肺癌与LCNEC分开是很重要的,因为(1)杜伐单抗/培溴利珠单抗的治疗效果尚不清楚,(2)与LCNEC相比,NSCLC有更多的驱动突变,(3)NSCLC预后更好,(4)NSCLC和LCNEC有不同的系统治疗策略(即培美曲塞可能不适用于LCNEC,而依托泊苷可能更适合于LCNEC)。在细胞质丰富、核仁明显的肿瘤中,神经内分泌形态学是区分LCNEC和NSCLC的关键,因为LCNEC和NSCLC都能高频率表达TTF-1。神经内分泌形态学是外科切除标本诊断的合适标准,但不适用于活检标本,正如前面强调的那样,导致LCNEC被误认为非小细胞肺癌的比例高达50%。
采用组织芯片(TMA)作为活检标本的替代模型,对NSCLC与LCNEC的分离进行了评价。以下各项标准各为1分:有丝分裂> 10/2mm 2,Ki-67 PI >40%,存在坏死、外周栅栏化、器官样嵌套或存在玫瑰花结,一种或多种阳性神经内分泌标记物染色为3分,≥5被鉴定为LCNEC,具有99%特异性和83%敏感性。使用WHO 2021标准对手术证实的LCNEC的配对活检进行评估显示,增加了神经内分泌分化的替代标记物。根据世界卫生组织2021标准对经手术证实的LCNEC活检组织进行评估,结果显示,增加神经内分泌分化的替代标记物(即≥2标准神经内分泌标记物染色)可将LCNEC的敏感度从43%提高到93%。在LCNEC/NSCLC TMA上的验证显示,敏感性为80%,特异性为99%。这些观察结果使先前的研究结果复杂化,这些发现表明神经内分泌分化在非小细胞肺癌中没有作用,因为这没有预后价值。在非小细胞肺癌中,单一神经内分泌标志物的焦点染色很常见(8-33%)。≥-2神经内分泌标记物在非小细胞肺癌切除标本中的阳性表达率仅为1-4%。相比之下,LCNEC中≥2神经内分泌标志物的阳性表达率为85%,3个标志物的阳性表达率>50%。
除了神经内分泌标记物外,IHC对Napsin A的研究可能提供一个相关的诊断标记物来区分LCNEC和腺癌,因为只有6%(0-15)的LCNEC表达该标记物,而腺癌的表达率为85%(65-88)。在活检标本诊断为TTF-1阳性、形态未分化的非小细胞肺癌中,Napsin-A染色阴性或微弱,并伴有神经内分泌标记物染色,可高度提示LCNEC。在图4中,我们提出了一种诊断算法,在活检标本上实现上述IHC标记,以区分NSCLC和LCNEC。最近对LCNEC诊断中其他已知的重叠难题进行了很好的回顾,因此这里不再讨论。
总结
考虑到越来越多的临床需要在有限的组织标本上建立诊断,我们对肺神经内分泌系统分子生物学的知识不断扩展,以及越来越多的系统治疗选择,我们必须设想一种与治疗结果相关并适用于活检标本的分类。
问题一,对于手术治疗的低级别nen(类癌),根据无复发间隔建立的调整分类是最相关的,该分类可以识别那些可能受益于保留实质切除和缩短随访时间的低复发风险患者。
问题二,肺nen的预后优化可能通过(联合)预后IHC标记物KI-67、OTP和CD44来实现,作为目前世卫组织分类的补充,有待进一步的独立验证。
问题三,有报道称AC与高分化nen重叠,诊断标准如有丝分裂指数可能显示转移性类癌的时间增加。重要的是,在局部疾病中,这些患者的治疗结果没有显示出相关差异。它与转移性疾病患者和治疗反应的相关性似乎是可能的,但由于缺乏数据,目前仍不清楚。此外,还需要一些能够将类癌亚型与系统治疗反应联系起来的活检标本标记物,目前潜在的候选标记物是Ki-67、SSRT2、OTP/CD44、pRb和p53免疫组化染色。
问题四,为了有效克服LCNEC和SCLC的诊断重叠,我们可能需要将高级别NEN归类为单一实体,并应用与系统治疗反应相关的分子(转录)谱(即RB1和‘Napy’/炎症亚型)。以研究个体化治疗方案为重点的临床试验可能会在不久的将来实现这样的分类算法,这些方案在统计学上有足够的动力,可以同时包括LCNEC和SCLC组织学。
问题五,最后,为了减少活检标本中LCNEC和非神经内分泌NSCLC的临床重要诊断重叠,由TTF1、Napsin-A和p40组成的IHC小组,然后是嗜铬粒蛋白-A、突触素和CD56仍然有效。
以上提出的所有标记物,以及它们在日常外科病理学实践中的潜在应用,都是有希望的,但需要进一步的前瞻性验证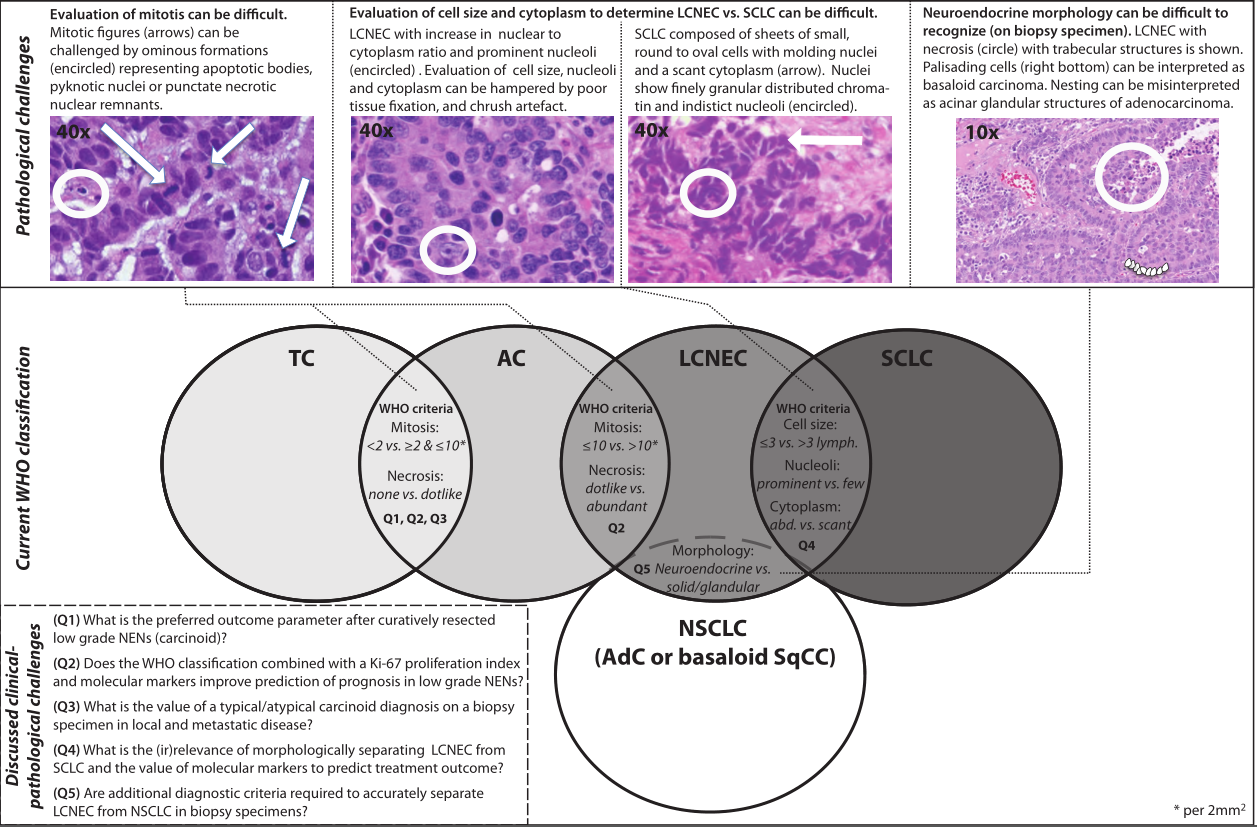

翻译及校审:李佳威、朱康浩
原文链接:http://www.xxwk.net/archives/1086