目的:分析既往接受过新辅助治疗后进行根治性切除的食管癌患者,以确定额外的辅助治疗是否与改善生存结果相关。
摘要背景数据:新辅助治疗后手术是局部晚期食管癌的标准治疗,而辅助治疗通常用于有残留病灶的患者。然而,治愈性切除术后辅助治疗的作用仍不确定。
方法:检索 MEDLINE、EMBASE 和 CENTRAL 数据库中比较食管癌患者接受新辅助治疗和根治性切除加和不加辅助治疗的研究。主要结果是总生存期(OS),并在适当情况下进行了随机效应荟萃分析。推荐分级、评估、发展和评价用于评估证据的确定性。
结果:共纳入10项研究,涉及6462名患者。与单纯接受新辅助治疗和食道切除术的患者相比,辅助治疗组1年后死亡率显著降低48%(RR0.52,95%CI0.41~0.65,P<0.001,中度确定性)。死亡率的下降持续到5年随访(RR0.91,95%CI0.86-0.96,P<0.001,中度确定性)。关于次要结果,辅助治疗和对照组之间的差异是不确定的。
结论:新辅助治疗和切除切缘为负的食管切除术后的辅助治疗在1和5年提供了改善的OS,证据具有中等到高度的确定性,但由于对这些结果的报道有限,对无病生存和局部/远端复发的益处仍不确定。
小摘要
虽然手术后新辅助治疗是食管癌治疗的标准,但辅助治疗的作用尚不确定。这篇综述的目的是分析以前接受过新辅助治疗然后进行根治性切除的食管癌患者,以确定额外的辅助治疗是否与改善生存结果有关。
引 文
食管癌是世界上第八种最常见的癌症,发病率一直在迅速上升。食管癌的两个主要亚型是鳞状细胞癌(SCC)和腺癌,合计占所有病例的90%以上。随着其发病率的增加,多年来人们探索了各种治疗方案。由于单纯手术预后不佳,多模式治疗已成为局部晚期食管癌治疗的标准护理方法,并可带来生存益处。然而,这些多模式治疗也可能伴随并发症风险和生活质量下降,因此应根据疾病严重程度、多学科病例讨论和患者喜好谨慎推荐给患者。
自从CROSS(食道癌放化疗后手术研究)试验显示新辅助治疗对生存期有显著好处以来,II和III期食管癌的治疗标准包括先进行新辅助放化疗,然后进行手术切除。因此,北美的实践模式通常包括对新辅助治疗有反应的患者进行手术治疗。相比之下,亚洲国家在历史上表现出一些偏差,其中几个中心倾向于先进行手术再进行辅助治疗。日本最初实施这种方法是因为日本临床肿瘤学集团(JCOG)9204研究的结果。然而,在最近的JCOG 9907试验之后,新辅助化疗和手术成为他们对临床II期和III期食道癌的标准护理。
虽然食管癌新辅助治疗的使用已被广泛接受,但辅助治疗的作用仍然相对不确定。辅助治疗的适应症高度依赖于机构和患者,关于这一主题的指南或随机证据数量有限。通常,辅助治疗被考虑用于最初接受手术但后来被发现患有更晚期疾病(如淋巴结阳性或切除切缘阳性)的患者。最近,基于Checkmate 577的辅助治疗表明,nivolumab可使无病生存时间显著增加一倍,国家综合护理网络指南已被修改,FDA于5月20日批准了这项试验。考虑到辅助治疗在这一亚组患者中益处的不确定性,本系统回顾和荟萃分析旨在分析以前接受过新辅助治疗和根治性食道切除术的患者,以确定与附加辅助治疗相关的生存结果。
方 法
搜索策略
我们搜索了从数据库开始到2020年9月期间的以下数据库:Medline、EMBASE和CENTER。这项搜索是由一名医学图书馆员设计并进行的,研究人员提供了一些信息。该搜索策略包括与食道癌和辅助治疗相关的关键词(完整的搜索策略请参阅补充表1,http://links.lww.com/SLA/D462)。我们还检索了已发表研究的参考文献,并人工检索灰色文献,以确保相关文章不会被遗漏。本系统评审和荟萃分析是根据系统评审和荟萃分析(PRISMA)的首选报告项目进行报告。
成果评估
在这篇综述中感兴趣的主要结果是1年和5年的总生存期(OS)。一年时间间隔的选择反映了食道癌的侵袭性,在纳入的研究中报告的较短的中位随访时间。次要结果包括无病生存(DFS)、局部复发、远处复发和辅助治疗相关并发症。
资格标准
如果这些研究调查了食管癌患者在新辅助治疗(放化疗或化疗)和切除切缘阴性的食管切除术后辅助治疗的作用,则符合纳入条件。我们包括随机对照试验和队列研究(前瞻性或回顾性)。排除标准包括:食管癌切除后切缘为负值的总人口小于80%,病理切缘状态未报告,总人口大于5%的IV期疾病,病例报告,会议摘要,社论,综述论文,基础科学文章,少于5名患者的研究,以及未报告相关结果的研究。我们将IV期疾病排除在≥5%之外,因为他们不适合进行诱导化疗和手术切除治疗。我们不以语言来区分文献。
研究选择和数据提取
根据标题、摘要和全文进行研究选择,一式两份。在标题和摘要阶段,任何差异都会自动包括在内,以确保纳入所有相关研究。在全文或数据摘要阶段发现的差异通过调用第三个独立审查员来解决冲突来解决。从研究中提取以下先验数据:基线研究特征(作者、年份、国家、单中心或多中心、研究类型、阴性边缘百分比、肿瘤生物学)、新辅助和辅助治疗类型、性别、年龄、肿瘤分期、病理淋巴结分期和Charlson合并症指数。
偏见风险与证据评估的确定性
用纽卡斯尔-渥太华量表(NOS)评估非随机化研究的偏倚风险,用Cochrane偏倚风险工具评估随机化研究的偏倚风险。基于Cochrane推荐评估、发展和评估(GRADE)方法,我们评估并报告了结果的质量。评估标准包括偏见风险、局限性、不一致性、间接性、不精确性和发表偏见--提供证据的总体得分为极低、低、中等或高确定性。
统计分析
所有统计分析和荟萃分析使用Stata,Version 14(StataCorp,College,TX)和Cochrane Review Manager 5.3(英国伦敦)进行数据分析和图表生成。我们使用DerSimonia和Laird随机效应模型进行配对荟萃分析,研究结果及其各自的95%可信区间(CI)。对于只报告中位数和四分位数范围的研究,我们使用wan等人提出的方法估计平均偏差和标准偏差。13如果适用,我们使用1年和5年作为我们的结果时间点。根据已建立的Cochrane手册指南14,使用I2统计量对异质性进行评估。使用包含10项以上研究的结果的漏斗图来评估发表偏倚,因为少于10项研究会导致对漏斗图的解释存在偏差。15所有结果的显著性水平被事先设定为p<0.05。亚组分析按癌症类型、术后淋巴结状况(淋巴结阳性>90%的研究被认为是淋巴结阳性研究)、辅助治疗类型和T分期(如果最初分析至少有10项研究)进行。
结 果
研究特征
最初的搜索产生了3692条潜在相关引用,其中总共有13项研究符合纳入标准。16-28尽管符合条件,Drake等人、Mokda等人、Samson等人、Burt等人和Eng等人。所有来自国家癌症数据库(NCDB)的数据都在相似的时间框架内进行了分析。虽然上述研究包含具有不同T分期和淋巴结状态的人群,表明NCDB内的不同患者亚组被检查,但它们很可能包括一些重叠的患者数据。为了防止过度陈述,在这四项研究中,由于其样本量最大,只有Mokda等人的研究被包括在结果分析中,总共留下了10项研究。排除的研究的数据仍然可以在提供的表格中找到。提供了棱镜流程图来概述选择过程(图1)。这些研究是在2007年至2019年间进行的,总共包括6462名患者。除一项随机对照试验(n=300)外,其余研究均为队列研究(n=6162)。所有患者的加权平均年龄为60.5岁(30.0-82.5岁)。加权平均随访时间66.4个月(1~144个月)。按癌症类型分类的研究报告仅包括腺癌(n=4646),仅鳞癌(n=226),以及腺癌和鳞癌的混合人群(n=1590)。在所有患者中,有5860例(90.68%)食道切除术后切缘病理阴性。在4个淋巴结阳性研究中有1485例患者,在6个研究中有4977例患者同时存在淋巴结阳性和阴性(50.03%的患者为N+(n=3362),49.97%的患者为N-(n=3100))。在研究的对照组中,有5061名患者仅使用新辅助治疗和手术,而在新辅助治疗后再手术和辅助治疗组有1401名患者。特别是纳入的RCT研究了表皮生长因子受体(EGFR)靶向辅助治疗(西妥昔单抗),而所有其他研究都使用了化疗辅助治疗:顺铂、5-氟尿嘧啶、法利泰、奈达铂、卡铂、伊立替康、依托泊苷、多西他赛、铂、亚叶酸钙、紫杉醇、奥沙利铂和表阿霉素。研究中使用的详细新佐剂和佐剂方案在http://links.lww.com/SLA/D462.的补充表2中报告。所有纳入研究的详细特征在http://links.lww.com/SLA/D462.的补充表3中报告
总生存期为1年
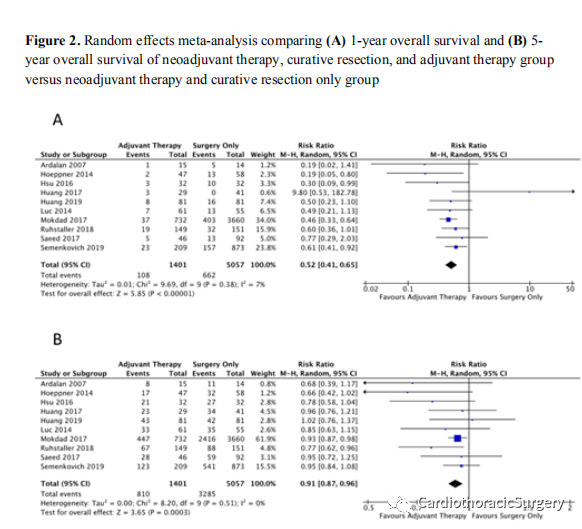
补充表4,http://links.lww.com/SLA/D462展示了所有结果的荟萃分析以及证据档案的等级确定性。总共有10项研究分析了1年(图2A)和5年OS(图2B)。由于缺乏包括3年结果的研究,没有对3年的OS数据进行分析。与单纯接受新辅助治疗和手术的患者相比,接受新辅助治疗和手术的患者在1年死亡率显著降低48%(RR0.52,95%CI0.41~0.65,P<0.001,中度确定性)。在基于癌症类型的亚组分析中,仅患有腺癌的人群(RR0.44)、仅患鳞癌的人群(RR0.43)和混合组(RR0.94)(亚组差异:P=0.21)之间的1年总体生存益处没有显著差异(补充图1A,http://links.lww.com/SLA/D461). 在基于辅助治疗类型的亚组分析中,辅助化疗组1年的OS受益保持在(RR0.52,95%CI0.42至0.64,P<0.001,中等确定性),但不能仅使用辅助放化疗或放疗,尽管在这一亚组中只有三项研究(RR0.62,95%CI0.18至2.09P=0.44,非常低的确定性)(补充图2A,http://links.lww.com/SLA/D461).
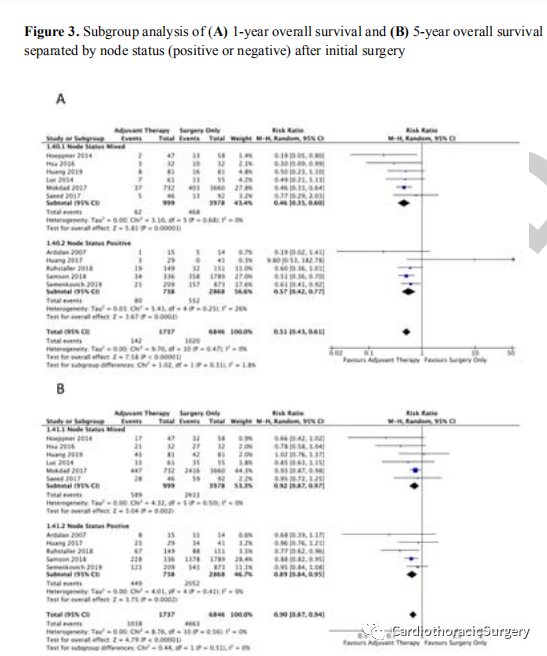
1年后,与非辅助治疗相比,只有结节状态混合亚组在辅助治疗后有显著的OS益处(结节阳性:RR0.61,95%CI 0.371.02,P=0.06,中度确定性;结节状态混合:RR0.46,95%CI0.35-0.60,P<0.001,高度确定)(亚组差异:P=0.32)(图3A)。根据T阶段分析,辅助治疗对T1-2组没有提供任何OS益处(RR0.42,95%CI0.11-1.69,P=0.11,低确定性),但T3-4组一年的OS收益显著增加49%(RR0.51,95%CI0.41-0.63P<0.001,中等确定性)(补充图3A,http://links.lww.com/SLA/D461).
正如Mokda等人所说。在对研究人群有显著贡献的情况下,进行了敏感性分析,以确定其对汇集数据的影响。取消这项研究不会改变1年OS和NODE混合亚组的结果,保留了辅助治疗的显著好处。
总生存期为5年
在5年期的同一队列中,接受辅助治疗的患者总体生存益处较小但显著(RR0.91,95%CI0.87-0.96,P<0.001,中等确定性)。对于亚组分析,仅腺癌患者(RR0.88,95%CI 0.771.00,P=0.04,中等确定性)经历了辅助治疗的显著生存益处(补充图1B,http://links.lww.com/SLA/D461).。在2个SCC研究(n=226)和4个混合组研究的亚组分析中,加用辅助治疗对5年OS无益处(RR分别为0.89,95%CI为0.67~1.18,P=0.42,极低确定性;RR为0.92,95%CI为0.84~1.01,P=0.07,中度确定性)。辅助治疗方式的比较亚组分析显示,辅助化疗继续显示出5年OS益处(RR0.91,95%CI0.86-0.96,P<0.001,中度确定性),而辅助放化疗组或单纯放疗组没有生存益处(RR0.92,95%CI0.79至1.07,P=0.29,非常低确定性)(补充图2B,http://links.lww.com/SLA/D461).
与1年的数据相似,在5年的随访中,只有混合结节状态亚组与辅助治疗相关的生存收益显著更高(图3B)。对于T分期亚组,T3-4患者在5年内继续体验到显著的OS益处(RR0.91,95%CI0.85-0.97P=0.005,中等证据确定性),而T0-2状态则没有(RR0.82,95%CI0.57-1.18P=0.29,非常低的确定性)(补充图3B,http://links.lww.com/SLA/D461).。去除一项随机对照试验后的敏感性分析(考虑到这评估了EGFR靶向治疗的使用情况)显示,在所有结果中,集合效应或显著性没有差异。特别是,1年和5年OS的效应大小没有显著差异(去除RCT后的1年总生存率:RR 0.50,95%CI为0.38-0.65;去除RCT后的5年总生存率:RR为0.92,95%CI为0.88-0.97)。去除Mokda等人的敏感性分析。这项研究也没有改变OS的结果,但删除了5年混合节点状态下的好处(RR:0.87,95%CI为0.761.00)。
无病生存和复发
只有5项研究(n=780)评估了1年和5年的DFS(补充图4,http://links.lww.com/SLA/D461).。在这两个时间点,辅助治疗组和对照组的DFS均无差异(1年DFS:RR0.82,95%CI 0.67-1.02P=0.07,极低确定性;5年DFS:RR0.96%CI0.79-1.17,P=0.68,极低确定性)(补充图4,http://links.lww.com/SLA/D461).。4项研究(n=550)报告了任意时间点的局部区域复发(补充图5,http://links.lww.com/SLA/D461).。辅助治疗组与对照组比较差异无统计学意义(RR 0.81,95%CI 0.53~1.24,P=0.31,极低可信度)。只有两项研究报告了远端复发(补充图6,http://links.lww.com/SLA/D461)),显示辅助治疗与对照组无显著差异(RR0.68,95%CI0.30~1.52,P=0.34,非常低的可信度)。由于缺乏报告这些结果的研究,亚组分析是不可能的。Http://links.lww.com/SLA/D462.的补充表5中报告了所有纳入研究的主要和次要结果。
并发症
在所有研究中,并发症的报道很少。大多数纳入的研究没有报告与辅助或新辅助治疗相关的生活质量、毒性或并发症。只有两项研究报告了这些结果,并在http://links.lww.com/SLA/D462.的补充表6中综合报告。
偏见和等级的风险
Http://links.lww.com/SLA/D462.的补充表7和表8提供了所有研究中偏向风险的摘要。12项队列研究采用渥太华纽卡斯尔量表进行评估,AHRQ标准适用于所有12项研究。所有12项研究的选择得分为3,可比性得分为2。75%(9/12)的研究结果得分为3,25%(3/12)的研究结果得分为2。对于随机对照试验,没有随机序列产生,不太可能的分配隐藏,参与者,医疗保健提供者,结果评估。然而,随访和丢失数据的总体损失小于5%,在这项研究中不存在选择性报告偏差。
Http://links.lww.com/SLA/D462.的补充表4总结了按等级评估证据的确定性。由于大多数研究的质量都很好,因此没有任何结果因存在偏见的风险而被降级。有较大CI重叠无效、或<400名患者和/或<300个总结局事件的预后因不精确而被降级。对http://links.lww.com/SLA/D461).10研究中所有结果的漏斗图进行了评估,没有结果显示出发表偏倚(补充图7和8,≥。综上所述,有高度确凿的证据表明,在仅有腺癌和结节状态混合亚组中,辅助性系统治疗在1年内提供了显著的OS益处。在总体人群、仅辅助化疗、阳性淋巴结状态和术后T3-4期的亚组中,辅助治疗对1年和5年的OS有显著益处的证据是适度确定的。仅对鳞癌、辅助放疗/放化疗、病理T0-2期患者进行的1年和5年总体生存分析显示,证据的可信度很低。同样,1年和5年、局部区域复发和远端复发的DFS也被认为具有很低的证据确定性。
讨 论
据我们所知,这是第一次对食管癌新辅助治疗和根治性切除术后辅助治疗的作用进行系统回顾和荟萃分析。在这项对6462名患者的回顾中,辅助治疗的使用与1年(相对危险度0.52)和5年(相对危险度0.91)的OS显著改善相关。随着证据的高度到中等确定性,接受辅助化疗的T3-T4腺癌患者在1年和5年的OS益处在亚组分析中是一致的。重要的是,混合结节状态组的患者在食道切除术后存活率有所提高,但结节阳性的患者没有。对于DFS、局部复发和远端复发,以及鳞癌、辅助放化疗和病理T1-2患者的亚组(由于样本量有限),结果都是不确定的。
虽然这是第一次在根治性食道切除术和新辅助治疗后检验辅助治疗的作用的荟萃分析,但之前的研究已经采取了更广泛的方法来评估食管癌的辅助治疗。马尔塔纳等人进行的荟萃分析。此外,该研究还发现,与单独接受新辅助放疗相比,在新辅助治疗和辅助化疗的联合应用中,联合接受新辅助治疗和辅助化疗的患者的生存结果没有差异。此外,该研究还发现,在同时接受新辅助治疗和手术的患者中,辅助治疗的作用并不直接,但与单独接受手术相比,联合接受新辅助治疗和辅助化疗的患者的OS没有差异。此外,该研究还发现,在新辅助和辅助治疗的环境下同时使用放射治疗,与单独接受新辅助放射治疗相比,其生存结果更差。我们的综述与这些结果略有冲突,因为我们确定联合治疗方式与改善OS有关。这种差异可以用马尔萨纳等人的事实来解释。目前的综述集中在成功的多模式治疗后全身治疗的影响,并相应地包括了化疗和基于化疗和放化疗的多模式治疗。此外,患者群体是不同的,因为目前的综述集中在初次食道切除术和新辅助治疗后切缘病理阴性的患者。此外,这一荟萃分析发表于2004年,不仅早于交叉发表,而且很可能不能反映当前的分期方案。因此,马尔萨纳等人。可能提出过时的发现,而本研究更能代表现代治疗策略。另一项可比较的研究是Yang等人的回顾性队列试验,该试验分析了3,071名食管癌患者,以确定新辅助和辅助化疗联合治疗的益处,与手术切缘状态无关。在这项研究中,T分期较高的患者在采用多模式治疗后OS明显改善。虽然Yang等人没有具体说明边缘状态,但本次综述建立在这些发现的基础上,因为在我们的亚组分析中,辅助治疗对T3-4分期的患者OS有显著改善。此外,我们的手术切缘阴性患者队列显示出与残留病患者相似的辅助治疗益处。先前对新辅助治疗和手术后切缘呈阳性的患者进行的回顾性队列研究得出结论:对这组患者实施辅助治疗可显著改善OS和DFS。尽管它侧重于辅助免疫治疗,而不是我们的研究那样的化疗/放疗,并且在我们的收入期过后发表,RCT CHECKMATE 577显示与辅助治疗相关的DFS增加。尽管只包括切缘阴性的患者,我们的研究显示了与辅助治疗相关的类似的OS益处,而DFS没有达到。我们的研究还涉及目前正在进行的值得注意的试验;特别是Neo-Aegis(食道腺癌和食管胃交界处国际研究)的新辅助试验,以及ESOPEC(食道腺癌患者围手术期化疗与新辅助化疗的比较)试验。与目前的综述类似,这两个试验的目的都是确定围手术期治疗和新辅助治疗之间的存活率是否存在差异。虽然ESOPEC仍在进行中,但Neo-Aegis已经公布了初步结果。与我们的发现相反,NeoAEGIS在24.5个月的中位随访时间内发现两组患者之间没有显著差异。应该注意的是,与我们的综述不同的是,这两项研究都主要集中在腺癌上,并没有具体说明边际状态为负。此外,Neo-Aegis还没有公布完整的OS数据。尽管这些试验无疑会提供关于这个主题的相关信息,但在与我们的研究进行任何有意义的比较之前,需要完整的数据才能与我们的研究进行任何有意义的比较。
目前食道癌的指导方针高度依赖于疾病的严重程度和当地的实践模式。通常,根据交叉试验的结果,北美对局部晚期食管癌的治疗标准是先使用新辅助化疗,然后再切除食道。然而,英国也采用了类似的方法,使用新辅助化疗而不是化疗。直到最近,传统的观点认为辅助治疗只会潜在地使淋巴结阳性或复发风险增加的患者受益,国家综合护理网络以前曾建议对通过食道切除接受不完全切除的患者使用辅助治疗。此外,直到最近,传统的观点还认为,辅助治疗只会使淋巴结阳性或复发风险增加的患者受益,国家综合护理网络曾建议对通过食道切除接受不完全切除的患者使用辅助治疗。此外,根据今年发表的Checkmate 577研究结果,FDA已经批准使用nivolumab作为食道癌三联疗法后的辅助治疗。
我们的研究对这些指南提出了挑战,因为它显示了为切除切缘阴性和术前诱导治疗的患者提供辅助治疗的明显的额外生存益处。此外,我们的综述仅发现,与仅有结节阳性的患者相比,混合结节状态组的OS有了显著的改善。这些发现表明,与以前的观念相反,辅助治疗可能不仅有利于有复发风险的患者,也可能有利于那些通过诱导治疗根除淋巴结阴性疾病的患者。可以预期,结节阳性患者的生存收益会更高。我们的结果表明并非如此。这可能可以用持续性结节阳性疾病的侵袭性来解释,这些疾病对任何诱导方案都没有反应。同样,这些患者可能表现出攻击性的潜在疾病生物学,因此,增加辅助治疗可能不会带来有意义的影响。此外,这些患者对诱导治疗没有反应的事实,预示着在术后环境中缺乏反应--最终解释了这篇综述中提出的结果。最后,虽然我们在T0-2亚组中没有确定有意义的OS差异,但这一结果的临床应用有限,因为早期T期患者被提供有治疗意图的前期手术或内镜治疗,而没有新的辅助治疗,因此不符合本综述的患者概况。
我们的研究提供了有希望的证据,证明辅助治疗对切除切缘阴性的患者有好处,因此,未来的研究有很大的潜力。由于目前这一主题的文献主要由观察性研究组成,应该在这一特定人群中进行更大规模的随机对照试验,以提供更有效的证据。未来的研究还应该报告其他癌症结果,如DFS、复发率和辅助治疗相关的并发症。将有关这些结果的信息与OS数据结合起来,将允许对癌症结果进行更准确的评估,并对辅助治疗对治疗发病率和患者生活质量的影响提供更全面的评估。最后,研究应该根据癌症类型和接受的辅助治疗类型对这些结果的报告进行分层,以确定哪种治疗方案最有效,以及哪组食管癌患者从中受益最大。未来的研究还应该包括和评估患者的不同系统辅助治疗方式,包括新辅助化疗和放射治疗,并考虑免疫治疗在食管癌中的作用。
这一荟萃分析的结果应该根据以下限制来解释。首先,我们纳入的研究中很少报道DFS、局部复发或远端复发的价值。因此,这些结果的证据的确定性是有限的,这阻碍了对辅助治疗对OS以外的结果的影响的彻底分析。虽然OS的数据在肿瘤学环境中具有明显的重要性,但DFS也需要确定一种治疗在管理疾病特异性影响方面的有效性。38,39单一关注OS限制了确定生存改善是由于疾病退化/治愈还是其他临床变量的能力。38然而,在我们的综述中显示的辅助治疗对OS的有意义的改善是一个值得进一步探索的重要发现。其次,这篇综述中包括的大多数研究都是基于队列的,只有一项随机对照试验(评估辅助性EGFR靶向治疗的效果)。即使排除了随机对照试验,我们的荟萃分析的结果在效应大小上是相同的,并且在1年和5年的OS中仍然显著。然而,我们的荟萃分析显示,大多数结果的一致性都很好,尽管实施了不同的辅助治疗方案,但1年和5年的总存活率I2为0%。因此,尽管证据的确定性将随着未来的随机对照试验而增加,但结果的大小和意义不太可能受到更多的队列研究的影响。考虑到试验很少的局限性,可能是因为食道切除术后的显著发病率和术后恢复-特别是辅助治疗中的细胞毒药物对患者来说可能太多了。因此,对于足够的RCT患者群体选择,重要的是采用更好的新辅助策略和术后风险分层的分析方法(例如。血浆循环肿瘤DNA测序)可将残留疾病降至最低,并在合适的患者群体中发挥最大效益。第三,没有一项研究调查了纯粹由淋巴结阴性患者组成的人群。因此,我们只能对辅助治疗对这一特定人群生存的影响做出保守的假设。第四,我们最初纳入的一些研究在类似的时间框架内评估了NCDB,留下了数据被夸大的可能性。因此,三项研究被排除在我们的结果分析之外。尽管这减少了我们的研究人群,但在有或没有额外的NCBD数据的情况下,OS在1年和5年的重要性仍然保持不变。最后,所有纳入的研究都没有分析与生活质量相关的结果,只有两项研究评估了与辅助治疗相关的并发症。虽然存活率是一项重要的结果衡量标准,但在临床实施之前,也有必要确定与治疗相关的不良反应。这一局限可能是由于所包括的较小规模的观察性研究,这些研究只分析了有限数量的结果。
结 论
综上所述,这项荟萃分析表明,新辅助治疗和切除切缘为负的食道切除术后的辅助治疗确实在1年和5年提供了改善的OS,证据具有中等到高度的确定性。尽管可以得出DFS或复发的结论的数据有限,但我们的综述确实提供了关于食管癌根治性切除术后辅助治疗的潜在生存益处的有趣信息。因此,应该进行大的随机对照试验和长期(>5年)随访,以提供进一步的证据,证实在这种情况下辅助治疗的实施。此外,增加对DFS、复发和生活质量指标的报告可能会提供关于真正相关益处和/或风险的更有意义的结论。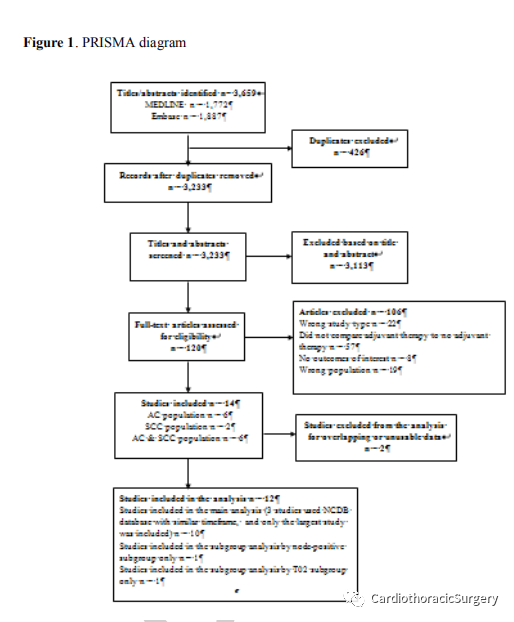

原文链接:http://www.xxwk.net/archives/1238