目的:本研究的目的是分析53例胸腺瘤患者的结果,其中34例有重症肌无力(MG),他们接受了机器人手术。对整个系列患者的肿瘤学结果进行了分析。此外,由于文献中还没有一致的数据,主要集中在对MG和胸腺瘤患者的神经学结果进行分析。
方法:收集并评价2014年1月至2019年12月在我科接受机器人胸腺切除术的53例胸腺瘤患者的临床结果,其中34例同时诊断为MG。根据Osserman分类和手术前后重症肌无力综合评分,根据临床评估确定患者的神经状态,而神经临床结果则使用美国重症肌无力基金会干预后评分进行评估。同时考虑减少类固醇治疗。评估胸腺瘤患者的复发率、辅助放疗和总生存期。
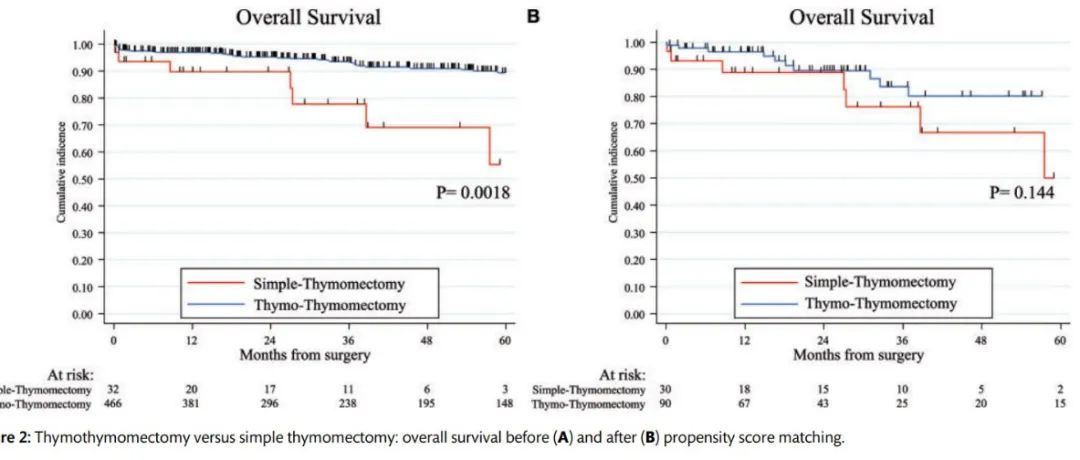
结果:神经转归:术后26例(76.5%)临床症状改善,其中完全稳定缓解5例(14.7%),药物缓解10例(29.4%),轻度症状11例(32.3%)。4例(11.8%)患者临床表现与治疗前相比无明显变化或MG用药减少,4例(11.8%)患者临床症状恶化。21例(61.7%)患者激素用量减少。肿瘤学结果:根据分期,平均随访36个月,总存活率为96%,4例(7.5%)胸膜复发,12例(22.6%)接受术后放疗。按Masaoka分期,I期占34%,II期占56.6%,III期占9.4%。
结论:我们的研究结果表明,胸腺瘤合并MG患者的机器人手术治疗能有效改善神经预后。此外,本系列中获得的肿瘤学结果证实了机器人手术治疗胸腺恶性肿瘤的有效性,其结果与开放手术的结果一致。然而,由于胸腺瘤的缓慢生长,进一步观察和更长时间的随访是必要的。
引文
胸腺瘤是一种罕见的胸腺上皮性肿瘤,通常以生长缓慢、局部浸润和罕见的远处转移为特征。胸腺瘤经常与几种疾病有关,其中重症肌无力(MG)是最常见的,在这些患者中有10%-15%的人被诊断为胸腺瘤。
1939年,Blalock报道了第一次手术治疗重症肌无力胸腺瘤的经验,他报道了一系列采用胸骨切开入路的病例。多年来,胸腺切除术已成为胸腺瘤的首选治疗方法,目前已被公认为胸腺瘤的标准有效治疗方法;它源于一项关于胸腺切除术对重症肌无力患者临床疗效影响的主要研究。
最初,外科治疗主要包括胸腺次全切除,但随着时间的推移,由于外科技术的发展和神经学术后数据的获取,完全切除胸腺组织及其周围纵隔脂肪的重要性变得不可否认,它是改善神经预后的关键因素。
此外,从肿瘤学的角度来看,胸腺瘤切除仍然是主要的治疗策略:肿瘤分期、组织学分析和手术的根治性是影响预后的基本因素。
近年来,考虑到MG患者的年轻年龄结构,外科医生治疗胸腺瘤的挑战一直集中在微创方法上。
在电视胸腔镜手术(VATS)用于胸腺切除的最初经验之后,尽管有不可否认的优势,但由于组织切除不完全的风险,许多外科医生不愿对MG患者使用微创方法。
再者,机器人手术的引入提供了几个优点,例如10倍放大的三维视觉,高度精确的运动和手术领域的毫不费力的可视化。此外,由于机器人手术的优势,根据ITMIG的建议,机器人手术允许应用“非接触技术”,以最大限度地提高外科手术的根本性。
几篇论文已经证实了机器人手术治疗胸腺良恶性肿瘤的安全性和有效性,但对胸腺瘤MG患者胸腺切除术后神经学结果的研究仍然非常有限。
这项研究分析了机器人手术治疗重症肌无力和胸腺瘤的效果,重点评估了手术后肿瘤和神经学的远期结果。
方法
伦理声明
研究设计、患者登记方法和数据收集方法由机构审查委员会审查和批准。
每个患者都得到了充分的信息,并必须签署知情同意书才能参加研究。这项回顾性研究评估了2014年1月至2019年12月期间接受机器人胸腺切除术的胸腺瘤患者的数据。有或没有神经学和血清学诊断为MG的胸腺瘤患者也包括在这项研究中,这些患者适合手术。良性胸腺疾病或胸腺瘤不符合手术条件的患者被排除在外。
手术前,所有有肌无力综合征症状的受试者都接受了神经学检查,包括血液检查以揭示乙酰胆碱受体和肌肉特异性血清激酶(抗麝香)抗体的存在,以及胸部的计算机断层扫描(CT)以发现前纵隔的未指明病变。同样,CT扫描显示前纵隔肿块(提示胸腺瘤)的受试者接受了乙酰胆碱受体和抗麝香抗体血液测试和神经学评估,以评估与MG相关的可能性。研究中没有患者的抗麝香抗体检测呈阳性。在所有常规临床检查完成后,所有患者都接受了机器人辅助胸腺切除术。
第三代和第四代机器人系统进行了机器人胸腺切除术。第四代是2015年在我们的日常外科实践中引入的。胸腺切除的机器人入路需要在左侧或右侧胸腔开3个手术切口。在我们的机构中,左侧是首选的,而我们只在胸腺瘤延伸到右半胸的情况下才使用右侧入路。手术通道的一侧取决于外科医生的经验和单侧肿瘤的范围。患者仰卧,在脊柱下方放置一卷以暴露纵隔区域。第一个入路位于腋前线的V型肋间间隙,第二个入路位于腋中线的第三个肋间间隙,第三个入路位于锁骨中线的V型肋间间隙。最大的颅口用来切除病变。在胸腺瘤较大(例如10厘米)的情况下,这个入口与肋间间隙一起被加宽了几厘米。选择这个特定的端口通常是因为这一水平的肋间空间更具伸缩性。
在所有分析的病例中,根据国际胸腺恶性肿瘤兴趣小组的建议进行了扩大胸腺切除术。在确定了侧膈神经和位于吻部的无名静脉后,扩大胸腺切除术包括完全剥离胸腺Glanden区块和纵隔脂肪组织。所有病例均按国际胸廓891G研究协会的淋巴结标测方案进行胸腺周围淋巴结站的探查。Romanoet等人/欧洲心胸外科杂志于2021年11月1日由客户从https://academic.oup.com/ejcts/article/60/4/890/6321589下载,癌症/国际胸腺恶性肿瘤兴趣小组[10]。在我们的系列中,没有进行N2淋巴结清扫,因为所有患者的胸部CT扫描都是阴性的。
从麻醉的角度来看,MG患者的治疗是一个真正的挑战,因为这种疾病涉及神经肌肉和呼吸,并增加了突然发生肌无力危象的风险。
在机器人胸腺切除术中,麻醉监测方案包括无创性检查血压、心电图、血氧饱和度、体温、双频谱指数和术中神经肌肉阻滞的四个系列监测。麻醉诱导采用异丙酚2 mg/kg、芬太尼1g/kg、罗库溴铵0.6 mg/kg。麻醉维持在持续静脉输注异丙酚(4~6 mg/kg/h)和瑞芬太尼(0.3~0.5 mg/kg/min),术后镇痛包括吗啡0.5 mg/kg、酮咯酸30 mg和对乙酰氨基酚1g,术毕用罗哌卡因(10 mg/ml)和利多卡因(2%)浸泡伤口。术后用酮咯酸90 mg/d输注,疼痛时用扑热息痛。
收集并分析人口学资料、术中(入路侧、手术时间、中转开放手术)和术后结果(胸腺瘤大小、组织病理学诊断、辅助治疗、肿瘤学和神经学随访)。
根据世界卫生组织胸腺上皮性肿瘤的分类和Masaoka的临床分期系统对肿瘤进行组织学分类。
根据Osserman-Jankins分类和手术前后重症肌无力综合评分(MGC)进行临床评估,而神经临床结果根据美国重症肌无力基金会干预后评分(MGFA-PIS)进行评估,其中完全稳定缓解(CSR)定义为无症状和至少1年未用药。所有患者在手术前和每隔6个月由专门的神经科团队进行检查,以评估任何神经改善和患者报告的可能的体征和症状(服用吡啶斯的明后12小时)。此外,记录任何最终减少的术后类固醇剂量。
这项研究的主要假设是对患有MG和胸腺瘤的患者使用机器人方法的肿瘤学和神经学结果进行分析,以确认与其他更传统的方法相比,使用机器人方法的优势,这一点在文献中可以看到。
统计分析
收集的分类数据用频度描述,连续数据用均值和标准差(SD)描述。
为了评价连续数据分布的正态性,用Shapiro-Wilk检验来表示分布的正态性。为了分析连续变量和分类变量,我们分别对独立样本进行了t检验(双尾)和v2检验。
为了评估手术前后MGC评分的差异,我们对配对数据(双尾)进行了t检验。统计学检验在平均水平0.05下进行。所有分析使用SPSSv.27(IBM-SPSS Inc.,Armonk,NY,USA)进行。
结果
从2014年到2019年,我所在机构共实施了233例机器人胸腺切除术。其中包括MG患者的良性肿瘤手术,以及MG和非MG患者的胸腺瘤手术。53名胸腺瘤患者接受了机器人辅助胸腺切除术。全部队列包括25名男性和28名女性,平均年龄56岁(SD 16)。在这些患者中,34名患有MG[18名女性和16名男性,平均年龄52.6岁(SD 18.1)]。34例MG患者中,13例(术前10例,术后3例)静脉注射免疫球蛋白,无1例接受血浆置换治疗。5例接受免疫抑制剂治疗(平均剂量为38.12 mg)。平均手术时间126min(SD 59)。1例(1.9%)因无名静脉和心包浸润而需中转开放手术。所有患者均在手术结束时拔管。平均住院天数为5.1天(SD3.3)。
术后并发症4例(7.5%),其中呼吸衰竭1例,需无创通气,气胸1例,胸腔引流1例,乳糜胸2例,其中1例在术后第2天接受机器人手术翻修。
肿瘤直径0.1~10 cm,平均3.8 cm(SD 2.5)。16例(30.2%)同时行淋巴结清扫,组织学结果为阴性。病理诊断为A型胸腺瘤16例(30.2%),AB型胸腺瘤8例(15.1%),B1型胸腺瘤8例(15.1%),B2型胸腺瘤14例(26.4%),B3型胸腺瘤7例(13.2%)。根据Masaoka分期,I期18例(34%),II期30例(56.6%),III期5例(9.4%)。根据病理分期和多专家委员会的评估,12名患者(22.6%)接受了辅助放射治疗。
肿瘤和神经系统的平均随访时间为36个月(SD17)[MG患者平均随访33.9个月(SD13.2)]。在随访期间,2名患者死亡:1名与胸腺瘤无关(发作期),1名死于疾病进展。34名出现肌无力危象的患者中有1名接受了静脉注射免疫球蛋白治疗。一名患者术后因严重肥胖被转移到重症监护病房,在保护区拔管。
A型和AB型胸腺瘤无复发,B型胸腺瘤复发4例(P=0.069):B1胸腺瘤1例,B2胸腺瘤1例,B3胸腺瘤1例,AB2/B3胸腺瘤1例,肌无力3例。1例B2/B3胸腺瘤患者未诊断为MG。原发肿瘤大小分别为2.4 cm、5 cm、3.5 cm和7 cm,4例确诊为胸膜复发。胸腺切除术后放疗12例,胸腺瘤A型或AB型2例(16.7%),B型10例(83.3%)(P=0.034)。
当我们评估组织病理学类型时,我们发现胸腺瘤的组织学类型与患者的年龄之间有显著的统计学相关性(P=0.030):B型胸腺瘤患者的平均年龄为52岁,即预后较差的患者,而A型或AB型胸腺瘤患者在老年人中更常见,事实上,平均年龄为61岁(SD15),而B型胸腺瘤的平均年龄为52岁,即预后较差的患者,而A型或AB型胸腺瘤在老年人中更常见,事实上,平均年龄为61岁(SD15)。
诊断MG 34例(64.2%),其中Osserman I级8例(23.5%),II级19例(55.9%),III级7例(20.6%)。
多变量分析显示,低级别的Osserman分级(I和II级)与较低的Masaoka分期(I级)之间存在统计学意义上的相关性,而较高的Osserman分级(IIb、III级)似乎与较高的Masaoka分期(II、III)相关(P=0.035)(表1)。
在组织学类型分析中也发现了类似的趋势:胸腺瘤B似乎与Osserman IIb或III相关(P=0.022)(表2)。
对所有MG患者进行MGFA-PIS评分。术后临床症状改善26例(76.5%),CSR 5例(14.7%),药物缓解10例(29.4%),轻度症状11例(32.3%)。4例(11.8%)患者(11.8%)与治疗前相比临床表现无明显变化,MG用药未见减少(U);4例(11.8%)患者临床症状恶化(表3)。
术前平均MGC值为11.9(SD6.1),术后平均MGC值为3.5SD4.3,术后MGC值较术前明显改善(P<0.0001)。
当我们分析MG患者术后激素治疗的效果时,发现21例(61.7%)的激素用量减少,特别是在OSERMAN I或II级患者,比OSERMAN III级患者减少更多(P=0.588)。术前平均激素用量为36.7 mg(SD14.5),术后平均剂量为15.5 mg(SD13.4)。
讨论
扩大胸腺切除术被认为是治疗早期胸腺瘤的金标准。手术包括根治性切除胸腺和胸腺周围脂肪组织的肿瘤块。根据ITMIG指南的规定,在确认左右膈神经后,必须切除前纵隔脂肪组织,以确保肿瘤学和神经根性,从颈静脉到心包前膈角进行解剖。
胸骨胸腺切除术长期以来一直是治疗胸腺瘤患者的首选手术方式。开放胸腺切除术可以很好地显示前纵隔,确保神经和血管的适当控制。此外,在侵犯邻近器官的情况下,胸骨切开可以可行地切除带有粘连结构的块状肿瘤。
1993年,Sugarbaker进行了第一次胸腔镜胸腺切除术,从根本上改变了胸腺恶性肿瘤的外科治疗方法。微创手术有几个优点,包括手术创伤小,术后疼痛少,胸腔引流时间短,住院时间短,在相同的肿瘤根治性下有更好的美容效果。此外,几项微创手术治疗胸腺肿瘤的研究表明,术后早期肺部恢复得到改善,这可被认为是重症肌无力患者术后处理的关键。
到目前为止,机器人手术被认为是微创手术的极端进化。由于它的特点,外科医生能够以更高的准确性复制开放胸腺切除术的相同步骤。
多项研究证实了机器人手术应用于前纵隔病变的安全性、可行性和有效性。然而,关于并发MG的胸腺肿瘤的机器人治疗的长期结果,没有一致的神经学数据可用。特别是,关于胸腺瘤影响的MG患者的神经学结果的数据很少。
在2015年的一项研究中,Keijzerset等人分析了接受机器人手术的MG患者的神经学结果,这些患者受到几种胸腺病变(增生、囊肿、脂肪瘤和胸腺瘤)的影响。他们将重点放在MGFA分级上,以确定手术前和干预后的状态,胸腺瘤患者获得5.6%的3年CSR。
2017年,Kumaret al.分析了71名MG患者的肿瘤学和神经学结果,这些患者因不同的疾病接受了机器人胸腺切除术,证实了机器人手术治疗这些患者的安全性和可行性。17.5个月后总的CSR率为38%;特别是21例胸腺瘤患者,CSR率为19%。
尽管在这些研究中评估了大量的患者,并取得了良好的结果,但仅受胸腺瘤影响的MG患者的具体长期结果并不一致。
这项研究是关于MG和胸腺瘤患者的长期神经学和肿瘤学结果的首批经验之一。事实上,众所周知,诊断为胸腺瘤或良性疾病的患者肌无力的病程是不同的。
我们分析了53例胸腺瘤患者,他们在完全内窥镜下接受了机器人胸腺切除术,其中34人受到MG的影响。
在神经学结果方面,本组中76.5%的患者症状改善(MGFA-PIS),36个月后CSR率为14.7%。与其他系列相比,这些结果似乎是一致的。
此外,OSERMAN I-II级与MasaokaⅢ-IV期(P=0.035)和B型(P=0.022)有相关性。这些结果证实了文献中发现的有关肌无力症状和更具侵袭性的胸腺瘤之间的联系的数据。
在我们的系列中,经过平均36个月的随访,当我们分析肿瘤学结果时,总存活率为96%,复发率为7.5%。此外,当我们将我们的神经学和肿瘤学结果与国际科学文献中的数据进行比较时,我们观察到它们与开放手术的结果是一致的,证实了机器人手术实现的根本性[21]。达成协议的另一个原因是,根据国际指南,所有患者术后都要接受一个多学科委员会的检查,以确定随访或放射治疗(IIb和III阶段)的适应症[22],这也是因为所有患者都要接受多学科委员会的检查,以确定随访或放射治疗(IIb和III阶段)的适应症。
此外,与经胸骨入路相比,机器人手术的并发症发生率更低,住院时间更短,术后生活质量更好。
机器人手术的令人满意的术后结果可以用机器人系统的特点来解释:更好的可见性、更大的灵活性和更好的机动性,使外科医生能够更容易地到达前纵隔的偏远区域,提高手术的精确度,从而确保扩大胸腺切除术的执行和“非接触”技术的应用,从而降低肿瘤细胞局部扩散的风险。这项技术意味着胸腺瘤永远不会被触及;在手术过程中,正常的胸腺组织和胸腺周围脂肪被用来抓取和牵引。这项技术避免了对肿瘤的任何直接操作,最大限度地降低了因包膜受损而种植肿瘤的风险。因此,根据国际胸腺恶性肿瘤兴趣小组标准[10],胸腺和胸腺周围脂肪可以在安全的手术切缘下进行解剖。对肿瘤学变量的分析表明,世界卫生组织的分类与复发率之间存在统计学上的显著相关性(P=0.069),证实了应用非接触式技术和使用机器人进行根治性手术的可能性。
此外,机器人系统的最新升级可以改善手术的根治性,例如术中使用荧光,在熟练的外科医生手中,荧光可以在获得神经和肿瘤根治性方面发挥重要作用,从而能够更精确、更彻底地切除肿瘤、胸腺和胸腺周围脂肪。
在我们的系列中,受到Masaoka III期胸腺瘤影响的患者也接受了机器人手术。这一结果表明,机器人技术的发展使得治疗这种疾病的局部晚期形式成为可能,从而避免了实施经胸骨手术。此外,我们的经验表明,肿瘤的体积并不是机器人手术的禁忌症。多亏了机器人仪器的广泛运动范围和放大的三维视图,我们实际上已经能够治疗大直径(高达10厘米)的病变,而不会出现并发症。
然而,VATS的做法不容忽视。事实上,根据文献中的数据,电视胸腔镜治疗早期胸腺瘤是安全可行的,并且与肿瘤预后良好相关。2014年,一个英国研究小组显示,与开放方法相比,在一组胸腺瘤患者中取得了良好的肿瘤学短期和中期结果。
我们的肿瘤学结果可以与电视胸腔镜手术和开放手术的结果相媲美;但是,由于胸腺瘤生长缓慢,需要进一步的研究来评估与其他技术的长期可比性。
局限性
这项单中心回顾性研究有一些局限性:考虑到胸腺瘤的缓慢生长,应该增加患者数量和随访时间,以确认肿瘤学结果。采用其他外科技术(胸骨切开和电视胸腔镜)进行前瞻性多中心对比研究将更好地分析肿瘤学和神经学结果。
总结
本研究对53例胸腺瘤患者进行了长期随访,其中34例为MG。MG患者神经症状的临床改善和肿瘤学结果表明,机器人技术是一种技术可行、安全、并发症发生率低、住院时间短的手术方法。
从肿瘤学的角度来看,报告的结果证实,在适用的情况下,应始终根据国际指南考虑微创手术。此外,神经学结果从长期临床角度证实了机器人技术的有效性。

原文链接:http://www.xxwk.net/archives/1780