引言重症肌无力(myasthenia gravis, MG)有4种基本治疗方法:
●对症治疗(抗胆碱酯酶药物)
●慢速免疫调节治疗(糖皮质激素和其他免疫抑制药物)
●快速免疫调节治疗(血浆置换和静脉用免疫球蛋白)
●手术治疗(胸腺切除术)
本专题将讨论用于胸腺切除术治疗MG。
概述胸腺切除术治疗MG患者的依据与如下观察发现有关:
●胸腺可能在肌无力的发病机制中发挥作用。
●多数有抗乙酰胆碱受体(acetylcholine receptor, AChR)自身抗体的MG患者存在胸腺异常:60%-70%的患者存在胸腺增生,10%-15%的患者存在胸腺瘤[1,2]。
因此,在所有MG患者的诊断性评估中,均应包括胸部及纵隔的CT扫描或MRI。
胸腺瘤 — 无论MG的状态如何(如,全身型、延髓型及眼肌型),所有合并胸腺瘤的患者均应进行胸腺切除术。胸腺瘤的治疗包括完全切除术,如果不能完全切除,则加用放疗来缓解肌无力症状和预防肿瘤局部浸润[3]。
无胸腺瘤 — 对于存在AChR抗体的全身型MG患者,在无胸腺瘤的情况下,通常认为胸腺切除术有益[4-8]。有关胸腺切除术的一些未解决的疑问包括:适合进行手术的年龄,应在病程的哪个阶段进行手术,手术方式,胸腺切除在血清学阴性MG患者、肌肉特异性受体酪氨酸激酶(muscle-specific receptor tyrosine kinase, MuSK)抗体阳性MG患者和单纯眼肌型MG患者中的作用。
疗效多中心、评估者盲法试验MGTX的结果支持胸腺切除术对非胸腺瘤MG患者有益[8]。该试验纳入了126例全身型AChR抗体阳性MG且病程小于5年的研究对象(16-65岁,中位年龄约33岁)。该试验将研究对象随机分配至进行经胸骨胸腺扩大切除术加隔日泼尼松治疗,或单纯进行隔日泼尼松治疗。观察到如下结局[8]:
●3年中,胸腺切除术组与单纯泼尼松治疗组相比,前者的时间加权平均定量重症肌无力评分(分数越高代表肌无力越严重)更低(6.15分 vs 8.99分,估计差异2.85分,95%CI 0.47-5.22)。
●3年内,胸腺切除术组对隔日泼尼松治疗的平均需求量显著更低(32mg vs 54mg,估计差异22mg,95%CI 12-32)。
●胸腺切除术组需接受硫唑嘌呤免疫抑制的研究对象比例显著更低(17% vs 48%,估计差异31%,95%CI 16-47)。
●胸腺切除术组因MG恶化而住院的研究对象比例显著更低(9% vs 37%,估计差异28%,95%CI 14-42)。
●12个月和36个月时,胸腺切除术组实现临床表现极轻微(即,无MG所致症状或功能受限,但检查时可能发现某些肌肉存在一定程度的肌无力)的研究对象比例显著更高(12个月时:67% vs 37%;36个月时:67% vs 47%)。
在MGTX试验之前,人们对胸腺切除术治疗无胸腺瘤的AChR抗体阳性MG患者是否有益存在争议[9-11],但来自非随机研究的证据提示胸腺切除术与MG缓解和改善有关。
●一项2016年的系统评价识别出了22项有关非胸腺瘤MG患者的观察性研究,结果显示,与保守治疗(即,药物)相比,通过胸腺切除术实现缓解的比值比为2.44(95%CI 1.91-3.12);通过胸腺切除术实现缓解的患者汇总比例为0.31(95%CI 0.25-0.37);对于保守治疗,相应比例为0.15(95%CI 0.12-0.18)[12]。两个治疗组均存在显著异质性。
●一项关于分别接受和不接受胸腺切除术的MG同卵双胞胎的研究显示,在11年的观察期间,接受胸腺切除术的那名双胞胎在不使用免疫调节治疗的情况下取得了持久的临床缓解,而另一名拒绝胸腺切除术及免疫调节治疗的双胞胎仍存在双侧上睑下垂和中等严重程度的易疲劳性肌无力症状[13]。
●在上文提及的2016年的系统评价中,一项回顾性研究纳入了395例非胸腺瘤MG患者,利用倾向评分平衡基线特征(如,年龄、性别、疾病严重程度、免疫抑制剂的使用),并选择了配对患者组:49例接受胸腺切除术治疗的患者和49例对照组患者[14];5年时,与对照组相比,胸腺切除术组实现缓解或MG表现最轻的可能性显著更高(21% vs 6%,HR 1.9,95%CI 1.6-23)。
胸腺切除术的益处并不是立竿见影的。1年缓解率小于20%,但经过7-10年,缓解率增至最高达50%[15-17]。
多数医疗中心普遍推荐对青春期至60岁的全身型AChR抗体阳性MG患者进行胸腺切除术,作为长期治疗方式[4-6]。
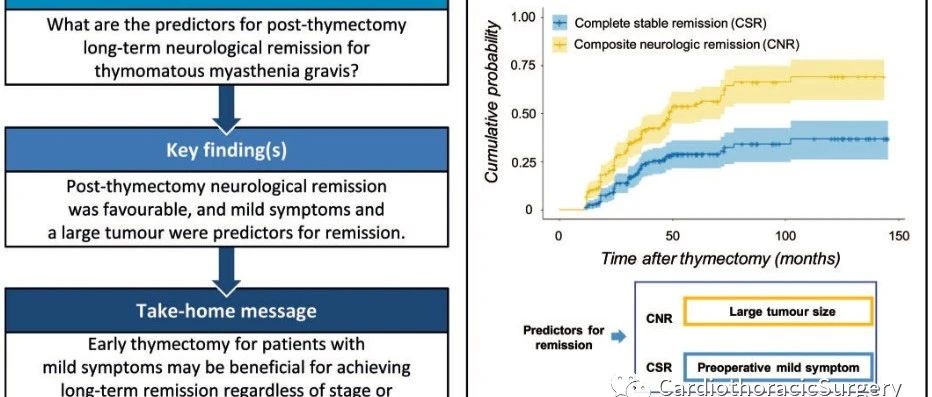
患者年龄和疾病严重程度 — 轻度、中度及重度MG行胸前切除术后的效果大致相当[9],但一项包含18项研究(均为回顾性研究)的系统评价结果提示,术前为轻度MG的患者在胸腺切除术后更可能获得缓解[18]。
虽然迄今为止没有一项研究确定了对非胸腺瘤患者施行胸腺切除术的年龄限制[9,16],但有观点认为年龄较大的患者胸腺退化的发病率较高因而胸腺切除术的效果不太好,胸腺切除术的风险可能超过潜在获益。因此,包括我们中心在内的大部分医疗中心都不对60岁及以上的患者施行胸腺切除术。然而,其他人认为高龄并非是严格的排除因素,并建议根据患者个体的风险与获益评估个体化对待[5]。虽然MGTX试验允许纳入年龄最高65岁的患者,但60岁及以上的患者很少。
血清学阴性肌无力 — 目前尚未确立胸腺切除术对无胸腺瘤的血清学阴性(AChR抗体和MuSK抗体均阴性)MG患者的作用。然而,大多数医疗中心建议,在具备与AChR抗体阳性患者相同状况(年龄、临床状况等)的前提下,可将胸腺切除术作为这类人群的长期治疗方式。一项针对这两组(AChR抗体阳性和阴性)患者的回顾性队列研究发现,在至少3年的随访中两组的胸腺切除术反应率相似[19]。
MuSK抗体阳性肌无力 — MuSK抗体阳性MG患者胸腺病变的发生率比AChR抗体阳性MG患者低得多,但罕见的合并胸腺瘤的患者例外。
现有证据并不支持胸腺切除术对MuSK抗体阳性MG患者的作用[4]。一项包含110例MuSK阳性MG患者的病例系列研究显示,40例接受胸腺切除术的患者术后状态与70例未接受手术的患者相当[20]。这一观察发现并不能排除胸腺切除术对患者有益的可能性,但包括笔者所在中心在内的许多医疗中心都不推荐MuSK阳性的非胸腺瘤MG患者进行胸腺切除术。
眼肌型肌无力 — 胸腺切除术对眼肌型MG的作用存在争议。虽然或许会像全身型MG患者一样获益,但一些医疗中心并不建议眼肌型MG患者进行胸腺切除[16]。其他医疗中心将胸腺切除术作为一种治疗选择,尤其是进行侵入性较小的经胸骨胸腺扩大切除术的中心(包括笔者所在的中心)。
手术方式胸腺切除术的目的是在安全的情况下,尽可能多地切除胸腺组织。除了胸腺本身,纵隔和颈部的脂肪组织中也可能含有不等量的胸腺组织[21]。应采用可最大程度切除这种异位胸腺组织,同时避免伤及喉返神经、左迷走神经和膈神经的手术方式。
有4种手术方式:
●经颈胸腺切除术
●微创胸腺切除术(如,电视辅助和机器人辅助的胸腺切除术)
●经胸骨胸腺切除术
●经颈-胸骨联合胸腺切除术
这些手术均可切除胸腺,但在切除包膜外的纵隔脂肪组织和颈部脂肪组织的范围上存在差异。
目前没有令人信服的资料显示上述任何一种手术方式在治疗MG方面比其他方式的疗效或长期缓解率更好[22]。由于缺乏较好的证据,在胸骨切开术式是否优于侵入性更小的术式(如,经颈扩大术式或电视辅助术式)方面,目前尚未达成共识,该问题有待通过设计恰当的前瞻性试验明确。
●胸骨切开术式(如,经胸骨胸腺扩大切除术或经颈-胸骨联合胸腺切除术)是许多胸外科医生及神经科医生的首选[15,16,23-25]。该术式可充分探查纵隔至颈部区域,从而完全切除所有的胸腺组织及相关的脂肪组织。
●其他人主张“经颈胸腺扩大切除术”,该术式可以将术后疼痛对通气储备的影响降至最小[26,27]。采用该术式仅需短暂的住院时间(通常为1日),且手术瘢痕相对较小。该术式使用一个特殊的有柄牵开器来改善纵隔暴露和在其中进行的切除,且常常与纵隔镜联合使用。一些人认为该术式可能不能充分暴露整个胸腺,从而增加了胸腺组织残留的风险。然而,数项病例系列研究已报道了该术式可达到与经胸骨胸腺切除术相似的临床改善[17,27-29]。
●单纯经颈胸腺切除术不能为手术提供充分的胸腺组织暴露,导致许多患者出现显著的胸腺组织残留,预后似乎更差[15,30]。目前已很少使用。
●采用微创方式进行胸腺切除术(如,电视胸腔镜胸腺切除术或机器人辅助胸腺切除术)的并发症发病率和死亡率较低[15,31-36]。一项回顾性研究对电视辅助胸腺切除术与经胸骨胸腺扩大切除术进行了比较,结果发现,这两种术式在MG缓解率或良好预后方面的差异无统计学意义[35]。虽在技术上可行,但微创胸腺切除术与“完全性”经胸骨胸腺切除术相比的疗效有待更多临床研究来证实。
由于肌无力患者存在呼吸功能受损,其接受手术干预的风险通常很高,但采用现代技术可将手术死亡率控制在1%以下[9]。
虽然关于哪种术式治疗MG更有效尚存在争议,但侵入性更小的术式无疑比侵入性更大的术式并发症发病率更低且住院时间更短。例如,一项纳入95例MG患者的病例系列研究发现,与经胸骨手术相比,接受电视胸腔镜手术(video-assisted thoracoscopic surgery, VATS)的患者平均住院时间显著更短(4.6日 vs 1.9日)[35]。在另一项包含151次经颈胸腺扩大切除术的病例系列研究中,大部分手术无需住院过夜,且手术主要并发症发生率小于1%[37]。此外,避免切开胸骨的术式可避免胸骨切开术的潜在并发症。
手术时机 — 非胸腺瘤患者接受胸腺切除术的最佳时机目前还未确定。然而,如果可能,手术时机可能最好是在患者的MG得到合理控制情况下,且延髓和呼吸系统症状减至最轻时,以免出现围手术期问题。为了减少术后感染和切口愈合问题,在临床情况允许的前提下,将糖皮质激素剂量减至最低也有所帮助。
一些人提出,在病程早期进行胸腺切除术的效果更好。该观点的依据是发病后早期进行手术的缓解率高于发病后晚期进行手术。然而,疾病早期时,患者得到缓解的比率更高。因此,在病程早期进行任何干预都似乎比病程晚期进行效果更好[9,16]。尽管缺乏证据表明早期胸腺切除术益处,但大部分专家通常推荐在MG确诊的前3年内行胸腺切除术[4,6]。
围手术期注意事项 — 有时术后会出现一过性的肌无力症状加重。已报道了与术后肌无力危象或需要长期机械通气相关的数个因素[38-41],包括:
●术前呼气肌无力
●术前肺活量小于2.0L
●术前有延髓相关症状
●术前有肌无力危象病史
●术前血清AChR抗体水平大于100nmol/L
●术中失血量大于1000mL
对于存在上述不良预后因素的患者,术后期应格外警惕。
对于术前有呼吸系统症状或延髓症状的患者,应在术前采用一种快速免疫治疗,即血浆置换或静脉用免疫球蛋白。这通常足以使患者顺利度过术后期。
在一般情况下,拟行胸腺切除术MG患者的手术指征、手术时机及术前术后管理应由外科医生与神经科医师或其他有MG专业知识的医生密切协作完成。
总结与推荐
●重症肌无力(MG)有4种基本疗法:对症治疗(抗胆碱酯酶药物)、慢速免疫治疗(糖皮质激素和其他免疫抑制药物)、快速免疫治疗(血浆置换和静脉用免疫球蛋白)、手术治疗(胸腺切除术)。
●胸腺切除术治疗乙酰胆碱受体(AChR)抗体阳性非胸腺瘤MG患者的依据与如下观察发现有关:胸腺可能在肌无力的发病机制中发挥作用,多数MG患者存在胸腺异常。所有合并胸腺瘤的患者均需进行胸腺切除术。
●一项随机对照试验的结果显示,对非胸腺瘤AChR抗体阳性MG患者进行胸腺切除术可改善临床结局。此外,来自非随机研究的较早期数据显示,胸腺切除术使患者转为无症状性或实现无药缓解的可能性约增至2倍,其中胸腺切除术后5年时实现无药缓解的中位比率为25%-50%。然而,胸腺切除术的益处不是立竿见影的,胸腺切除术不是一种治愈性疗法。
●胸腺切除术治疗MG的最佳时机尚不确定。然而,如果可能,最好在合理控制MG且延髓和呼吸系统症状极轻微的情况下手术,以免出现围手术期问题。
●我们有关胸腺切除术的推荐意见如下:
•如果可切除,无论MG的状态如何(如,全身型、延髓型、眼肌型),所有合并胸腺瘤的患者均需进行胸腺切除术。胸腺瘤的治疗包括完全切除术,如果不能完全切除,可通过放疗缓解肌无力症状并预防肿瘤局部浸润。
•对于60岁以下的非胸腺瘤全身型AChR抗体阳性MG患者,我们推荐进行胸腺切除术(Grade 1B)。
•对于60岁以下的非胸腺瘤全身型血清学阴性[即,无可检出的AChR抗体或肌肉特异性受体酪氨酸激酶(MuSK)抗体]MG患者,我们建议进行胸腺切除术(Grade 2C)。
•对于非胸腺瘤全身型MuSK抗体阳性MG患者,以及60岁及以上患者中的大多数,我们建议不进行胸腺切除术(Grade 2C)。
●胸腺切除术对眼肌型MG的作用存在争议。
●对于术前有呼吸系统症状或延髓相关症状的患者,我们建议在行任何手术之前给予一种快速免疫治疗(即,血浆置换或静脉用免疫球蛋白)(Grade 2C)。接受胸腺切除术的MG患者的围手术期管理应由外科医生与神经科医师或其他有MG专业知识的医生密切协作完成。
●在无明显胸腺瘤的情况下,有几种不同的手术方式可供使用。胸腺切除术的目标是在安全前提下尽可能多地切除胸腺组织。这包括胸腺本身,以及前纵隔脂肪组织中任何潜在的包膜外胸腺组织。有关胸骨切开术式是否比侵入性更小的术式(如,经颈扩大术式或电视辅助术式)更好,目前尚未达成共识。
参考文献
- Silvestri NJ, Wolfe GI. Myasthenia gravis. Semin Neurol 2012; 32:215.
- Kim JY, Park KD, Richman DP. Treatment of myasthenia gravis based on its immunopathogenesis. J Clin Neurol 2011; 7:173.
- Romi F. Thymoma in myasthenia gravis: from diagnosis to treatment. Autoimmune Dis 2011; 2011:474512.
- Skeie GO, Apostolski S, Evoli A, et al. Guidelines for treatment of autoimmune neuromuscular transmission disorders. Eur J Neurol 2010; 17:893.
- Jani-Acsadi A, Lisak RP. Myasthenia gravis. Curr Treat Options Neurol 2010; 12:231.
- Kumar V, Kaminski HJ. Treatment of myasthenia gravis. Curr Neurol Neurosci Rep 2011; 11:89.
- Sanders DB, Wolfe GI, Benatar M, et al. International consensus guidance for management of myasthenia gravis: Executive summary. Neurology 2016; 87:419.
- Wolfe GI, Kaminski HJ, Aban IB, et al. Randomized Trial of Thymectomy in Myasthenia Gravis. N Engl J Med 2016; 375:511.
- Gronseth GS, Barohn RJ. Practice parameter: thymectomy for autoimmune myasthenia gravis (an evidence-based review): report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology 2000; 55:7.
- Cea G, Benatar M, Verdugo RJ, Salinas RA. Thymectomy for non-thymomatous myasthenia gravis. Cochrane Database Syst Rev 2013; :CD008111.
- Diaz A, Black E, Dunning J. Is thymectomy in non-thymomatous myasthenia gravis of any benefit? Interact Cardiovasc Thorac Surg 2014; 18:381.
- Taioli E, Paschal PK, Liu B, et al. Comparison of Conservative Treatment and Thymectomy on Myasthenia Gravis Outcome. Ann Thorac Surg 2016; 102:1805.
- Riggs KR, Gutmann L, Riggs JE. Discordant thymectomy in identical twins concordant for myasthenia gravis. Ann Intern Med 2011; 155:478.
- Barnett C, Katzberg HD, Keshavjee S, Bril V. Thymectomy for non-thymomatous myasthenia gravis: a propensity score matched study. Orphanet J Rare Dis 2014; 9:214.
- Jaretzki A, Steinglass KM, Sonett JR. Thymectomy in the management of myasthenia gravis. Semin Neurol 2004; 24:49.
- Saperstein DS, Barohn RJ. Management of myasthenia gravis. Semin Neurol 2004; 24:41.
- Shrager JB, Deeb ME, Mick R, et al. Transcervical thymectomy for myasthenia gravis achieves results comparable to thymectomy by sternotomy. Ann Thorac Surg 2002; 74:320.
- Mao Z, Hu X, Lu Z, Hackett ML. Prognostic factors of remission in myasthenia gravis after thymectomy. Eur J Cardiothorac Surg 2015; 48:18.
- Guillermo GR, Téllez-Zenteno JF, Weder-Cisneros N, et al. Response of thymectomy: clinical and pathological characteristics among seronegative and seropositive myasthenia gravis patients. Acta Neurol Scand 2004; 109:217.
- Guptill JT, Sanders DB, Evoli A. Anti-MuSK antibody myasthenia gravis: clinical findings and response to treatment in two large cohorts. Muscle Nerve 2011; 44:36.
- Sonett JR, Jaretzki A 3rd. Thymectomy for nonthymomatous myasthenia gravis: a critical analysis. Ann N Y Acad Sci 2008; 1132:315.
- Orsini B, Santelmo N, Pages PB, et al. Comparative study for surgical management of thymectomy for non-thymomatous myasthenia gravis from the French national database EPITHOR. Eur J Cardiothorac Surg 2016; 50:418.
- Jaretzki A 3rd, Aarli JA, Kaminski HJ, et al. Thymectomy for myasthenia gravis: evaluation requires controlled prospective studies. Ann Thorac Surg 2003; 76:1.
- Jaretzki A 3rd, Wolff M. "Maximal" thymectomy for myasthenia gravis. Surgical anatomy and operative technique. J Thorac Cardiovasc Surg 1988; 96:711.
- Masaoka A. Extended trans-sternal thymectomy for myasthenia gravis. Chest Surg Clin N Am 2001; 11:369.
- Papatestas AE, Genkins G, Kornfeld P, et al. Transcervical thymectomy in myasthenia gravis. Surg Gynecol Obstet 1975; 140:535.
- Bril V, Kojic J, Ilse WK, Cooper JD. Long-term clinical outcome after transcervical thymectomy for myasthenia gravis. Ann Thorac Surg 1998; 65:1520.
- Calhoun RF, Ritter JH, Guthrie TJ, et al. Results of transcervical thymectomy for myasthenia gravis in 100 consecutive patients. Ann Surg 1999; 230:555.
- Meyers BF, Cooper JD. Transcervical thymectomy for myasthenia gravis. Chest Surg Clin N Am 2001; 11:363.
- Zieliński M, Kuzdzal J, Szlubowski A, Soja J. Comparison of late results of basic transsternal and extended transsternal thymectomies in the treatment of myasthenia gravis. Ann Thorac Surg 2004; 78:253.
- Bachmann K, Burkhardt D, Schreiter I, et al. Long-term outcome and quality of life after open and thoracoscopic thymectomy for myasthenia gravis: analysis of 131 patients. Surg Endosc 2008; 22:2470.
- Meacci E, Cesario A, Margaritora S, et al. Thymectomy in myasthenia gravis via original video-assisted infra-mammary cosmetic incision and median sternotomy: long-term results in 180 patients. Eur J Cardiothorac Surg 2009; 35:1063.
- Pompeo E, Tacconi F, Massa R, et al. Long-term outcome of thoracoscopic extended thymectomy for nonthymomatous myasthenia gravis. Eur J Cardiothorac Surg 2009; 36:164.
- Tomulescu V, Sgarbura O, Stanescu C, et al. Ten-year results of thoracoscopic unilateral extended thymectomy performed in nonthymomatous myasthenia gravis. Ann Surg 2011; 254:761.
- Meyer DM, Herbert MA, Sobhani NC, et al. Comparative clinical outcomes of thymectomy for myasthenia gravis performed by extended transsternal and minimally invasive approaches. Ann Thorac Surg 2009; 87:385.
- Marulli G, Rea F, Melfi F, et al. Robot-aided thoracoscopic thymectomy for early-stage thymoma: a multicenter European study. J Thorac Cardiovasc Surg 2012; 144:1125.
- Khicha SG, Kaiser LR, Shrager JB. Extended transcervical thymectomy in the treatment of myasthenia gravis. Ann N Y Acad Sci 2008; 1132:336.
- Loach AB, Young AC, Spalding JM, Smith AC. Postoperative management after thymectomy. Br Med J 1975; 1:309.
- Gracey DR, Divertie MB, Howard FM Jr, Payne WS. Postoperative respiratory care after transsternal thymectomy in myasthenia gravis. A 3-year experience in 53 patients. Chest 1984; 86:67.
- Younger DS, Braun NM, Jaretzki A 3rd, et al. Myasthenia gravis: determinants for independent ventilation after transsternal thymectomy. Neurology 1984; 34:336.
- Watanabe A, Watanabe T, Obama T, et al. Prognostic factors for myasthenic crisis after transsternal thymectomy in patients with myasthenia gravis. J Thorac Cardiovasc Surg 2004; 127:868.
原文链接:http://www.xxwk.net/archives/1785