摘要
目的 为了研究PERCIST1.0对预测新辅助化疗和预后的肿瘤反应的有用性,并确定对于食管鳞状细胞癌(ESCC)患者是否需要改善PERCIST。
病例以及研究方法 我们分析了177例ESCC患者的病例,并检查了PERCIST与其病理反应之间的关联。通过Kaplan-Meier分析和Cox比例风险模型评估了全PERCIST与无进展生存期(PFS)和总生存期(OS)的关联。为了研究PERCIST的潜在改进,我们使用了生存树技术来了解患者的预后。
结果 病理反应与原发性肿瘤的PERCIST之间存在显著相关性(p <0.001)。对原发肿瘤的SUL峰反应进行分类以对病理反应进行分类的最佳临界值为-50.0%。SUL峰反应的诊断准确性为87.3%灵敏度,54.1%特异性,68.9%准确性,阳性预测值60.5%和阴性预测值84.1%。Whole-PERCIST与PFS和OS显著相关。生存树结果表明,整个SUL峰响应的大幅降低与患者的预后密切相关。对于PFS,预后分离的临界值为-52.5%,对于OS为-47.1%。
结论 PERCIST1.0可以帮助预测肿瘤反应和预后。然而,F-FDG-PET / CT在组织病理学反应评估中往往低估了残留的肿瘤。改良的PERCIST(通过SUL峰反应(-50%)进一步对部分代谢反应进行分类)可能比PERCIST1.0更适合评估肿瘤反应并将高危患者按复发和不良预后分层。
简介
食道癌是全球第八大最常见的癌症。在日本,经食管切除术治疗的食道癌的5年生存率估计为54.5%。食管癌伴病理性淋巴结转移(LNMs)的复发率显著较高,为40%–70%。抑制这种癌症术后复发并提高患者生存率的努力包括使用新辅助放化疗(NACT),这是西方国家的标准疗法,已被证明可以提高完全切除率和生存率。另一种有希望的治疗方法:一项日本临床肿瘤学小组试验(JCOG9907)证明,与术后化疗组相比,NAC组的总生存时间明显更长,并且没有其他严重的不良事件。
在日本,鳞状细胞癌(SCC)是食管癌的主要组织学类型,在所有病例中,约有90%经常伴有在颈部,胸部和腹部的广泛淋巴结转移。因此,在SCC病例中经常进行颈部,纵隔和上腹部区域的淋巴结清扫术。根据日本食道学会诊断和治疗食道癌的指南,强烈建议将NAC作为晚期食道癌的有效治疗方法。哪个临床问题是更好的选择——NAC或NACT——尚未得到解答,并且日本正在进行一项随机对照试验。
伴随着实体瘤中反应评估标准(RECIST)的使用,计算机断层扫描(CT)和内窥镜检查目前也被广泛应用于评估肿瘤反应。但是,由于食管的管腔结构,食管肿瘤是无法使用RECIST标准进行测量的病变,在RECIST1.1中,只有短轴长度> 15 mm的淋巴结才可测量。因此,RECIST标准可能不适用于转移灶较小的食管癌淋巴结转移评估。在食管癌评估中,有时难以使用RECIST标准评估肿瘤反应。此外,NAC并不总是对所有食道癌患者有益。
食管癌患者需要鉴定出更具选择性的生物标志物以预测肿瘤反应和预后。氟18氟脱氧葡萄糖正电子发射断层扫描/计算机断层扫描(F-FDG-PET / CT)已显示出对肿瘤抗癌疗法反应的半定量分析和视觉评估的临床前景,尽管食管癌尚无解剖学变化。Wahl等人提倡应用PERCIST1.0评估2009年的代谢性肿瘤反应。几个研究小组已经证明,PERCIST可能适合评估食管癌患者对NAC的肿瘤反应和随后的预后,但据我们所知,这些研究是单中心研究,以及PERCIST在临床上的有用性和有效性与NAC后手术切除的关系尚未在一项多中心研究中充分探究。我们在日本进行了本项多中心研究,以确定PERCIST是否可用于预测肿瘤对NAC的反应和预后,并探讨是否需要对食管鳞状细胞癌(ESCC)患者使用PERCIST进行改进。
病例选择以及研究方法
病例选择
我们收集了257例食管癌患者的病例,这些患者在2008年2月至2016年3月期间在日本的7家医院手术前后接受了NAC并接受了18 F-FDG-PET / CT手术切除(鹿儿岛大学医学院,鸟取大学,北海道大学全球健康与医学国家中心和仓敷市中心医院)。该研究排除了转移至其他远处器官的患者(n = 3),临床病理数据不足(n = 41)和可用于PET / CT的数据(n = 27)。非鳞状细胞癌(non-SCC)(n = 9)的患者也被排除在外,因为非SCC的患者很少。接受术前NACT或放化疗(CRT)的患者不包括在本研究中。
我们的最终研究人群为177名ESCC患者,中位年龄为66岁(范围38-78)。自2017年以来已使用第八版TNM分期; 然而,由于目前患者的分期和治疗是根据第七版TNM分期确定的,因此我们在本次调查中使用了国际癌症控制联盟(UICC)指南的第七版。
研究方案是根据赫尔辛基宣言进行的,并得到了七个机构的审查委员会/伦理委员会的批准,由于研究的回顾性设计,该委员会放弃了书面知情同意的需要。(兵库医学院伦理审查委员会;鹿儿岛大学医学与牙科科学研究生院流行病学伦理委员会,欧洲医学杂志,影像学研究;鸟取大学伦理审查委员会;国家全球卫生与医学中心机构审查委员会;北海道大学临床研究机构审查委员会;仓敷市立医院医学伦理委员会。)
18 F-FDG-PET/CT
集成的PET / CT扫描仪用于数据采集:Biograph / Somatom Emotion Duo(西门子医疗,德国埃尔兰根),Discovery 600 M(GE Healthcare,美国威斯康星州沃基沙),Aquidio-16(东京都东芝),GEMINI GXL16(飞利浦医疗系统,荷兰埃因霍温),GEMINI TF64(飞利浦医疗系统),Biograph mCT(西门子医疗)和Biograph 64(西门子医疗)。CT数据是在呼气过程中在正常呼气位置获取的,并用于衰减校正和病变定位。图像使用标准重建协议得以重建,而该标准基于标准子集期望最大化方法(OSEM),响应线行动作最大似然算法(LOR-RAMURA)或傅里叶重组(FORE)。检查前患者禁食≥4小时。所有患者的血糖水平均不超过200 mg / dL。
对于影像学检查,所有患者均通过肘前静脉给予2.5-5.0 MBq / kg体重的剂量,并被告知F-FDG注射后要安静地休息约60分钟。从开始的18F-FDG-PET / CT到开始NAC的中位持续时间为12天(范围为0-56天)。从第二次18F-FDG-PET / CT到完成NAC或手术切除之间的中位持续时间分别为18天(范围7–54天)和12天(范围1–81天)。
18 F-FDG-PET/CT图像分析
使用市售软包装GI-PET(东京AZE公司)分析了患者的18张F-FDG-PET / CT图像,该软包装能够协调不同PET / CT系统之间的标准化摄取值(SUV)。并使用PERCIST量化患者的治疗反应。两位具有17年F-FDG-PET / CT经验的董事会认证的核医学医师(H.K.和K.K)回顾性地对患者的数据进行了解释和分析,取得了共识。在原发性肿瘤或淋巴结转移的异常摄取的每个部位上,半自动在轴向图像上绘制易激发的体积(VOI)。通过与相邻的18个F-FDG-avid结构,生理摄取或病变重叠,手动调整每个VOI的边界。
根据患者的第一次和第二次扫描结果以及术后组织病理学结果确定18 F-FDG摄取阳性淋巴结转移。食管旁或其他纵隔,锁骨下和腹部淋巴结吸收18 F-FDG的量大于背景中的基本动静活动,被认为具有转移性。SUV峰值的计算是在每个患者最热的部位的1.2厘米直径内的易激发区域(ROI)中进行的,然后将其归一化为与日本人匹配的峰值(SUV峰值×[瘦体重] / [总体重])。
每位患者的瘦体重都是根据已发布的公式计算得出的。我们还使用SUL峰值来确定给定肿瘤的该值是否是正常右肝叶中直径为3厘米的球形ROI的平均肝脏SUL值的±2倍标准差(SD)的1.5倍。代谢肿瘤体积(MTV)被定义为18 F-FDG-avid肿瘤,其阈值大于等于1.5倍的平均肝SUL值±2SD。然后计算总病变糖酵解(TLG)。随后自动计算并记录每个参数的减少百分比。
PERCIST
根据PERCIST确定每个患者的治疗反应。这些反应评估标准如下:完全代谢反应(CMR)定义为病变内18 F-FDG摄取的完整分辨率,其水平低于平均肝脏活性,并且与周围背景也没有区别,没有新的常见的18F-FDG-avid病变的模式。部分代谢反应(PMR)定义为在基线时可评估的最强目标病变与随后确定的最强烈可评估的目标病变之间相比SULpeak值降低≥30%和SUL绝对降低≥0.8SUL单位,或者增大幅度不超过SUL的30%或所有其他病变的大小。进行性代谢性疾病(PMD)定义为18 F-FDG摄取的SULpeak增加30%,肿瘤SUL增加> 0.8 SUL单位,TLG增加> 75%或出现一种或多种新的18 F-FDG-avid病变典型的癌症,该类疾病与治疗效果或感染无关。稳定代谢疾病(SMD)定义为不符合CMR,PMR或PMD的疾病。
我们评估了每个患者原发肿瘤的PERCIST状态和整个PERCIST状态,主要根据NAC前后原发肿瘤的SUL反应率获得每个原发肿瘤的PERCIST状态,并基于主要是从所有患者病变中最高的SUL病变获得的整个SUL响应率,包括在NAC之前和之后对Eur J Nucl Med Mol成像的原发性肿瘤和淋巴结转移。为了进行补充分析,从NAC之前和之后的原发肿瘤的这些代谢性病变或所有病变的最高摄取病变中获取原发性病变和整个病变的TLG和MTV的缓解率。当存在多个病变时,最多选择五个最热的病变并通过GIPET软件自动进行评估,并选择最差的客观反应进行PERCIST的测定。该软件自动确定治疗评估。两位核医学医师对18个F-FDG-PET / CT数据进行了解释和分析,检查了通过此算法获得的这些结果数据,他们确认了这些结果在临床上是适合理的。
组织病理学评估
根据TNM分类将组织病理学发现分类为:病理性T期(pTstage),然后是病理性LNM的数量,淋巴管浸润的存在(Ly0,阴性;Ly1-3,阳性),静脉浸润( V0,阴性;V1-3,阳性)和切除水平(R0,完全切除肿瘤;非R0,微观残留肿瘤[R1];宏观残留肿瘤[R2])。
NAC对食管癌的组织病理学效果被摘录到日本食道疾病学会《 2008年食管癌临床和病理学指南》(第10版),并且根据原发肿瘤的程度评估了组织病理学效果回归分析如下:0级,整个病变均无明显坏死或细胞或结构改变。1a级,坏死或肿瘤缩小到整个病变的三分之一以下,或仅细胞或结构变化以不同的量存在;1b级,坏死或肿瘤缩小到不超过整个病变的三分之二;2级,坏死或肿瘤缩小至整个病变的三分之二以上,但仍有存活的肿瘤细胞;3级,整个病变坏死和/或被纤维化所取代,有或没有肉芽肿性改变(不存在活的肿瘤细胞)。我们将177例患者分为两个病理反应组:病理反应(1b,2和3级)组和病理反应(0和1a级)组。
统计分析
我们通过频率或中位数和范围的汇总统计来总结临床病理因素。肯德尔(Kendall)的秩相关检验用于检验原发肿瘤的PERCIST状态与病理反应等级之间的关联。对于患者原发性肿瘤的PERCIST状态,我们使用卡方检验研究了代谢反应状态(CMR,PMR)与非代谢反应状态(其他)和病理反应之间的关系。使用Mann-Whitney U检验分析了原发性肿瘤的SULpeak,TLG和MTV反应与病理反应之间的关联。我们确定了接受者的操作特征(ROC)曲线,并用原发性肿瘤的这三个指标的截止值以及最大的Youden指数来区分病理性反应者和非病理性反应者。使用DeLong检验分析了ROC曲线下面积(AUC)之间差异的显著性。
无进展生存期(PFS)定义为从患者NAC起始日期到疾病复发日期的持续时间。总生存期(OS)定义为NAC起始日期与肿瘤致死亡之间的持续时间。
我们使用Kaplan-Meier(KM)方法和单变量Cox比例风险模型评估了整个病变的PERSIST状态和SULpeak反应的预后能力,以及临床病理因素。为了表征整个PERCIST状态的预后能力,我们还使用Cox比例风险模型进行了多变量分析。我们优先考虑整体PERCIST,因为该指标包括从NAC之前和之后的原发肿瘤和淋巴结转移中获得的18F-FDG摄取病变。可以得出淋巴结转移中18 F-FDG摄取阳性与不良预后有关。我们使用原发性肿瘤的PERCIST状态进行组织病理学检查,但该指标不能始终准确地预测预后。如上所述,PERCIST状态主要由SULpeak响应确定。多变量分析的重点是整体PERCIST状态,因此,为了避免共线性,我们没有将SULpeak响应纳入Cox比例风险模型。我们将前向变量选择与Akaike信息准则(AIC)结合使用,并从仅使用整体PERCIST状态的空模型开始。
我们进行了两种类型的前向选择多变量分析。使用以下术前危险因素构建模型1:年龄,性别,位置,临床T期(cT期),临床N期(cN期)和临床M期(cM期)。使用术前和术后危险因素(术后因素:pT分期,病理学LNM数量,Ly,V和切除水平)构建模型2,以确定整个PERCIST状态是否是术前预后因素和/或术后预后因素。
我们使用了生存树技术来表征患者的预后。在生存树技术中,对患者进行递归划分。我们首先根据所有变量和临界值的对数秩检验的结果,使用最实质的Eur J Nucl Med Mol成像对预后进行分类,将所有患者分为两个亚组。对于预后最佳分离的两个结果亚组中的每个亚组,均以相似的方式进行进一步划分。通过递归地应用这种划分,生成了多个亚组,在每个亚组中,患者的预后是同质的,而在各个患者之间的预后是不均匀的。递归划分一直进行到满足某个统计标准为止,以避免创建受试者人数不足的亚组,这可能导致对亚组特异性疗效的估计不稳定。如概述的那样,生存树分析非常简单,并且没有复杂的统计模型。递归应用简单的两样本对数秩检验。该分析有助于以简单的分类树形式掌握患者的复杂预后结构,并且在临床研究中具有多种应用。
由于其简单性,生存树技术没有共线性问题。因此,我们能够将PERCIST的状态和SULpeak对整个病变的反应(以及其他因素)结合起来,以解决它们的相对重要性。KM曲线和对数秩检验用于对比通过生存树技术确定的预后亚组。使用SPSS Statistics 22软件,R v3.4.1进行统计分析。可从https://cran.rroject.org/bin/windows/base/old/3.4.1/和Rver.3.86(Rcoreteam)下载。使用Party和Survival的Th-e R软件包进行生存树分析,并且AIC函数这一步骤用于执行多变量Cox回归分析。所有其他分析都是使用SPSSS tatistics 22软件和R v3.4.1进行的。
结果
PERCIST状态与病理反应之间的相关性
表1总结了我们ESCC患者人群的特征,包括原发肿瘤的整体PERCIST和PERCIST结果。外科手术包括食管全切术,两场或三场淋巴结肿大和胃管重建术。
在177例患者中,有10例观察到原发肿瘤的整体PERCIST状态与PERCIST状态之间存在差异。10名患者的特征显示在表2中。在所有10名患者中,整体PERCIST的评估均差于原发性肿瘤,并且10名患者中的一名在NAC后出现了新的淋巴结转移。
有79名病理反应者和98名非病理反应者。通过Kendall秩相关检验,原发性肿瘤的PERCIST状态与病理反应之间存在显着相关性(r = 0.320,p <0.001)(表3)。原发性肿瘤的PERCIST状态与病理反应的符合率为63.3%(112/177)。原发性肿瘤代谢反应者(CMR或PMR)中病理反应者的数量显著高于原发性肿瘤非代谢反应者(代谢反应者,55.2%(74/130);非代谢反应者,11.6%(5 /43),p<0.001)。病理反应者中原发性肿瘤的SULpeak,TLG和MTV的中位反应率分别为-76.9%(范围-100%至4.87%),-94.5%(范围-100至-11.6%)和-93.4 %(− 100至118.9%),非病理反应者的相应值明显较差,分别为−46.4%(−100%至71.0%),− 87.7%(−100至187.3%)和− 71.7%(− 100%至163.4%)(所有P均<0.001)。
表4总结了原发性肿瘤三个指标的最佳临界值,AUC和对病理反应者状态的诊断性能。用于诊断18 F-FDG-PET / CT以预测病理反应者的AUC为:这三个指标均具有显著性(所有p均<0.001)。但是,这些参数之间的AUC没有显着差异(每个p> 0.05)。关于这三个指标的病理反应者状态的诊断性能范围如下:敏感性75.9–87.3%,特异性48.0–60.2%,准确性68.9–75.9%,阳性预测值(PPV)54.1–63.6%和阴性预测值(NPV)71.2–84.3%。
PERCIST状态与生存之间的相关性
表5和表6提供了OS和PFS的Cox比例风险模型的结果。在PFS的单变量分析中,以下因素与复发密切相关:整体PERCIST状态,整体SULpeak响应,pT分级, 病理LNM的数量,病理反应,淋巴管浸润,cN分期,cM分期,静脉浸润和切除水平。在多变量分析中,整体PERCIST状态和cN分期是模型1复发的重要预后因素(整体PERCIST状态:危险比[HR] 0.617,p = 0.002,cN分期:HR 1.732,p = 0.016)。然而,在模型2中,整体PERCIST状态不是复发的重要预后因素(HR0.812,p = 0.215),复发的重要预后因素是病理LNM的数目,cN分期,静脉浸润和切除水平(每个p <0.05)。
关于患者的OS,在单因素分析中,整体PERCIST状态,整体SULpeak反应,pT分期,病理LNM数量,淋巴管浸润,cN分期和静脉浸润与OS显著相关。在多变量分析中,整体PERCIST状态是两个模型中OS的重要预后因素(模型1的HR = 0.534,p <0.001,模型2的HR = 0.672,p = 0.029)。在模型1中,cT分期和cM分期是重要的预后因素,在模型2中,病理LNM的数量和静脉浸润是OS的重要预后因素(每个因素p <0.05)。
生存树分析和PERCIST的潜在改进
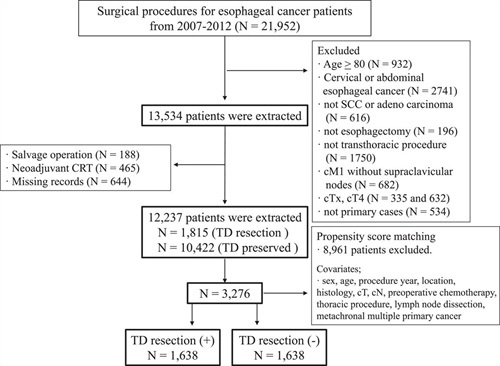
我们应用了表5中列出的变量的生存树技术。其中,最重要的是SULpeak反应,PERCIST,TLG和MTV,其他因素是已知的预后因素。PFS和OS的生存树分析结果显示在图1和2。对于PFS,选择了病理LNM的数量和整个SULpeak反应。生存树技术将病理学LNM的数量(≥3与其他情况相比)确定为第一个分配变量,≤2的子群体(作为病理LNM的数量)通过临界值进一步分为两个子群体,即占整个SULpeak响应的-52.5%。总之,我们确定了三组,其中病理LNM数量较多(≥3)的患者的PFS最短,病理LNM数量较少(≤2)的患者的PFS降低大于-52.5%。整个SULpeak反应的PFS最长(图1)。
表7总结了通过生存树分析确定的三个PFS预后组的基线特征(即图1中的A–C组)。A组的生存率最差,并且包括具有三个以上病理LNM的ESCC患者。与其他两组相比,A组的阳性静脉侵袭和死亡比率均更高。B组表现出相反的特征。
关于患者的OS,除了整个SULpeak反应外,还选择了cN分期和pT分期作为OS的预测指标。通过生存树算法确定了四组,整个SULpeak响应降低百分比的临界值定义为-47.1%(图2)。在这四组中,整体SULpeak响应降低百分比大于-47.1%的患者的生存率最差,而整体SULpeak响应降低百分比小于-47.1%的患者却具有最低的生存率。晚期pT生存率次之。其他两组的预后较好。
表8总结了通过生存树分析确定的OS的四个预后组的基线特征(即图2中的A–D组)。尽管所有D组患者的两种PERCIST状态的结果均为代谢反应,但D组包括更多患有pT3期和病理性LNM的ESCC患者。GroupA的非代谢反应,复发和静脉浸润阳性的百分比很高。C组是最佳的生存组,复发率和静脉侵袭阳性率均较低。
尽管这两个树模型中的预测指标并不完全相同,但结果表明,使用- 50%的临界值,整体SULpeak响应降低的百分比有助于一致地区分ESCC患者的PFS和OS预后。该发现与PERCIST定义不一致,在该定义中,将SULpeak响应降低百分比的临界值-30%用于对PMR和SMD进行分类。
基于生存树分析的上述发现,我们检查了PERCIST的修改版本。通过使用整个SUL峰值响应的临界值-50%,将PERCIST方案中的部分代谢反应(PMR)进一步分为两个子类,我们定义了改进的PERCIST,如下所示:PMR(SULpeak响应> -50)和PMR (SULpeak响应≤−50)。
由PERCIST分离的KM曲线和由我们改进的PERCIST方案分离的KM曲线在图5和6中显示。PFS和OS分别为图3和4。从这些图中可以看出,两个修改的PMR子类之间的PFS和OS不相同(它们基于SULpeak响应的降低百分比> -50或≤-50)。SULpeak反应降低幅度较大的患者生存期较长,复发概率较低(与CMR状态接近),而SULpeak反应降低幅度较低的患者则相反,即生存期较短,复发率较高。此外,我们创建了包括其他疾病死亡在内的OS的KM曲线,以分别确认我们改良的PERCIST的意义(补充数据),这与图4非常相似。该结果表明,基于−50%的PERCIST的改良SULpeak反应的降低百分比可能有助于对ESCC患者的预后进行更精确的分类。代表性的病例情况如图5和图6所示。
讨论
几项研究表明,PERCIST在预测对CRT和NACT的肿瘤反应以及食管癌患者的预后方面很有用。SUVmax,MTV,TLG和视觉分析已用于研究肿瘤18 F-FDG摄取与对NAC的病理反应之间的相关性。但是,这些研究大多数集中在评估原发肿瘤中18 F-FDG的摄取。据报道,NAC后淋巴结中18 F-FDG摄取阴性可预测可切除的胸膜ESCC患者的无复发生存期更长,而NAC后淋巴结中18 F-FDG摄取状态是评估预后的关键NAC治疗标准。
其他研究人员认为,病理LNM的数量是与接受NAC的食管癌患者全身疾病和生存相关的独立因素。基于单独的调查,我们确定了目前所有177例ESCC患者的整体PERCIST状态和原发肿瘤的PERCIST状态:在177例患者中有10例观察到这两个指标之间存在差异,并且对整体PERCIST的评估在所有10例患者中均比原发性肿瘤差。据我们所知,在对ESCC患者的多中心研究中,尚无相关报道是基于18 F-FDG摄取在原发性肿瘤和淋巴结转移中获得的PERCIST的有用性和有效性与肿瘤对NAC的反应预测和预后的。
我们目前的分析显示,在原发性肿瘤的PERCIST状态与病理反应之间存在显着相关性,在病理反应者和无反应者之间,原发性肿瘤三个指标的减少百分率也存在显着差异。Tani等。报道指出,PERCIST状态与ESCC患者的病理反应之间的一致性率为63%,病理反应者和非病理反应者的SUVmax和MTV降低百分比存在显着差异。其他调查显示,食管癌患者的PERCIST状态与病理反应之间存在显着相关性,NACT的病理反应者和非病理反应者之间SULpeak,MTV和TLG的降低百分比显着更高。
关于区分病理性反应者和NAC的非病理性反应者,Odawara等人报道指出,SULpeak临界值降低的百分比为55.8%,灵敏度为77.8%,特异性为75.0%,与SUVmax和体积参数相比,SULpeak可能更适合于评估病理反应。然而,在本研究中,PERCIST与病理分级之间的相关性较低,并且关于原发性肿瘤的三个指标的病理应答者状态具有相对较低的特异性和较低的PPV。此结果归因于CMR和PMR的假阳性率高。CMR的高假阳性率表明残留肿瘤细胞在病理学上并不罕见,并且18 F-FDG-PET / CT由于空间分辨率有限,无法在小或低细胞残留肿瘤中检测到低糖代谢。
我们先前与PERCIST相关的多中心研究表明,NAC后乳腺癌患者对病理性完全应答的SULpeak反应表现出低特异性及低PPV。我们认为PERCIST可用于预测肿瘤反应,但是18 F-FDG-PET / CT在组织病理学反应评估中容易低估残留的肿瘤细胞。最近有报道称,弥散加权磁共振成像(DW-MRI)在区分NACT后食管癌残留肿瘤方面具有优势。18 F-FDG-PET / CT和DWI-MRI的结合可能有助于提高预测肿瘤反应的诊断准确性。
据我们所知,另外仅有一组人对PERCIST进行了调查,以评估接受过NAC的局部晚期ESCC患者的预后。柳川等人提示与非CMR患者相比,实现CMR患者的无病生存(DFS)和OS率明显更高,并且原发肿瘤的PERCIST状态是预测患者术前DFS和OS最重要的预后因素,尽管静脉浸润和切除水平也是重要的预测指标。在我们目前的研究中,根据患者的PERCIST状况,患者的PFS和OS显著不同。在术前风险模型中,对于患者,PFS和OS以及术前和术后风险模型中的OS,都显示出PERCIST的整体状态是重要的预后因素。在临床病理因素中,我们观察到静脉浸润和病理LNM是PFS和OS的重要预后因素。
对于仅接受手术的患者以及接受NAC的患者,病理LNM的数量是最重要的因素。Miyata等人认为,治疗后的淋巴结状况而非病理性肿瘤消退似乎可用于预测预后,ESCC加上接受过NAC的三个或三个以上病理性淋巴结转移患者,其全身转移和复发可能性超过50%。静脉侵袭的存在被认为是血行转移的重要的初始步骤,并且是不利的预后因素。Jeon等人报道静脉侵袭和高SUVmax值可能是ESCC患者的重要预后因素。我们目前的数据表明,PERCIST可用于预测患者术前和NAC后的预后,并且静脉浸润和病理LNM的数量是可用于预测预后的后处理因素。
这项研究相对于先前研究的优势在于,它使用生存树分析和KM分析检查了PERCIST是否适合分层NAC后ESCC患者的预后。我们的数据显示,用于区分PFS和OS的预后良好组与预后不良组的整个SULpeak反应的最佳截止值约为-50%。我们观察到基于原始PERCIST的SULpeak反应PMR患者组(−30%至-50%)是预后不良的人群和非代谢反应的人群,并且我们的分析结果表明,改良的PERCIST可以分层预后较差的ESCC患者,且PFS和OS比原始PERCIST更准确。
尚未发表使用SULpeak反应的临界值对ESCC患者预后进行分层的研究。其他研究报道,SUVmax比率降低≥50%的ESCC患者的5年生存率明显高于比率<50%的ESCC患者。其他研究人员表明,对于NAC的病理反应,SULpeak降低或SUVmax降低的最佳临界值分别为-55.8%或-56%,术前NACT的SULpeak和TLG降低的最佳临界值为分别为-55.7%和-98.1%。Ohsawa等人报告说,在NAC之前和之后从18 F-FDG-PET / CT获得的最佳SUVmax降低率是-40%,并且与无复发生存率(RFS)显著相关。Chang等人建议,术前CRT后连续18 F-FDG-PET / CT测量的TLG降低率(48%)是RFS和OS的有效预测指标。在对直肠癌患者的研究中,Avallone等人报告说,术前CRT治疗开始前和术后12天从18 F-FDG PET / CT获得的SUVmean降低率(52%)与复发的可能性相关。这些过去的发现均支持我们的数据。我们改良的PERCIST或许能比原始PERCIST更准确地反映出肿瘤反应和预后。
在本研究中,整个SULpeak反应,病理LNM的数量以及cN和pT分期使我们能够将PFS和OS预后良好与预后不良区分开。我们的数据表明,整个SULpeak反应≤−50%且病理LNM≤2或pT0-1期疾病的患者预后良好。整体SULpeak响应>−50%或≥3个病理LNM的患者和整体SULpeak响应<−50%且pT3-4阶段疾病的患者的预后较差。病理学肿瘤深度和病理学LNM数量已被描述为独立的预后因素,据报道,晚期(pT3-4)疾病患者比pT0-2疾病具有更多的全身转移性病变。尽管根据PERCIST判断这些患者已达到PMR,但应根据患者的pT分期和病理LNM的数量,考虑采取其他药物控制系统性复发和疾病转移。
我们的生存树分析结果并不总是与pT阶段相关。TNM分期目前是食管癌患者生存最有价值的预后因素。我们的生存树分析数据包括有关TNM分期和成像生物标志物的信息,这可能是有希望对高危患者进行分层的新预后因素,并且它们可能在决定接受NAC的ESCC患者的治疗中起关键作用。需要进一步的前瞻性研究来确定我们目前的数据是否可用于对ESCC患者进行分层。
如果PERCIST在手术前将ESCC患者判断为预后良好,则应进行积极的根治性手术切除。对于在手术前被判断为预后不良的ESCC患者,目前尚无有效的额外或替代治疗方法。至于有希望的附加治疗或替代治疗,对这些患者而言,术前癌症免疫疗法与化学疗法,术前放化疗,术后辅助性癌症特异性疫苗疗法或术后化疗的联合治疗可能是有效的。关于癌症免疫疗法,进行了一项随机双盲安慰剂对照III期研究(KEYNOTE-590),以评估派姆单抗联合化疗(5-FU +顺铂)与安慰剂联合化疗作为一线治疗的有效性和安全性。晚期食管癌或食管胃连接癌患者仍在进行中。另外,最近的辅助癌症特异性疫苗治疗已显示出比没有疫苗治疗的对照组患者显著更高的5年食管癌特异性生存率。在欧洲和北美,进行术前和术后化疗以治疗腺癌。在日本,尚未对接受过NAC +手术的患者术后化疗方案的有效性进行充分验证。如果这些治疗方法的临床效果得到证实,我们相信PERCIST可能在决定术前阶段的患者管理方面起着至关重要的作用。
有一些研究局限性要解决:(1)研究设计是回顾性的,因此存在选择偏倚的可能性;临床病理结果的产生同样受到限制。(2)由于多中心研究和回顾性设计,所纳入的NAC方案是异质的。(3)在这项研究中使用了五种不同的PET / CT仪器。我们统一了SUV值,以减少PET / CT仪器之间的差异。PERCIST的最终数据主要基于从相同的PET / CT仪器和协议进行的第一次和第二次PET / CT扫描获得的SULpeak响应进行检查。将来,应该对更多接受统一NAC方案的ESCC患者进行前瞻性研究,以探讨PERCIST的临床实用性和有效性。
总之,PERCIST1.0可用于预测ESCC患者的肿瘤反应和预后。但是,18 F-FDG-PET / CT在组织病理学反应评估中容易低估残留的肿瘤细胞,与PERCIST1.0相比,我们使用SULpeak反应截止值(-50%)重新定义PMR的改良PERCIST可能是更适合评估NAC后肿瘤反应和对高危ESCC患者进行复发和预后不良的分层。
我们明确声明,人类参与者已获得包括赫尔辛基宣言在内的适当名称的道德委员会的批准。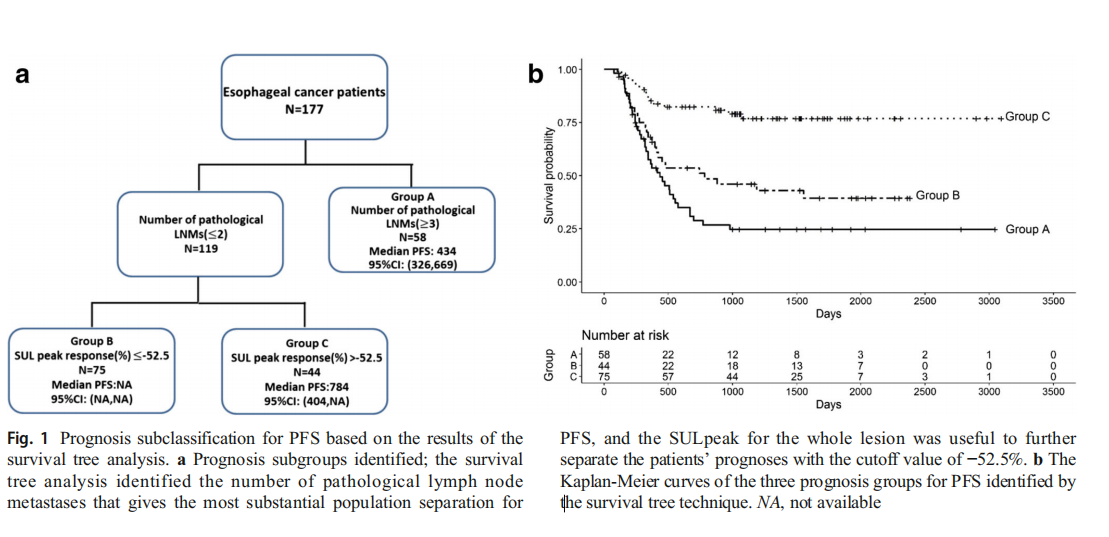
图1基于生存树分析结果的PFS的预后分类。
a预后亚组确定;生存树分析确定了病理性淋巴结转移的数量,这些淋巴结转移可实现PFS的最大分离,整个病变的SULpeak有助于进一步区分患者的预后,其临界值为-52.5%。
b通过生存树技术确定的PFS的三个预后组的Kaplan-Meier曲线。
NA,不适用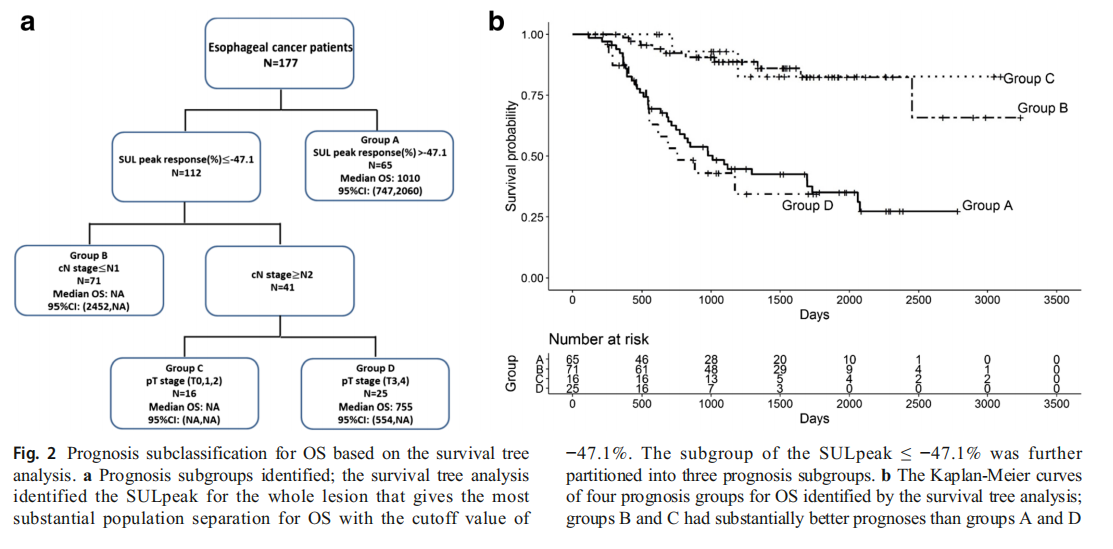
图2基于生存树分析的OS预后子分类。
a预后亚组确定;生存树分析确定了整个病变的SULpeak,它为OS提供了最实质性的群体分离,临界值为−47.1%。SULpeak≤-47.1%的亚组进一步分为三个预后亚组。
b通过生存树分析确定的OS的四个预后组的Kaplan-Meier曲线;B和C组的预后比A和D组好得多
图3通过全PERCIST状态评估ESCC患者的PFS(a)和OS(b)生存功能的Kaplan-Meier(KM)估计。显示了整个PERCIST状态之间的显著差异(PFS,p = 0.025,OS,p = 0.0068)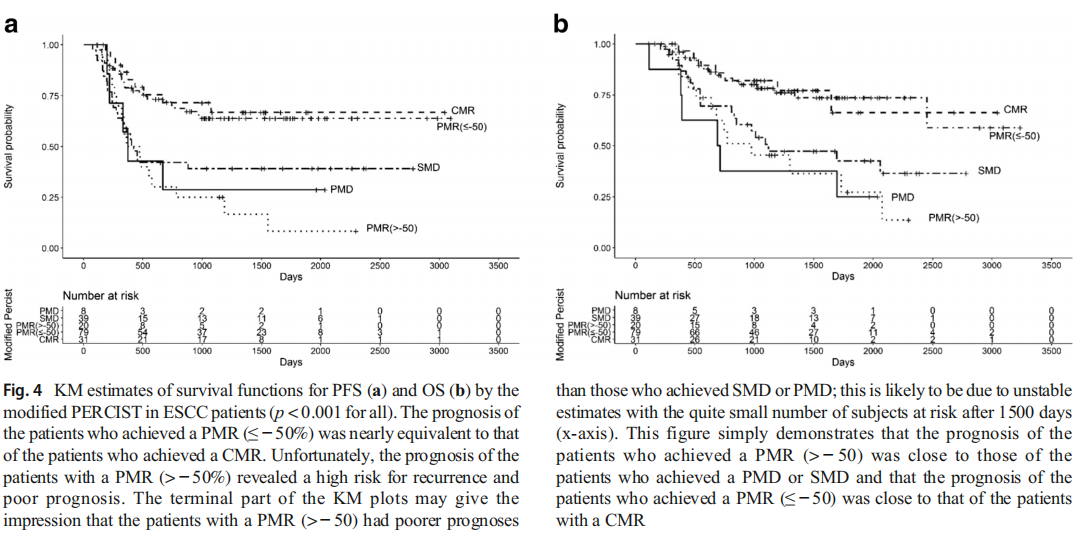
图4.改良的PERCIST在ESCC患者中对PFS(a)和OS(b)的生存功能的KM估计(全部p <0.001)。
达到PMR的患者(≤-50%)的预后与达到CMR的患者的预后几乎相同。不幸的是,患有PMR(> -50%)的患者的预后显示出复发的高风险和不良的预后。KM图的末端部分可能给人的印象是,PMR(> -50)的患者预后较达到SMD或PMD的患者差;这很可能是由于估算值不稳定,在1500天后(x轴)有相当多的受试者处于危险之中。该数字仅表明达到PMR(> − 50)的患者的预后接近达到PMD或SMD的患者的预后,而达到PMR(≤−50)的患者的预后与患有CMR的患者接近。
图5一名61岁的ESCC患者(cT3N2M0 IIIB期)。
NAC之前他的中位胸原发肿瘤(白色箭头)和右复发神经淋巴结转移(红色箭头)的SULpeak值分别为8.7和3.2,NAC之后的SULpeak值分别为2.1和1.8。基于整体SULpeak响应(-75.5%),perfect-PERCIST的响应状态为PMR。
具有(a)最大强度投影(MIP)图像和(b,c)轴向图像的基线18 F-FDG-PET / CT。NAC 18 F-FDG-PET / CT之后的(d)MIP图像和(e,f)轴向图像。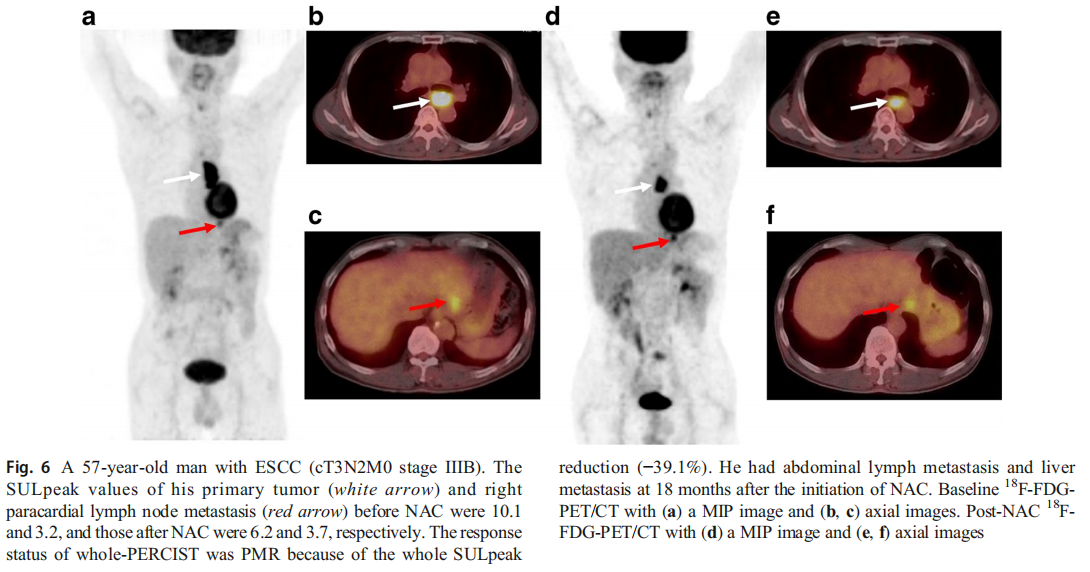
图6一名57岁的ESCC患者(cT3N2M0 IIIB期)。NAC之前他的原发肿瘤(白色箭头)和右心包旁淋巴结转移(红色箭头)的SULpeak值分别为10.1和3.2,NAC之后的SULpeak值分别为6.2和3.7。由于整个SULpeak减少(-39.1%),整个PERCIST的反应状态为PMR。NAC开始后18个月,他发生了腹部淋巴结转移和肝转移。
(a)MIP图像和(b,c)轴向图像的基线18 F-FDG-PET / CT。NAC 18 F-FDG-PET / CT后(d)MIP图像和(e,f)轴向图像。
原文链接:http://www.xxwk.net/archives/2094