赫捷, 陈万青, 李兆申, 等. 中国食管癌筛查与早诊早治指南(2022,北京)[J]. 中华肿瘤杂志, 2022, 44(6):491-522.
DOI:10.3760/cma.j.cn112152-20220517-00348
摘 要
食管癌是我国常见的消化道恶性肿瘤之一,严重威胁我国居民生命健康。食管癌高风险人群接受筛查和早诊早治能够有效降低食管癌的发病率和死亡率。制定符合中国国情的食管癌筛查与早诊早治指南,将促进中国食管癌筛查的同质性和规范性,提高食管癌筛查的效果。中国食管癌筛查与早诊早治指南受国家卫生健康委员会疾病预防控制局的委托与指导,由国家癌症中心发起,联合多学科专家,整合食管癌筛查与早诊早治领域的国内外研究进展,同时考虑中国国情和食管癌筛查的实际经验,根据世界卫生组织推荐的指南制定原则和方法,针对食管癌筛查过程中的筛查人群、技术、流程等给出了基于证据的推荐,旨在保证食管癌筛查与早诊早治效果,为中国的食管癌防控提供科学依据。
【关键词】食管肿瘤;筛查;早诊早治;指南;中国
一、引言
食管癌是威胁我国居民生命健康的主要恶性肿瘤之一。世界卫生组织数据显示,2020年我国食管癌新发病例为32.4万例,死亡病例为30.1万例,分别占全球食管癌发病与死亡的53.70%和55.35%。食管癌严重威胁我国居民生命健康,如何有效降低食管癌疾病负担也是我国重大公共卫生问题之一。
按照组织类型分类,食管癌主要分为食管鳞状细胞癌和食管腺癌,在我国以食管鳞状细胞癌为主。食管癌早期患者缺乏典型的临床症状和体征,大多数患者就诊时已达肿瘤中晚期,导致我国食管癌患者的总体预后较差。2003—2015年间,尽管我国食管癌年龄标化5年生存率从20.9%上升到30.3%,但总体5年生存率仍偏低。食管癌患者的生存时间与其临床分期密切相关,早期食管癌患者在接受治疗后5年生存率可达95%。目前已有多项研究表明,针对食管癌高风险人群开展筛查能够有效降低食管癌的发病率和死亡率。我国的食管癌筛查始于20世纪70年代,并于21世纪迅速发展。目前,我国已开展包括食管癌筛查在内的多个重大公共卫生项目,均取得了较好的社会效益。
随着针对人群的食管癌筛查项目广泛开展,规范食管癌筛查、早诊早治技术和实施方案对于保证筛查效果至关重要。已有多个学术团体发布了一系列专家共识意见,但目前我国仍缺乏基于循证医学证据的食管癌筛查和早诊早治指南。因此,国家癌症中心成立中国食管癌筛查与早诊早治指南制定专家组,联合肿瘤学、消化内科学、内镜学、外科学、病理学、临床检验学、流行病学、循证医学、卫生经济学和卫生管理学等多学科专家,基于世界卫生组织推荐的指南制定原则和方法,制定了中国食管癌筛查与早诊早治指南,以期为我国食管癌筛查与早诊早治的规范开展提供参考。
二、指南形成方法
1. 指南发起机构与专家组成员:本指南受国家卫生健康委员会疾病预防控制局的委托与指导,由国家癌症中心发起,联合多学科专家共同制定。指南制定启动时间为2021年8月16日,定稿时间为2022年5月15日。
2. 指南工作组:本指南成立了多学科工作组,主要涵盖了肿瘤学、消化内科学、内镜学、外科学、病理学、临床检验学、流行病学、循证医学、卫生经济学和卫生管理学等学科专家。证据检索与评价由国家癌症中心、兰州大学、哈尔滨医科大学和深圳大学共同完成。所有工作组成员均填写了利益声明表,不存在与本指南直接的利益冲突。
3. 指南使用者与应用的目标人群:本指南适用于各级医疗机构开展食管癌筛查。指南的使用者为各级医疗机构的医务工作者,包括肿瘤科、胸外科、病理科和消化内科等筛查相关学科医师及工作人员。指南推荐意见的应用目标人群为有意向或适宜接受食管癌筛查的受检者。
4. 临床问题的遴选和确定:通过系统检索国内外食管癌筛查领域已发表的指南和系统评价,以及对食管癌筛查领域部分专家的访谈,工作组初步拟定了8大类关键问题框架,涵盖25个临床问题,以在线问卷的形式对临床问题的重要性进行调研和评分。收集汇总2轮共72人次(第1轮25人次、第2轮47人次)的专家函评反馈,最终遴选出本指南拟解决的20个临床问题。
5. 证据的检索:指南制定工作组成立了证据检索与评价小组,针对最终纳入的关键问题,按照人群、干预、对照和结局原则进行检索,具体检索数据库包括PubMed、Embase.com、Clinicaltrial.gov、Cochrane Library、Web of science、中国知网、万方数据知识服务平台、维普资讯网和中国生物医学文献数据库。此外,也对食管癌筛查相关综述、系统评价或Meta分析和指南的参考文献进行滚雪球检索。证据检索截止日期为2021年11月5日。
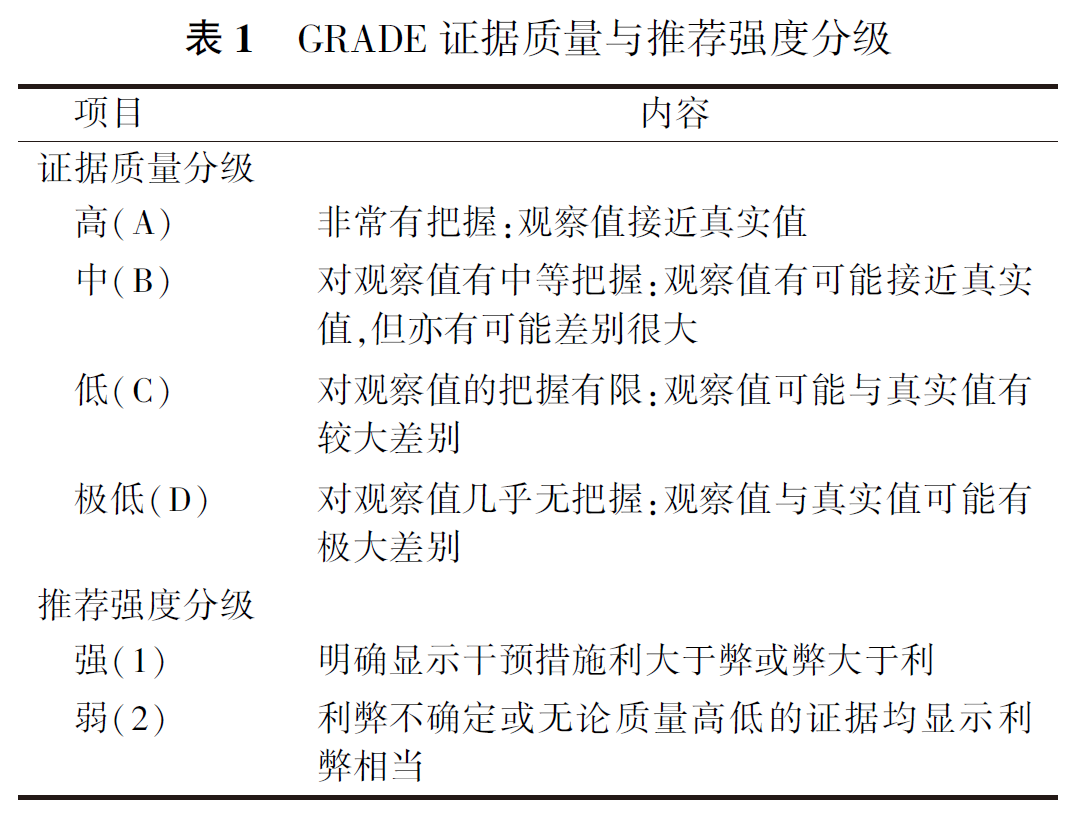
6. 证据的评价与分级:证据检索与评价小组对纳入的随机对照试验采用Cochrane Reviewer's Handbook 5.0.1标准进行评价,对纳入的队列研究采用纽卡斯尔-渥太华量表进行评价,对于诊断准确性研究采用QUADAS-2进行评价,对于病例系列研究采用英国国立临床优化研究所制定的评价工具进行评价,对指南等使用开发指南研究和评估工具Ⅱ进行评价。评价过程由2个人独立完成,若存在分歧,则共同讨论或咨询第三方解决。使用推荐意见分级的评估、制定及评价(Grading of Recommendations Assessment,Development and Evaluation, GRADE)方法对证据质量和推荐意见进行分级,见表1。
7. 推荐意见的形成:指南工作组基于证据评价小组提供的国内外证据,同时考虑我国筛查目标人群的偏好和价值观、干预措施的成本和利弊后,初步拟定了食管癌筛查临床问题推荐意见。指南工作组先后2次以德尔菲法通过邮件形式发送至相关专家进行意见征询,在对推荐意见进行了进一步修改后,于2022年3月进行面对面评议,并形成共识。
8. 指南文稿的形成与外审:指南工作组参考国际实践指南报告规范草拟指南文稿,内部审议后形成征求意见稿。通过国家癌症中心组织的会议等方式公开征求意见,根据反馈结果完善形成最终稿。
9. 指南的传播、实施与更新:指南发布后,指南工作组将主要通过以下方式对指南进行传播和推广:(1)在相关学术会议中对指南进行解读;(2)有计划地在中国部分省份组织指南推广专场会议,确保基层的恶性肿瘤筛查工作人员充分了解并正确应用本指南;(3)在学术期刊和书籍出版社公开发表本指南;(4)通过媒体等进行推广。指南工作组将综合临床实践的需求与证据产生的进展,对本指南进行更新。计划在3年内对本指南的推荐意见进行更新。
三、关键问题及推荐意见临床问题 1
我国食管癌发病率和死亡率
(A)我国食管癌负担严重,是恶性肿瘤死亡的主要原因之一
(B)我国食管癌发病率呈现出性别、年龄和地区差异
(C)我国食管癌死亡率呈现出性别、年龄和地区差异临床问题 2
我国食管癌患者的生存率
(A) 我国食管癌5年相对生存率近年来有所提高
(B) 我国食管癌5年相对生存率呈现出地区和性别差异临床问题 3
食管癌发病相关危险因素和保护因素
危险因素
(A)特定的饮食因素是食管癌的危险因素
(B)遗传因素是食管癌的危险因素
(C)饮酒是食管癌的危险因素
(D)吸烟是食管癌的危险因素
保护因素
某些饮食因素是食管癌的保护因素临床问题 4
筛查相关食管肿瘤病变病理分型和病理分期
(A)食管癌组织学分型包括鳞状细胞癌(非特殊型)、腺癌(非特殊型)、腺鳞癌、小细胞癌等
(B)根据美国癌症联合会(American Joint Committee on Cancer, AJCC)TNM分期系统(第8版),食管癌病理分期分为0期、Ⅰ期、Ⅱ期、Ⅲ期和Ⅳ期临床问题 5
食管早期癌和癌前病变定义
(A)食管早期癌指病灶局限于黏膜层的食管浸润性癌,无论有无区域淋巴结转移
(B)食管癌前病变包括食管鳞状上皮细胞异型增生和Barrett食管异型增生临床问题 6
食管癌筛查不良结局事件指标
(A)食管癌筛查的危害是指与未筛查比较,个人或群体在参与筛查过程中产生的任何负面效应
(B)过度诊断是指个体通过参与筛查被诊断为恶性肿瘤,但如果个体未进行筛查,则恶性肿瘤终生不会被发现的情况
(C)间期癌是指在常规筛查间隔之间被诊断出的恶性肿瘤临床问题 7
食管癌高发区定义
(A)建议以县级行政区为单位界定食管癌高发地区(强推荐,证据分级:中)
(B)食管癌年龄标化发病率>15/10万的地区为食管癌高发地区,年龄标化发病率>50/10万的地区为食管癌极高发地区(强推荐,证据分级:中)临床问题 8
食管癌高风险人群定义
年龄≥45岁,且符合以下任意一项:
(A)长期居住于食管癌高发地区(强推荐,证据分级:中)
(B)一级亲属中有食管癌疾病史(强推荐,证据分级:中)
(C)患有食管癌前疾病或癌前病变(强推荐,证据分级:中)
(D)有吸烟、饮酒、热烫饮食等生活和饮食习惯(强推荐,证据分级:中)临床问题 9
食管癌高风险人群筛查的推荐起止年龄
推荐高风险人群食管癌筛查起始年龄为45岁,至75岁或预期寿命<5年时终止筛查(强推荐,证据分级:中)临床问题 10
食管新型细胞收集器筛查食管癌的有效性
(A)不推荐使用传统球囊拉网细胞学检查进行食管癌早期筛查(弱推荐,证据分级:中)
(B)推荐使用食管新型细胞收集器进行Barrett食管筛查(弱推荐,证据分级:中)
(C)推荐使用食管新型细胞收集器进行内镜前食管癌初筛(强推荐,证据分级:中)临床问题 11
食管癌的生物标志物筛查
不推荐生物标志物检测用于食管癌筛查(强推荐,证据分级:极低)临床问题 12
食管癌筛查人群与筛查间隔
(A)推荐我国食管癌高风险人群每5年进行1次内镜检查(强推荐,证据分级:中)
(B)推荐低级别上皮内瘤变者每1~3年进行1次内镜检查(强推荐,证据分级:中)
(C)推荐低级别上皮内瘤变合并内镜下高危因素或病变长径>1 cm者每年接受1次内镜检查,持续5年(强推荐,证据分级:中)
(D)推荐无异型增生的Barrett食管患者,每隔3~5年进行1次内镜检查(弱推荐,证据分级:低)
(E)推荐低级别上皮内瘤变的Barrett食管患者,每隔1~3年进行1次内镜检查(弱推荐,证据分级:低)临床问题 13
食管内镜种类的选择
(A)推荐Lugol氏液染色内镜或窄带成像(narrow band imaging, NBI)内镜作为食管癌筛查的首选,条件不足者可选择普通白光内镜,有条件者可联合使用放大内镜(强推荐,证据分级:中)
(B)推荐有条件的医院尝试使用人工智能显微内镜(弱推荐,证据分级:低)
(C)推荐不能耐受常规通道内镜者尝试经鼻内镜(弱推荐,证据分级:低)临床问题 14
食管内镜检查操作过程
(A)建议食管内镜下对全部食管黏膜进行系统的观察,并需要有充分与合理的检查时间(强推荐,证据分级:低)
(B)内镜检查时间至少持续7 min,观察食管时间不少于3 min(弱推荐,证据分级:中)
(C)推荐使用黏液祛除剂和祛泡剂来提高食管内镜下黏膜的可见度,并要求患者内镜筛查前应禁食6 h以上、禁水2 h以上(强推荐,证据分级:极低)临床问题 15
PET-CT筛查食管癌的有效性
(A)不推荐使用 18F-FDG PET-CT检查进行食管癌早期筛查(弱推荐,证据分级:中)
(B)不推荐使用PET-CT检查进行食管癌早期筛查(弱推荐,证据分级:低)临床问题 16
食管癌早期治疗方法
(A)推荐早期食管癌内镜治疗前通过内镜检查评估病变范围、分期以及浸润深度(强推荐,证据分级:中)
(B)对于符合内镜下切除的绝对和相对适应证的早期食管癌患者,推荐进行内镜下切除,首选内镜黏膜下剥离术(endoscopic submucosal dissection, ESD);病变长径≤10 mm时,如果能保证整块切除,也可以考虑内镜下黏膜切除术(endoscopic mucosal resection, EMR)治疗(强推荐,证据分级:高)
(C)对采用EMR切除后的早期食管腺癌患者,推荐在EMR切除后进行消融治疗,提高治愈率、降低食管狭窄与穿孔的发生率(弱推荐,证据分级:高)
(D)内镜下射频消融术(radio frequency ablation, RFA)可用于治疗局限于黏膜固有层以内的食管鳞癌。因病灶过长、近环周等原因难以整块切除或患者不耐受内镜切除术时可考虑内镜下RFA(弱推荐,证据分级:中)
(E)对于病变浸润深度达到黏膜下层(>200 μm)的T1b期食管癌患者,有淋巴结或血管侵犯,肿瘤低分化(≥G3),应行食管切除术,拒绝手术或手术不耐受者可行同步放化疗(强推荐,证据分级:中)临床问题 17
食管癌前病变早期治疗方法
(A)病理学显示食管鳞状上皮低级别上皮内瘤变,但内镜下有高级别病变表现或合并病理学升级危险因素者可行内镜下切除,未行切除者应3~6个月内复查内镜并重新活检;因病灶过长、近环周等原因难以整块切除或患者不耐受内镜切除术时可考虑应用RFA(强推荐,证据分级:中)
(B)病理学显示鳞状上皮高级别上皮内瘤变且经内镜或影像学评估无黏膜下浸润和淋巴结转移者,推荐内镜下整块切除;因病灶过长、近环周等原因难以整块切除或患者不耐受内镜切除术时可考虑应用RFA(弱推荐,证据分级:中)
(C)Barrett食管伴黏膜低级别异型增生(low-grade dysplasia, LGD)的患者推荐内镜下射频消融治疗,未行治疗者每6~12个月随访1次;Barrett食管伴HGD,首选内镜下切除后行RFA(强推荐,证据分级:高)临床问题 18
食管癌和癌前病变患者的治疗后管理
(A)病灶超过食管周径3/4的食管癌和癌前病变行内镜切除术后应积极预防食管狭窄,推荐局部注射类固醇、口服类固醇和球囊扩张(强推荐,证据分级:高)
(B)早期食管鳞癌及癌前病变内镜治疗后第1年每3~6个月应复查,包括上消化道内镜及其他相应检查,若无明显异常,第2年开始可每年进行1次复查(弱推荐,证据分级:低)
(C)建议在内镜切除或消融治疗Barrett食管相关LGD、HGD或早期腺癌后定期进行内镜随访(强推荐,证据分级:高)临床问题 19
开展食管癌筛查医师应具备的能力
食管癌筛查内镜医师应清楚了解食管的解剖学特征,具备一般内镜检查能力,开展内镜诊疗工作不少于5年,取得主治医师及以上专业技术职务任职资格;每位内镜医师至少有300例食管内镜诊疗操作的个人经验;内镜医师满足培训标准,可以进行食管癌内镜筛查(强推荐,证据分级:低)临床问题 20
食管癌筛查质量控制
推荐将食管癌早期诊断率、染色内镜使用率作为食管癌筛查质量控制指标(强推荐,证据分级:低)(一)流行病学问题临床问题 1
我国食管癌发病率和死亡率
(A)我国食管癌负担严重,是恶性肿瘤死亡的主要原因之一
(B)我国食管癌发病率呈现出性别、年龄和地区差异
(C)我国食管癌死亡率呈现出性别、年龄和地区差异
2020年我国食管癌新发病例数为32.4万例,占全球的53.70%。国家癌症中心数据显示,2016年中国食管癌新发病例数为25.25万例,占全部恶性肿瘤的6.21%,其中男性18.45万例,女性6.80万例。全国食管癌发病率(粗率)为18.26/10万,其中男性和女性分别为26.05/10万和10.07/10万,男性高于女性。食管癌发病率在40岁之前处于较低水平,自40岁之后快速上升,男女发病率均于80~84岁达到高峰。食管癌发病率存在地域差异,2016年,农村地区食管癌年龄标化发病率(15.0/10万)高于城市地区(8.2/10万)。从东、中、西三大经济区域来看,食管癌的发病率也存在着较大差异,2015年中国东部地区新发食管癌8.9万例,发病率为17.2/10万;中部地区新发食管癌9.0万例,发病率为19.6/10万;西部地区新发食管癌6.7万例,发病率16.8/10万。从2000年开始,城市地区和女性人群的粗发病率均呈下降趋势;人群年龄结构标准化后,城市、农村、男性、女性均呈下降趋势。
2020年我国食管癌死亡病例数为30.1万例,占全球的55.35%。国家癌症中心数据显示,2016年中国食管癌死亡病例数为19.39万例,占全部恶性肿瘤的8.03%,其中男性14.23万例,女性5.16万例;全国食管癌死亡率(粗率)为14.02/10万,其中男性和女性分别为20.10/10万和7.64/10万,男性高于女性。食管癌死亡率在40岁之前处于较低水平,自40岁之后快速上升,男性死亡率在80~84岁达到高峰,女性死亡率在85岁之后达到高峰。食管癌死亡率存在地域差异,2016年,农村地区食管癌年龄标化死亡率(11.0/10万)高于城市地区(6.2/10万)。从东、中、西三大经济区域来看,食管癌的死亡率也存在着较大差异,2015年中国东部地区食管癌死亡病例数为6.9万例,死亡率为13.4/10万;中部地区死亡病例数为6.8万例,死亡率为14.7/10万;西部地区死亡病例数为5.1万例,死亡率为12.9/10万。我国食管癌死亡率呈下降趋势。临床问题 2
我国食管癌患者的生存率
(A) 我国食管癌5年相对生存率近年来有所提高
(B) 我国食管癌5年相对生存率呈现出地区和性别差异
食管癌预后较差,基于全球60个国家或地区的数据显示,食管癌年龄标化的5年生存率仅为10.0%~30.0%。我国基于17个肿瘤登记地区的数据显示,2003—2015年食管癌5年合计相对生存率从20.9%(95%CI:20.1%~21.6%)增长至30.3%(95%CI:29.6%~31.0%);2012—2015年,男性食管癌5年生存率(27.7%)低于女性(36.7%);城市地区食管癌5年生存率(18.1%)低于农村地区(33.2%),可能与食管癌筛查项目主要在农村地区开展有关(尤其是2012年以前)。虽然食管癌预后较差,但食管癌早期患者在接受治疗后5年生存率可达95%,因此,探索高效的筛查与早诊早治策略对于提高食管癌的生存率至关重要。临床问题 3
食管癌发病相关危险因素和保护因素
危险因素
(A)特定的饮食因素是食管癌的危险因素
(B)遗传因素是食管癌的危险因素
(C)饮酒是食管癌的危险因素
(D)吸烟是食管癌的危险因素
保护因素
某些饮食因素是食管癌的保护因素
1. 目前研究已经明确的主要危险因素
(1)特定的饮食因素:冉进军等对2004—2013年发表的中国人群中饮食因素与食管癌关系的23项研究进行Meta分析,结果显示,热烫饮食(OR=1.93,95%CI:1.65~2.22)、腌制饮食(OR=1.46,95%CI:1.21~1.72)、辛辣饮食(OR=1.52,95%CI:1.15~1.90)、油炸饮食(OR=1.57,95%CI:1.23~1.92)、高盐饮食(OR=1.55,95%CI:1.31~1.79)、霉变饮食(OR=1.56,95%CI:1.35~1.78)、硬质饮食(OR=2.11,95%CI:1.17~3.04)、快速进食(OR=1.92,95%CI:1.62~2.21)和不规律饮食(OR=1.78,95%CI:1.30~2.26)均会增加食管癌发病风险。汪求真等对2000—2005年发表的21项中国人群食管癌饮食因素的病例对照研究进行Meta分析(累计病例数为5 759例,对照病例数为8 795例),结果显示,腌制食品、饮食不规律、霉变食品、喜烫食、高盐饮食、进餐速度快和酸菜均会增加食管癌的发病风险,合并OR分别为2.79(95%CI:1.85~4.20)、2.76(95%CI:2.42~3.14)、2.53(95%CI:2.16~2.95)、2.51(95%CI:1.75~3.60)、2.27(95%CI:1.35~3.82)、2.17(95%CI:1.61~2.92)和1.71(95%CI:1.16~2.54)。
(2)遗传因素:食管癌有家族聚集性,一项基于人群的大型病例对照研究显示,食管癌家族史与食管鳞癌发病风险之间存在密切关联,食管鳞癌的发病风险随着受影响的一级亲属数量的增加而增加(P<0.001),另外,父母双方均患食管癌的个体食管鳞癌发病风险大幅度增加(OR=7.96,95%CI:1.74~36.32)。目前,全基因组关联研究已经确定了几十个食管癌的遗传易感位点。Song等对158例食管鳞癌患者进行综合基因组分析,最终确定了8个突变位点,其中6个是已知的肿瘤相关基因,包括TP53、RB1、CDKN2A、PIK3CA、NOTCH1和NFE2L2,另外2个是新发现的食管鳞癌相关基因ADAM29和FAM135B。
(3)饮酒:饮酒人群食管癌的发病风险增高。世界癌症研究基金会和美国癌症研究所发布的《2018癌症预防和生存报告》共纳入6项研究进行Meta分析,结果显示,酒精每日摄入量每增加10 g,食管鳞癌风险增加25%(OR=1.25,95%CI:1.12~1.41)。Prabhu等纳入18篇探索食管鳞癌和饮酒关系的研究进行Meta分析,其中8项研究来源于亚洲人群,8项研究来源于欧洲人群,结果显示,每周酒精摄入量>200 g者的食管癌发病风险是不饮酒者的4.65倍(OR=4.65,95%CI:3.61~5.99);在亚洲人群中,每周酒精摄入量>200 g者的食管癌发病风险是不饮酒者的5.80倍(OR=5.80,95%CI:3.64~9.24);在欧洲人群中,每周酒精摄入量>200 g者的食管癌发病风险是不饮酒者的3.87倍(OR=3.87,95%CI:2.57~5.82)。
(4)吸烟:吸烟人群食管癌的发病风险增高。2014年关于烟草问题的《美国卫生总监报告》对1964年以来吸烟与食管癌的研究进行了汇总分析,得出结论:有充分证据证明吸烟与食管癌之间存在因果关系。Wang等对1987—2015年发表的52项研究进行Meta分析,研究人群来源于北美、欧洲、大洋洲、亚洲及南美洲地区,结果显示,吸烟者和曾经吸烟者食管鳞癌的发病风险分别是不吸烟者的4.18倍(RR=4.18,95%CI:3.42~5.12)和2.05倍(RR=2.05,95%CI:1.71~2.45)。在中国人群中开展的相关研究也支持吸烟是食管癌的危险因素。Chen等基于CKB队列的研究显示,在男性中,吸烟者食管癌的发病风险是不吸烟者的1.47倍(RR=1.47,95%CI:1.24~1.73),但在女性中,吸烟者与不吸烟者食管癌的发病风险差异无统计学意义(RR=1.24,95%CI:0.71~2.17)。廖震华等对1993—2008年发表的25项研究进行Meta分析,结果显示,每日吸烟量1~9支、10~19支和≥20支者食管癌发病风险分别是不吸烟者的1.36倍(OR=1.36,95%CI:1.10~1.68)、1.38倍(OR=1.38,95%CI:1.08~1.77)和3.53倍(OR=3.53,95%CI:1.56~7.98);吸烟年限20~29年、30~39年和≥40年者食管癌发病风险分别是不吸烟者的1.78倍(OR=1.78,95%CI:1.34~2.37)、1.89倍(OR=1.89,95%CI:1.44~2.48)和2.15倍(OR=2.15,95%CI:1.56~2.94)。
2. 目前研究已经明确的保护因素
Sun等对15项研究进行Meta分析,研究人群来源于北美、欧洲、亚洲及南美洲地区,结果显示,与最低膳食纤维摄入人群比较,最高膳食纤维摄入人群食管癌的发病风险降低48%(OR=0.52,95%CI:0.43~0.64);每日膳食纤维摄入量每增加10 g,Barrett食管和食管癌的风险降低31%(OR=0.69,95%CI:0.61~0.79)。一项包含北美、欧洲和亚洲研究人群的Meta分析结果显示,与膳食钙摄入最低者比较,膳食钙摄入最高者食管癌的发病风险降低20%(OR=0.80,95%CI:0.71~0.91)。Li等对纳入的12项研究进行Meta分析,其中8项研究来自欧洲人群,3项研究来自美国人群,1项研究来自澳大利亚人群,结果显示,食用蔬菜和水果分别可使食管腺癌的发病风险降低24%(OR=0.76,95%CI:0.59~0.96)和27%(OR=0.73,95%CI:0.55~0.98)。Liu等对1988—2012年发表的32项研究进行Meta分析,研究人群来源于北美、欧洲、亚洲及南美洲地区,结果显示,相比于蔬菜和水果摄入最低者,蔬菜和水果摄入最高者分别可使食管鳞癌发病风险降低44%(OR=0.56,95%CI:0.45~0.69)和47%(OR=0.53,95%CI:0.44~0.64)。(二)筛查和早诊早治结局临床问题 4
筛查相关食管肿瘤病变病理分型和病理分期
(A)食管癌组织学分型包括鳞状细胞癌(非特殊型)、腺癌(非特殊型)、腺鳞癌、小细胞癌等
(B)根据美国癌症联合会(American Joint Committee on Cancer, AJCC)TNM分期系统(第8版),食管癌病理分期分为0期、Ⅰ期、Ⅱ期、Ⅲ期和Ⅳ期
食管癌的组织学分型推荐参考《WHO消化系统肿瘤分类(2019年版)》,主要包括鳞状细胞癌(非特殊型)、腺癌(非特殊型)、小细胞癌等。
食管癌病理分期系统推荐应用AJCC癌症分期手册(第8版)。细化定义如下。
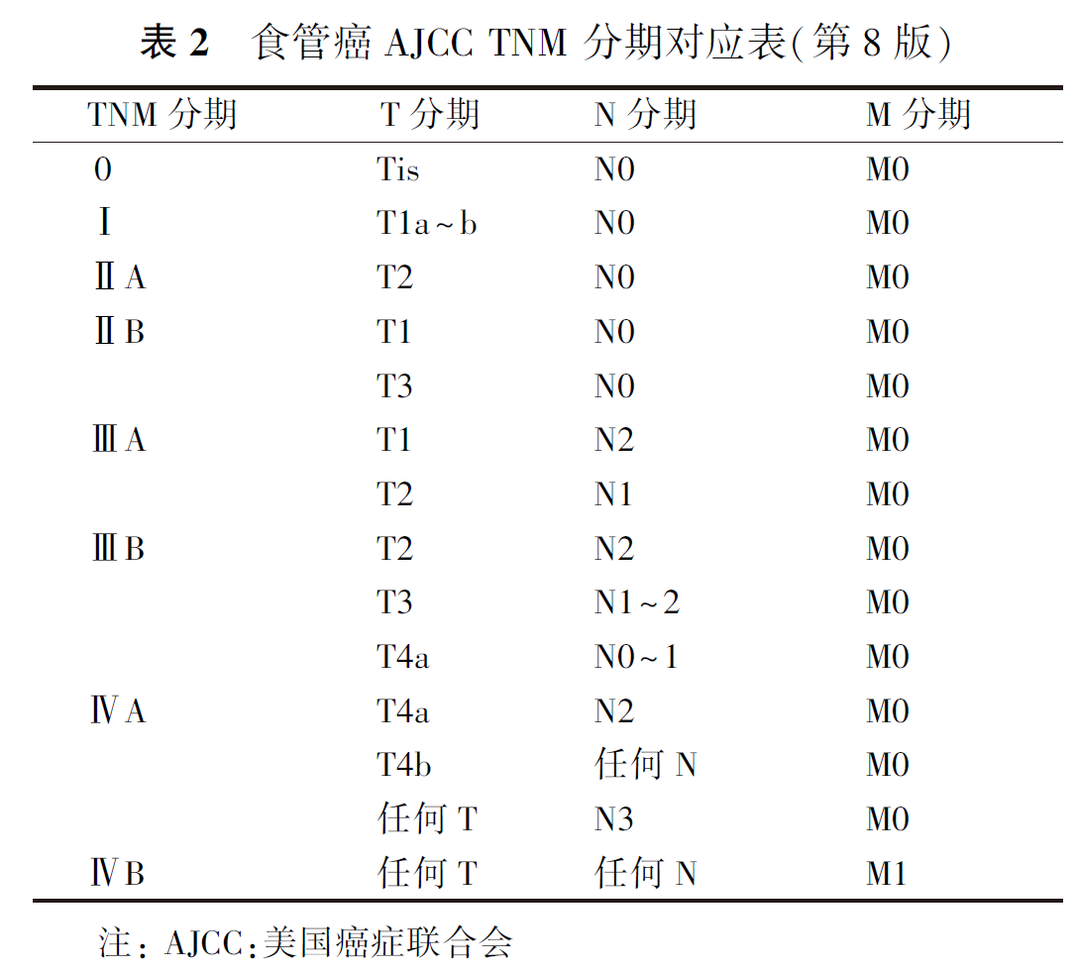
1. 原发肿瘤(T):Tx:原发肿瘤不能评价;T0:没有原发肿瘤的证据;Tis:高级别上皮内瘤变或异型增生;T1a:肿瘤侵及黏膜固有层和黏膜肌层;T1b:肿瘤侵及黏膜下层;T2:肿瘤侵及固有肌层;T3:肿瘤侵及食管纤维膜;T4a:肿瘤侵及胸膜、心包、奇静脉、膈肌或腹膜;T4b:肿瘤侵及其他邻近结构,如主动脉、椎体或气道。
2. 区域淋巴结(N):Nx:区域淋巴结无法评价;N0:无区域淋巴结转移;N1:1~2枚区域淋巴结转移;N2:3~6枚区域淋巴结转移;N3:≥7枚淋巴结转移。
3. 远处转移(M):M0:无远处转移;M1:有远处转移。
具体AJCC TNM 分期(第8版)定义规则见表2。
临床问题 5
食管早期癌和癌前病变定义
(A)食管早期癌指病灶局限于黏膜层的食管浸润性癌,无论有无区域淋巴结转移
(B)食管癌前病变包括食管鳞状上皮细胞异型增生和Barrett食管异型增生
食管早期癌和癌前病变定义主要参考来源包括《WHO消化系统肿瘤分类(2019年版)》、《食管癌诊疗规范(2018年版)》、《食管癌诊疗指南(2020年版)》等多部国内外指南及专家共识。临床问题 6
食管癌筛查不良结局事件指标
(A)食管癌筛查的危害是指与未筛查比较,个人或群体在参与筛查过程中产生的任何负面效应
(B)过度诊断是指个体通过参与筛查被诊断为恶性肿瘤,但如果个体未进行筛查,则恶性肿瘤终生不会被发现的情况
(C)间期癌是指在常规筛查间隔之间被诊断出的恶性肿瘤
食管癌筛查不良结局事件主要参考美国国家癌症研究所的医师数据咨询信息库(physician data query, PDQ)中的PDQ癌症信息摘要。
1. 筛查的危害:筛查的危害是指与未筛查比较,个体或群体在参与筛查过程中产生的任何负面效应。对筛查危害的评估不仅要量化危害的发生频率,还要量化其严重程度。筛查的危害在随机对照试验和筛查项目中可能存在差异。筛查的危害可根据筛查的类型(如生理影响、心理影响、经济压力以及时间或机会成本)和危害产生的环节(如筛查过程、筛查技术本身、监测以及阳性筛查结果的管理)进行分类。筛查过程的危害包括因被邀请参加筛查或等待筛查结果而产生的焦虑以及对自身不良生活方式或寻求健康行为的焦虑。筛查技术本身的危害包括从阴性筛查结果得到的保证可能会导致患者忽视自身出现的症状,从而延迟就医,导致间期癌的延迟诊断和可能的死亡;内镜检查相关的并发症和感染。
2. 过度诊断:过度诊断是指个体通过参加筛查被诊断为恶性肿瘤,但如果个体未进行筛查,则终生不会发现这些恶性肿瘤。部分经过筛查发现的肿瘤并不会继续生长和转移,然而这些肿瘤一经发现,医师就会给予治疗,目前没有明确的证据表明在这种情况下给予治疗会延长患者的生命,并且过度治疗会对患者造成心理上的焦虑和经济上的负担。一项多中心国际研究的结果显示,Barrett食管重度异型增生的过度诊断率可达40%。过度诊断会对患者造成较大的心理压力,导致患者高估自己患癌的风险。美国的一项问卷调查表明,筛查发现的Barrett食管患者中,约63%的患者一年内患恶性肿瘤的风险被高估,约38%的患者一生中患恶性肿瘤的风险被高估。
3. 假阳性:正常个体可能在筛查试验中获得异常结果。假阳性检测结果可能会引起焦虑和后续频繁的检查。
4. 假阴性:由于筛查的手段对于食管癌的检出概率并不能达到100%,食管癌患者可能在筛查中获得正常结果。这种假阴性结果(错误显示恶性肿瘤患者未患恶性肿瘤)可能导致患者在出现症状的情况下依然推迟治疗。
5. 内镜检查相关的并发症和感染:筛查可能会导致内镜检查相关的罕见但较为严重的并发症,包括穿孔、心肺事件、误吸(食物、水、胃酸或呕吐物进入呼吸道)以及需要住院治疗的严重出血。这些筛查相关的并发症发生率估计为0/10 000~13/10 000次,相关死亡率为0/10 000~0.8/10 000次。此外,内镜检查还可能导致感染,相关研究报道有乙肝病毒和幽门螺杆菌感染,为了减少类似情况的发生,我国已制定了《软式内镜清洗消毒技术规范WS 507-2016》。(三)人群风险分类临床问题 7
食管癌高发区定义
(A)建议以县级行政区为单位界定食管癌高发地区(强推荐,证据分级:中)
(B)食管癌年龄标化发病率>15/10万的地区为食管癌高发地区,年龄标化发病率>50/10万的地区为食管癌极高发地区(强推荐,证据分级:中)
本指南对食管癌高发地区的定义主要参考《中国早期食管癌及癌前病变筛查专家共识意见(2019年,新乡)》。
国内大部分食管癌筛查专家共识都将食管癌高发地区人群列为筛查对象之一,然而很少对高发地区这一概念进行明确的定义。目前仅有《中国早期食管癌及癌前病变筛查专家共识意见(2019年,新乡)》对食管癌高发地区的概念进行了专门的定义,即以县级行政区为单位界定食管癌高发地区,以2000年第五次全国人口普查数据各年龄段人口数为标准,年龄标化发病率>15/10万为高发地区,年龄标化发病率>50/10万为极高发地区。临床问题 8
食管癌高风险人群定义
年龄≥45岁,且符合以下任意一项:
(A)长期居住于食管癌高发地区(强推荐,证据分级:中)
(B)一级亲属中有食管癌疾病史(强推荐,证据分级:中)
(C)患有食管癌前疾病或癌前病变(强推荐,证据分级:中)
(D)有吸烟、饮酒、热烫饮食等生活和饮食习惯(强推荐,证据分级:中)
目前,全球各国发表的食管癌筛查指南或专家共识均建议在高风险人群中进行食管癌筛查,但是各个指南对食管癌高风险人群的判定标准有一定的差异。目前,国内与国外常用的食管癌筛查指南和专家共识对于高风险人群的定义见表3和表4。除了年龄外,国内外大部分指南和专家共识在定义食管癌高风险人群时均考虑了食管癌家族史。例如中国临床肿瘤学会发布的《食管癌诊疗指南》将符合下列任何一项者定义为食管癌高风险人群:年龄≥40岁且来自食管肿瘤高发地区;有食管肿瘤家族史;具有食管癌高危因素(吸烟、重度饮酒、头颈部或呼吸道鳞癌、喜食高温及腌制食物、口腔卫生状况不良等)。美国胃肠内镜学会(American Society for Gastrointestinal Endoscopy, ASGE)将满足下列条件的人群定义为食管癌高风险人群:白人男性;年龄>50岁;患有胃食管反流病5年以上;有Barrett食管或食管腺癌家族史。


国内外常用的食管癌筛查指南和专家共识在定义高风险人群时,除了年龄和食管癌家族史这2个因素外,其他方面有很大的差异。一些国外组织机构,如ASGE、美国胃肠病协会(American Gastroenterological Association, AGA)、英国胃肠病协会、美国胃肠病学会(American College of Gastroenterology, ACG)和欧洲胃肠内镜协会(European Society of Gastrointestinal Endoscopy, ESGE)制定的食管癌筛查指南在定义高风险人群时通常考虑Barrett食管、胃食管反流病、肥胖等因素。然而国内的专家共识在定义食管癌高风险人群时,通常考虑食管癌前病变、是否来自食管癌高发地区、是否暴露于吸烟、饮酒等食管癌的危险因素。国内外对高风险人群的定义存在分歧的主要原因是,一方面国外食管癌的组织学分型以腺癌为主,而国内食管癌以鳞状细胞癌为主;另一方面,国内与国外食管癌发病的危险因素也不同。考虑到本指南应用于中国人群,因此在制定食管癌高风险人群定义时,主要参考国内指南和专家共识以及食管鳞癌发生相关的研究证据。
本指南在制定食管癌高风险人群推荐意见时,也考虑了国内食管癌发病常见的危险因素。食管癌家族史是食管癌发病较为重要的一个危险因素,我国食管癌发病存在明显的家族聚集现象,这可能与同一家族的患者具有相同的遗传背景有关,有研究者发现多个与食管鳞癌发生有关的易感基因位点,这些位点与环境因素产生交互作用,影响食管鳞癌的发生。食管癌发病存在家族聚集现象的另一个原因,可能是由于同一家族的患者共同暴露于特定的环境因素。癌前病变也是影响食管癌发生的另一个危险因素。食管癌的癌前病变包括食管鳞状上皮异型增生和Barrett食管相关异型增生,这两种癌前病变均与食管癌的发生密切相关。一项在河南省林州市进行的队列研究结果显示,在13.5年的随访过程中,正常食管鳞状上皮、鳞状上皮轻、中、重度异型增生癌变率分别为8%、24%、50%和74%;与病理诊断正常的个体比较,筛查病理确诊为食管鳞状上皮轻度异型增生(RR=2.9, 95%CI:1.6~5.2)、中度异型增生(RR=9.8, 95%CI:5.3~18.3)、重度异型增生(RR=28.3, 95%CI:15.3~52.3)患者食管癌的发病风险依次升高。另一项在我国林州市、磁县、肥城食管癌高发地区开展的前瞻性队列研究结果显示,在约8.5年的随访时间内,正常食管鳞状上皮、食管鳞状上皮轻、中、重度异型增生人群癌变的累积发生率分别为0.26%、1.4%、4.5%和15.46%,并且与正常食管鳞状上皮的个体比较,患有食管鳞状上皮轻度异型增生(HR=4.55,95%CI:2.82~7.34)、中度异型增生(HR=15.18,95%CI:8.98~25.66)、重度异型增生(HR=55.78,95%CI:29.78~104.49)的个体具有更高的食管癌发病风险。这两项研究都在中国食管癌高发地区开展,研究人群为长期居住于食管癌高发区的人群,因此在这两项研究中,当地一般人群的食管癌发病率也高于全国平均发病水平(19.28/10万)。一些生活习惯和饮食习惯同样能增加食管癌发病风险。一项基于中国人群的前瞻性队列研究显示,饮用热茶是食管癌发病的危险因素,并与吸烟和饮酒存在协同作用。一项在伊朗食管癌高发地区开展的研究显示,吸烟、饮用热茶、摄入水果蔬菜过少和室内空气污染均为食管鳞癌发病的危险因素。
综上所述,本指南在制定食管癌高风险人群推荐意见时考虑了年龄、是否来自食管癌高发区、食管癌家族史、食管癌前病变以及是否存在吸烟、饮酒、热烫饮食等食管癌危险因素。(四)筛查起止年龄临床问题 9
食管癌高风险人群筛查的推荐起止年龄
推荐高风险人群食管癌筛查起始年龄为45岁,至75岁或预期寿命<5年时终止筛查(强推荐,证据分级:中)
我国食管癌年龄别发病率和死亡率在45岁之前处于较低水平,自45岁之后迅速上升,发病率于80~84岁达到高峰。基于我国145个肿瘤登记处的食管癌统计数据显示,45~49岁、50~54岁、55~59岁、60~64岁、65~69岁、70~74岁年龄组的食管癌发病率分别为12.34/10万、28.30/10万、53.96/10万、88.86/10万、109.88/10万和130.10/10万,而35~39岁和40~44岁年龄组的食管癌发病率则分别为1.41/10万和5.01/10万。因此,本指南建议将45岁作为食管癌筛查的起始年龄。
对于食管癌筛查的终止年龄,国内有专家共识建议到74岁终止筛查。虽然我国老年人食管癌发病率仍然较高,75~79岁、80~84岁和85岁及以上年龄组食管癌发病率分别为142.29/10万、143.65/10万和125.21/10万,但是目前食管癌筛查手段以内镜为主,这种筛查方式本身有可能会对患者造成创伤,且恶性肿瘤的治疗本身也存在一定不良反应。考虑到老年人的身体状况和预期寿命,75岁及以上老年人参加食管癌筛查的获益和危害难以权衡,且将食管癌筛查终止年龄延后可能导致更高的成本。因此,本指南推荐75岁或预期寿命<5年者终止筛查。(五)筛查和早期诊断办法临床问题 10
食管新型细胞收集器筛查食管癌的有效性
(A)不推荐使用传统球囊拉网细胞学检查进行食管癌早期筛查(弱推荐,证据分级:中)
(B)推荐使用食管新型细胞收集器进行Barrett食管筛查(弱推荐,证据分级:中)
(C)推荐使用食管新型细胞收集器进行内镜前食管癌初筛(强推荐,证据分级:中)
2008年,一项对无症状人群(n=740)开展筛查的前瞻性评估结果显示,传统机械球囊细胞学检查诊断食管鳞状细胞异形增生或肿瘤的灵敏度为39%,特异度为85%;充气球囊拉网细胞学检查诊断食管鳞状细胞异形增生或肿瘤的灵敏度为46%,特异度为84%。可见,传统拉网细胞学检查的灵敏度偏低,且缺乏高级别证据的支持。目前,国内多个专家共识均已不推荐将传统机械球囊和充气球囊拉网细胞学作为早期食管癌筛查的手段,具体描述见表5。

食管新型细胞收集器是一种新型食管细胞学采样装置,相比传统拉网细胞学采样具有更高的成功率。2018年发表的系统评价结果显示,新型细胞收集器在Barrett食管筛查与检测、食管鳞状上皮异型增生检测、嗜酸性食管炎的检测及食管良性疾病的评估方面都有显著的效果,且患者的接受度普遍较高。2013年的一项建模分析显示,与不筛查比较,在胃食管反流人群中采用新型细胞收集器筛查可有效降低食管腺癌死亡率。2017年发表的一项横断面研究显示,新型细胞收集器在食管异常筛查中的准确性高达94.7%。2019年,一项系统评价显示,在使用新型细胞收集器过程中,不良事件发生率极低(<1/2 000),与未镇静处理的内镜检查比较,新型细胞收集器接受度更高(中位数为6.0,四分位间距为5.0~8.0)且绝大部分患者(90.1%)无吞咽困难。2020年发表的一项在新西兰开展的调查性研究显示,受访者更愿意选择无创筛查方式,但无创筛查方式的灵敏度和特异度低于传统胃镜筛查。食管新型细胞收集器筛查食管鳞癌及癌前病变的研究起步较晚,但进展迅速。伊朗学者开展的一项研究显示,新型细胞收集器结合p53免疫组化诊断食管鳞状上皮异型增生的灵敏度和特异度分别为100%和97%。2021发表的一项在坦桑尼亚开展的研究显示,细胞海绵取样具有安全性、可接受性和可行性的特点,为创新的病因学和早期检测研究铺平了道路。近期,中国团队改良了食管细胞收集器形状,实现单次平均细胞采集数量超过600万个,安全性和患者耐受性良好,并研发了人工智能辅助细胞诊断系统,在社区筛查人群中的灵敏度达90%,特异度达93.7%,充分显示了其在我国高发地区人群筛查中的应用前景。2019年国内专家共识推荐食管新型细胞收集器联合生物标志物检测对Barrett食管相关异型增生及早期食管腺癌进行初筛,同时联合生物标志物检测在食管鳞状上皮异型增生及早期鳞癌筛查中开展更多应用。此外,2013年和2017年发表的两项研究均显示,新型食管细胞筛查相较于传统的内镜筛查成本更低,更容易被患者接受。临床问题 11
食管癌的生物标志物筛查
不推荐生物标志物检测用于食管癌筛查(强推荐,证据分级:极低)
已有多种生物标志物被提出可用于辅助诊断食管癌,但它们并不能确认食管癌前病变的诊断或者预测高危人群食管癌的进展风险。现阶段不推荐单个生物标志物或一组生物标志物组合用于食管癌的筛查或诊断,食管癌指南和专家共识关于标志物筛查的推荐意见表6。

食管鳞状细胞癌患者循环失调的microRNAs被认为在食管癌的诊断和预后方面具有较好潜力。一项纳入35项研究的Meta分析评估了血浆或血清microRNAs诊断食管鳞状细胞癌的效能,结果显示,循环microRNAs用于诊断食管鳞癌的灵敏度为0.80(95%CI:0.77~0.82),特异度为0.78(95%CI:0.75~0.81),受试者工作特征(receiver operating characteristic, ROC)曲线下面积为0.86(95%CI: 0.82~0.88)。在食管癌患者血清中发现的与肿瘤相关抗原相关的自身抗体也被提出作为食管癌早期诊断的生物标志物。最常用的抗体检测方法是酶联免疫吸附试验,最常用来评估的自身抗体包括p53、NY-ESO-1、HSP70、c-Myc、MMP-7等。大多数原始研究仅评估了单一抗体诊断价值,仅有少数研究评估了多种自身抗体组合的诊断价值。对于单一自身抗体,特异度通常非常高(中位特异度为98.3%),但灵敏度大多相当低(中位灵敏度为26.7%)。对于某些自身抗体组合,可以在相当高的特异度水平下获得更高的灵敏度,但仍然达不到可以用来筛查的标准。开发扩展和优化的自身抗体标志物组合,在食管癌早期筛查诊断中具有良好前景,但现阶段仍不推荐任何肿瘤相关抗原的自身抗体用于食管癌筛查。其他有报告用于食管癌筛查以及鉴别诊断的生物标志物包括血清蛋白和组织蛋白等。然而这些研究提供的证据不充分,无法推荐任何生物标志物来补充或替代内镜检查和组织病理学检查的标准常规做法。临床问题 12
食管癌筛查人群与筛查间隔
(A)推荐我国食管癌高风险人群每5年进行1次内镜检查(强推荐,证据分级:中)
(B)推荐低级别上皮内瘤变者每1~3年进行1次内镜检查(强推荐,证据分级:中)
(C)推荐低级别上皮内瘤变合并内镜下高危因素或病变长径>1 cm者每年接受1次内镜检查,持续5年(强推荐,证据分级:中)
(D)推荐无异型增生的Barrett食管患者,每隔3~5年进行1次内镜检查(弱推荐,证据分级:低)
(E)推荐低级别上皮内瘤变的Barrett食管患者,每隔1~3年进行1次内镜检查(弱推荐,证据分级:低)
2006—2012年,江苏省扬中市农村一项针对40~69岁人群的上消化道内镜筛查队列研究显示,筛查组食管癌病例数为97例(n=12 768),发病粗率为127.52/10万(95%CI:104.51/10万~155.60/10万);未筛查组食管癌病例数为473例(n=33 257),发病粗率为209.41/10万(95%CI:191.36/10万~229.16/10万);筛查组因食管癌死亡24例,死亡粗率为44.92/10万(95%CI:32.09/10万~62.86/10万);未筛查组因食管癌死亡218例,死亡粗率为98.36/10万(95%CI:86.13/10万~112.32/10万)。另外,研究显示,与未筛查组比较,筛查组食管癌发生的RR值为0.70(95%CI:0.56~0.86),筛查组因食管癌死亡的RR值为0.47(95%CI:0.33~0.67),且差异均有统计学意义(P<0.001)。2006—2015年,四川省盐亭县以乡镇66 202名40~69岁人群为筛查对象的上消化道内镜筛查队列研究显示,筛查组(n=22 702)食管癌的发病风险低于对照组(n=33 325;RR=0.59,95%CI:0.49~0.72),差异有统计学意义(P<0.001)。另外,筛查组因食管癌死亡50例,对照组因食管癌死亡393例,筛查组食管癌的死亡风险低于对照组(RR=0.32,95%CI:0.23~0.43),差异有统计学意义(P<0.05)。2006—2012年,以山西省阳城县53 541名农村人群为研究对象的上消化道内镜筛查研究显示,筛查组食管癌病例数为116例(n=12 460),发病粗率为148.93/10万(95%CI:124.15/10万~178.65/10万);未筛查组食管癌病例数为427例(n=41081),发病粗率为190.32/10万(95%CI:173.10/10万~209.25/10万);筛查组因食管癌死亡41例,死亡粗率为53.10/10万(95%CI:39.10/10万~72.12/10万);未筛查组因食管癌死亡169例,死亡粗率为77.03/10万(95%CI:66.25/10万~89.56/10万)。另外,相较于对照组(66 525人),筛查组(1 579人)食管癌发生的RR值为0.61(95%CI:0.50~0.74),食管癌死亡的RR值为0.51(95%CI:0.36~0.69)。2006—2015年,以山东省肥城县40~69岁人群为筛查对象的上消化道内镜筛查队列研究显示,受邀筛查组累计因食管癌死亡60例(n=23 470),受邀但未参与筛查组累计因食管癌死亡157例(n=33 257),未受邀且未筛查组累计因食管癌死亡734例(n=58 106);受邀筛查组与未受邀且未筛查组比较,因食管癌死亡的RR值为0.35(95%CI:0.26~0.45),差异有统计学意义(P<0.001);受邀组(无论是否筛查)与未受邀组比较,因食管癌死亡的RR值为0.70(95%CI:0.60~0.81),差异有统计学意义(P<0.001)。2009—2011年对河南省11 035人进行食管内镜筛查,其中7 038人(63.75%)食管无异常,3 775人(34.21%)确诊为癌前病变,222人(2.01%)确诊为食管癌;在食管癌确诊患者中,40~44岁、45~49岁、50~54岁、55~59岁、60~64岁和65~69岁的患者占比分别为1.4%、6.29%、16.78%、20.98%、27.97%和26.57%。另一项在我国河北省磁县农村地区进行的病例对照研究显示,筛查组食管鳞状细胞癌的累积发病率和累积死亡率分别为1.68%(363/21 653)和1.44%(312/21 653),对照组食管鳞状细胞癌的累积发病率和累积死亡率分别为1.94%(460/23 733)和1.74%(412/23 733)。2007—2013年以河南省安阳市多个村庄608 402人为研究对象的食管癌内镜筛查研究也显示,在筛查队列中确诊了23例上消化道肿瘤,其中16例为食管癌,死亡的10例消化道肿瘤中有5例为食管癌;与对照组比较,筛查组的标准化发病率和死亡率分别为0.57(95%CI:0.38~0.86)和0.47(95%CI:0.25~0.88)。2021年发表的一项多中心研究显示,在接受筛查的113 340人中发现1 127例食管癌患者和372例因食管癌死亡患者,未接受筛查的224 677人中发现2 896例食管癌患者和1485例因食管癌死亡患者,对照组299 483人中发现6 305例食管癌患者和3 317例因食管癌死亡患者;与对照组比较,筛查组发生食管癌的风险为0.74(95%CI:0.69~0.79),差异有统计学意义(P<0.001);筛查组因食管癌死亡的风险为0.40(95%CI:0.36~0.45),差异有统计学意义(P<0.001)。
2012年发表的一项评估我国高风险地区食管癌内镜筛查策略成本-效益的研究显示,50岁时进行1次内镜筛查的净现值(5 500万美元)和收益成本比(2.52)最低,我国高风险地区的食管癌筛查具有一定的成本-效益。2018年一项针对山东省上消化道癌内镜筛查的直接医疗成本分析显示,上消化道癌筛查的直接医疗成本最高为1 763.20元/例,最低为200.53元/例。一项关于我国高风险地区食管癌内镜筛查的成本估算研究显示,每个食管癌色素内镜筛查的成本为196美元,占该县人均生产总值的3.82%。一项评估风险分层内镜筛查成本效益的研究显示,与未筛查比较,随着食管癌评分阈值的降低,额外获得的质量调整生命年增加;40岁时接受内镜筛查每10万人可额外获得49~172个质量调整生命年,65岁时接受筛查每10万人可额外获得329~1 147个质量调整生命年;在人均GDP支付意愿阈值之下(10 276美元/质量调整生命年),评分阈值为8或9的风险分层内镜筛查在55岁以下人群中最具成本效益,而常规内镜筛查在55岁以上人群中最具成本效益。可见,在我国的食管癌高风险地区进行食管癌内镜筛查具有成本效益,但目前仍缺少基于中国人群的大样本多中心筛查间隔研究。根据现有证据,推荐我国食管癌高发地区人群和高风险人群每5年进行1次内镜检查。
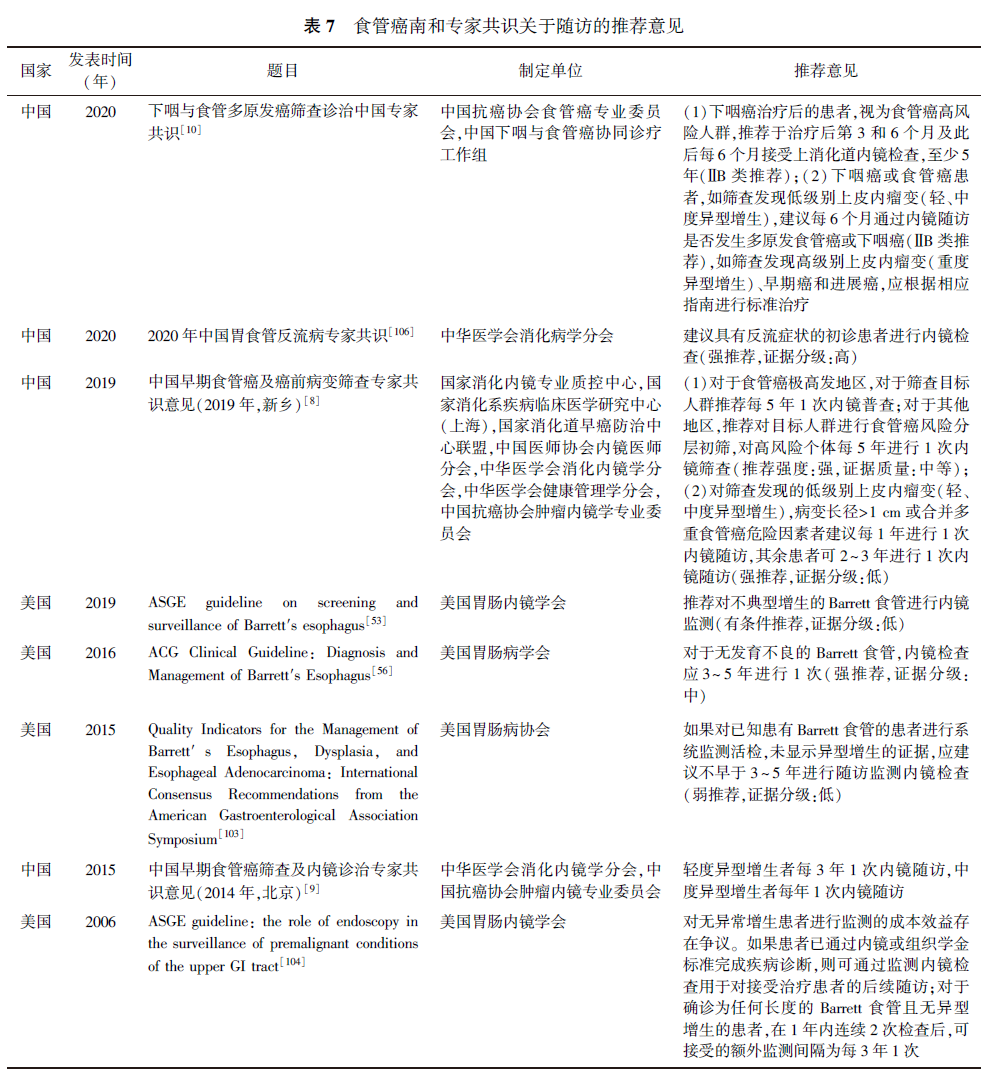
自2005年起,对河南省林州市76例鳞状上皮低级别上皮内瘤变患者随访13.5年,结果显示,18例进展为食管癌,占总数的23.7%。2009年报告的一项研究对中国歙县425人进行持续食管内镜监测,结果显示,首次内镜检查正常的308人在2年后有32例(7.5%)发生了病变;117例首次内镜检查有病变的患者中,25例在1年半内(5.9%)病情发生了进展,15例(3.5%)在1年内无任何变化,36例(8.5%)在近2年的时间发生了好转。2018年发表的一项四川大学华西医院的调查研究显示,食管黏膜低级别上皮内瘤变多见于老年人,男女比约为2.5∶1;对201处食管黏膜低级别上皮内瘤变的随访发现,58.2%的病变能达到病理逆转,28.9%无变化,12.9%进展为高级别上皮内瘤变或癌(原病变长径>1 cm者占73.1%)。2015年美国Barrett食管诊疗临床指南中表明,非典型增生的Barrett食管在接受药物治疗后的3~6个月内应接受内镜复查,而无不典型增生的Barrett食管应3~5年接受1次内镜检查。2019年美国内镜协会制定的Barrett食管筛查与监测指南推荐要对不典型增生的Barrett食管进行内镜监测。2019年我国发布的《上消化道癌人群筛查及早诊早治技术方案》中推荐有低级别上皮内瘤变的患者应每3~5年进行1次内镜随访;2020年我国发布的《下咽与食管多原发癌筛查诊治中国专家共识》指出,下咽癌治疗人群为食管癌高风险人群,推荐在治疗后第3、6个月及此后每6个月进行1次食管内镜检查,并至少坚持5年。
2015年AGA研讨会的国际共识建议,如果对已知患有Barrett食管的患者进行系统性监测活检,但未显示异型增生的证据,应建议在3~5年内进行随访监测内镜检查。2006年ASGE指南推荐,对于已确定的任意长度且无异型增生的Barrett食管确诊患者,在1年内连续检查2次后,可接受的间隔为每3年进行1次额外的检查。2016年ACG对Barrett食管的诊断和管理的临床指南也推荐,对于无异型增生的Barrett食管患者,应每隔3~5年进行1次内镜检查。2021年的一项成本-效益分析显示,非成形性Barrett食管的最佳内镜监测间隔在男性中可能为3年,在女性中为5年。
《中国早期食管癌筛查及内镜诊治专家共识意见(2014年,北京)》推荐,轻度异型增生者每3年1次内镜随访,中度异型增生者每1年1次内镜随访。《中国早期食管癌及癌前病变筛查专家共识意见(2019年,新乡)》推荐,对筛查发现的低级别上皮内瘤变(轻、中度异型增生),病变长径>1 cm或合并多重食管癌危险因素者建议每1年进行1次内镜随访,其余患者可每2~3年进行1次内镜随访。国内外食管癌指南和专家共识关于随访的推荐意见具体见表7。
综上,本指南推荐食管癌高风险人群每5年进行1次内镜检查,低级别上皮内瘤变者每1~3年进行1次内镜检查;低级别上皮内瘤变合并内镜下高危因素或病变长径>1 cm者每年接受1次内镜检查并持续5年;无异型增生的Barrett食管患者,每隔3~5年进行1次内镜检查;低级别上皮内瘤变的Barrett食管患者,每隔1~3年进行1次内镜检查。临床问题 13
食管内镜种类的选择
(A)推荐Lugol氏液染色内镜或窄带成像(narrow band imaging, NBI)内镜作为食管癌筛查的首选,条件不足者可选择普通白光内镜,有条件者可联合使用放大内镜(强推荐,证据分级:中)
(B)推荐有条件的医院尝试使用人工智能显微内镜(弱推荐,证据分级:低)
(C)推荐不能耐受常规通道内镜者尝试经鼻内镜(弱推荐,证据分级:低)
近年来,科技不断进步,又出现了多种内镜检查方式,可根据实际情况进行选择,表8详细描述了国内外食管癌指南和专家共识有关食管内镜选择的推荐意见。

2011—2014年,有学者在山东聊城地区基于6 000人的一项食管癌筛查对比研究显示,在白光内镜组(n=3 000)检出32例上消化道癌,在i-scan内镜组(n=3 000)检出51例上消化道癌,检出率差异有统计学意义(P<0.05);白光内镜组的早诊率(6.67%)与i-scan内镜组(12.00%)比较,差异有统计学意义(P<0.05);白光内镜组和i-scan内镜组的检出灵敏度分别为78.13%和82.35%,检出特异度分别为98.03%和98.52%,差异无统计学意义。另有学者在2012—2015年进行的一项比较白光内镜和NBI放大内镜在Barrett食管随访监测中应用价值的研究显示,白光内镜组平均每例患者取活检数量(5.3块)明显多于NBI放大内镜组(3.1块),差异有统计学意义(P<0.05);普通内镜的上皮内瘤变检出率(21.6%)低于NBI放大内镜组(31.8%),差异有统计学意义(P<0.05);普通内镜的上皮内瘤变诊断准确率(58.6%)低于NBI放大内镜组(93.1%),差异有统计学意义(P<0.05)。研究人员对203例食管癌高风险个体进行碘染色内镜检查发现25例食管病变(食管炎19例,低级别上皮内瘤变2例,高级别上皮内瘤变4例),染色前表现为黏膜发红与粗糙者(n=4)碘染色后有1例能正常染色,1例淡染,2例表现为不染色;染色前2例表现为黏膜发红与凹陷不规则者均表现为碘不染色;黏膜发红与粗糙的3例患者中有1例病理诊断为低级别上皮内瘤变,2例诊断为高级别上皮内瘤变;黏膜发红与凹陷不规则的2例患者均病理诊断为高级别上皮内瘤变。120例普通白光内镜检查后疑似食管病变患者进一步行NBI放大内镜检查显示,术后病理诊断为低级别上皮内瘤变的患者(n=16)NBI放大内镜的诊断符合率为62.50%,术后病理诊断为高级别上皮内瘤变的患者(n=27)NBI放大内镜的诊断符合率为81.48%,术后病理诊断为早期食管癌的患者(n=77)NBI放大内镜的诊断符合率为100.00%,且对3种不同类型病变的诊断符合率差异有统计学意义。研究者在2016—2018年间对宿迁市500例患者的内镜检查研究发现,普通白光内镜诊断早期食管癌的灵敏度、特异度和准确度分别为49.32%、97.42%和90.40%,NBI放大内镜诊断早期食管癌的灵敏度、特异度和准确度分别为79.45%、97.89%和95.20%,NBI放大内镜联合Lugol氏液染色诊断早期食管癌的灵敏度、特异度和准确度分别为95.89%、99.30%和98.80%,两两比较,差异均有统计学意义(均P<0.05)。43例早期食管癌的碘染色与NBI筛查结果显示,碘染粉色征诊断早期食管癌的诊断准确率、灵敏度和特异度分别为87.23%、91.67%和82.61%,NBI背景着色征诊断早期食管癌的诊断准确率、灵敏度和特异度分别为89.36%、87.50%和91.30%,二者诊断准确度的差异无统计学意义(P>0.05)。广东省阳江市人群的一项比较研究(NBI内镜和普通内镜组)显示,NBI内镜的消化道早癌及癌前病变检出率为98.0%,高于普通内镜组(78.0%),差异有统计学意义(P<0.05)。有学者在2018年通过病理活检验证发现,Lugol氏液染色内镜检测轻度、中度、重度食管异型增生及食管癌的灵敏度分别为45.9%、55.3%、87.0%和97.7%。法国学者比较NBI和Lugol氏液染色内镜,以334例食管鳞癌患者为研究对象,发现Lugol氏液染色内镜的灵敏度、特异度、阳性似然比和阴性似然比分别为100.0%、66.0%、21.2%和100.0%;NBI内镜的灵敏度和特异度分别为100%和79.9%,NBI内镜的特异度高于Lugol氏液染色内镜,差异有统计学意义(P=0.002)。可见,Lugol氏液染色内镜和NBI内镜是食管癌筛查的首选,条件受限者可以选择普通内镜或碘染色,条件允许者可以选择NBI放大内镜。因此,本指南推荐Lugol氏液染色内镜或NBI内镜作为食管癌筛查的首选,条件不足者可选择普通白光内镜联合碘染色,有条件者可联合放大内镜。
2015年研究者开发出一种高分辨显微内镜通过定量图像分析提高内镜下食管鳞癌筛查的准确性,通过对中美3家医院177例375处经标准内镜确诊的食管鳞状上皮内瘤变的图像分析,结果显示,训练集的灵敏度和特异度分别为93%和92%,测试集的灵敏度和特异度分别为87%和97%,独立验证集的灵敏度和特异度分别为84%和95%。一种新型、低成本、高分辨率显微内镜作为Lugol氏液染色内镜辅助设备的诊断准确性研究显示,单独Lugol氏液染色内镜与高分辨率显微内镜作联合Lugol氏液染色内镜的灵敏度分别为91%和96%(P=0.083 2),特异度分别为48%和88%(P<0.001),整体精确度分别为57%和90%,差异有统计学意义。有学者对一种新的完全自动化、实时图像分析和平板界面的高分辨显微内镜通过测试发现,该分析系统的灵敏度和特异度分别为95%和91%,而第一代高分辨显微内镜的灵敏度和特异度分别为84%和95%。2018年,有学者开发出一种计算机辅助的容积激光内镜,通过测试发现借助于临床模型的开发该检测方法可以提高早期食管癌的分类精确度,且有望超过人类专家。有研究者在2018年报告了一种新型多光谱散射内镜,该系统可以通过分析从上皮细胞散射的光来检测和识别不可见的异常发育情况,且通过光纤探头可以快速扫描整个食管内膜;测试显示其对食管疾病诊断的准确度达96.49%(55/57),活检验证显示其对单个部位的诊断准确度也达90%以上。有研究显示,计算机辅助-NBI内镜用于食管鳞癌筛查的灵敏度、特异度和准确性分别为91.0%、96.7%和94.3%,计算机辅助-白光内镜用于食管鳞癌筛查的灵敏度、特异度、准确性分别为98.5%、83.1%和89.5%;计算机辅助-NBI内镜用于食管鳞癌筛查的准确度和特异度高于计算机辅助-白光内镜,差异有统计学意义(P<0.01)。可见,计算机辅助系统高分辨显微内镜、多光谱散射内镜和新型激光内镜等可能具有更高的诊断准确性和特异度,但需要更多的证据支持,且需要有条件的医院才能开展。因此,本指南推荐有条件的医院可以尝试使用人工智能显微内镜。
有研究显示,在食管癌筛查中更多的患者愿意选择经鼻内镜而非传统内镜,其理由为经鼻内镜更为舒适。在美国和英国进行的一项多中心前瞻性队列研究显示,在200例食管疾病患者中,54.2%的患者更愿接受经鼻内镜,高于常规内镜的16.7%,差异有统计学意义(P<0.001);经鼻内镜患者与常规内镜患者的疼痛视觉模拟评分分别为7.2和6.4分,差异有统计学意义(P=0.000 4)。2016年发表的ACG Barrett食管诊疗指南中提出,经鼻内镜可作为常规内镜筛查Barrett食管的一种替代方法,但证据级别较低。可见,经鼻内镜有望替代常规内镜成为一种主流选择,但需要更多的证据支持。因此,本指南推荐不能耐受常规通道内镜者可尝试经鼻内镜。
一项纳入9项研究、覆盖626名无症状人群的Meta分析显示,磁控胶囊内镜灵敏度为0.94(95%CI:0.90~0.97),特异度为0.73(95%CI:0.51~0.89),阳性似然比为3.1(95%CI:1.65~5.38),阴性似然比为0.09(95%CI:0.04~0.21),与传统胃镜比较,差异无统计学意义。一项纳入7项研究涉及916例患者和745处胃部病变的Meta分析显示,胶囊内镜平均检查时间为(21.92±8.87)min,磁控胶囊内镜检查的灵敏度为87%(95%CI:84.0~89.0),识别胃溃疡的灵敏度为82%(95%CI:71.0~89.0),识别胃息肉的灵敏度为82%(95%CI:76.0~87.0),识别胃糜烂的灵敏度为95%(95%CI:86.0~98.0)。但目前国内人群磁控内镜的可接受度及经济成本仍缺乏高级别的证据,因此本指南暂不推荐选择磁控内镜进行食管癌筛查。临床问题 14
食管内镜检查操作过程
(A)建议食管内镜下对全部食管黏膜进行系统的观察,并需要有充分与合理的检查时间(强推荐,证据分级:低)
(B)内镜检查时间至少持续7 min,观察食管时间不少于3 min(弱推荐,证据分级:中)
(C)推荐使用黏液祛除剂和祛泡剂来提高食管内镜下黏膜的可见度,并要求患者内镜筛查前应禁食6 h以上、禁水2 h以上(强推荐,证据分级:极低)
一般认为内镜检查时间越长则病变的检出率越高,但延长内镜检查时长对镇静要求更高且严重降低患者的耐受性。一项基于日本人群探索内镜筛查时间的研究显示,平均内镜检查时间为4.4 min组、6.1 min组和7.8 min组内镜医师检出肿瘤病灶的概率分别为0.57%、0.97%和0.94%;与检查时长<5 min组比较,5~7 min组和>7 min组肿瘤病灶检出率比值比(OR)分别为1.90(95%CI:1.06~3.40)和1.89(95%CI:0.98~3.64)。2017年基于韩国人群的一项回顾性研究得出同样的结论,8名医师的平均检查时长为2.38 min、6名医师的平均检查时长为3.25 min,与内镜检查短时间组比较,长时间组的内镜医师更有可能检查出上消化道癌(OR=1.52,95%CI:1.17~1.97)。可见,系统的检查并保证足够的时长对食管癌内镜筛查非常重要。因此,本指南建议食管内镜对全部食管黏膜进行系统的观察,并需要有充分与合理的检查时间。
检查时间是诊断性内镜检查中最主观的操作员因素之一。理想情况下,内镜检查时间越长,内镜检查期间高危病变的检出率越高。然而,在临床实践中,时间有限且延长内镜检查过程会降低患者的耐受性,并将对内镜检查中心产生重大的资源影响。一项回顾性队列研究结果表明,平均内镜检查时间超过7 min的内镜医师发现高危病变和肿瘤性病变的可能性是进行较短检查时间的内镜医生的2.50倍(OR=2.50,95%CI:1.52~4.12)和3.42倍(OR=3.42,95%CI:1.25~10.38)。日本的一项回顾性队列研究表明,中速(5~7 min)和慢速(>7 min)的食管胃十二指肠内镜医师发现肿瘤性病变是快速(<5 min)内镜医师的2倍左右(OR 值分别为1.90(95%CI:1.06~3.40)和1.89倍(95%CI:0.98~3.64)。一项多中心前瞻性队列研究显示,随着检查时间的增加,内镜下发现可疑病变的比例增加(≤2 min,30%;3~4 min,35.5%;5~6 min,82.1%;≥7 min,84.6%;P<0.001);黏膜高级别异型增生(high-grade dysplasia, HGD)或早期腺癌的比例也增加(≤2 min,15%;3~4 min,32.3%;5~6 min,46.4%;≥7 min,69.2%;P=0.001),延长内镜检查时间可提高HGD和腺癌的检出率。因此,参考欧洲胃肠内镜检查指南和亚洲对上消化道肿瘤诊断标准的共识,本指南推荐内镜检查时间至少为7 min。
一项纳入10项原始研究(n=1 541)的Meta分析结果显示,与未使用二甲基硅油比较,使用二甲基硅油可改善内镜下的可见度(加权均数差为-4.3,95%CI:-4.94~-3.67)。《中国早期早期食管癌筛查及内镜诊治专家共识意见》指出,接受食管筛查者应禁食6 h以上、禁水2 h以上,且认为在检查前10~20 min给予黏液祛除剂及祛泡剂口服可有利于改善视野,检查前5 min在麻醉医师的配合下给予镇静或麻醉可提高内镜的接受度。一项研究评估了上消化道内镜筛查预用药能否提高早期癌和癌前病变的检出率和黏膜可见度,结果显示,预用药虽不能提高病变检出率,但可显著提高消化道的黏膜可见性。《中国早期食管癌及癌前病变筛查专家共识意见(2019年,新乡)》推荐,内镜筛查前应完善检查前准备,禁食>6 h,禁水>2 h,可应用黏液祛除剂和祛泡剂口服改善内镜观察视野。食管癌指南和专家共识关于筛查前准备的推荐意见详见表9。因此,本指南推荐使用黏液祛除剂和祛泡剂来提高食管内镜下黏膜的可见度,并要求患者内镜筛查前应禁食6 h以上、禁水2 h以上。

临床问题 15
PET-CT筛查食管癌的有效性
(A)不推荐使用 18F-FDG PET-CT检查进行食管癌早期筛查(弱推荐,证据分级:中)
(B)不推荐使用PET-CT检查进行食管癌早期筛查(弱推荐,证据分级:低)
一项2017年的回顾性研究对8 468名研究对象进行18F-FDG PET,结果显示,18F-FDG PET筛查食管癌的灵敏度为3.6%(95%CI:0.1%~18.3%),特异度为99.7%(95%CI:99.6%~99.7%),阳性预测值为2.0%(95%CI:0.0%~10.4%),阴性预测值为99.8%(95%CI:99.7%~99.9%),筛选灵敏度较低。
目前,尚无指南或专家共识推荐使用PET-CT进行食管癌筛查。《中国早期食管癌筛查及内镜诊治专家共识意见(2014年,北京)》指出,PET-CT在检测食管癌远处转移方面具有明显优势,但对早期食管癌的诊断价值有限。2017年相关专家共识提出PET-CT可用来判断食管癌N分期,但其灵敏度和特异度较低。食管癌指南和专家共识关于食管癌筛查中PET-CT选择的推荐意见详见表10。

综上,目前使用PET-CT筛查食管癌证据单一且缺乏高级别的证据,另尚无经济成本评估的研究发表。结合国内实际情况,本指南不推荐PET-CT用于食管癌筛查。(六)针对不同筛查结果的治疗与管理临床问题 16
食管癌早期治疗方法
(A)推荐早期食管癌内镜治疗前通过内镜检查评估病变范围、分期以及浸润深度(强推荐,证据分级:中)
(B)对于符合内镜下切除的绝对和相对适应证的早期食管癌患者,推荐进行内镜下切除,首选内镜黏膜下剥离术(endoscopic submucosal dissection, ESD);病变长径≤10 mm时,如果能保证整块切除,也可以考虑内镜下黏膜切除术(endoscopic mucosal resection, EMR)治疗(强推荐,证据分级:高)
(C)对采用EMR切除后的早期食管腺癌患者,推荐在EMR切除后进行消融治疗,提高治愈率、降低食管狭窄与穿孔的发生率(弱推荐,证据分级:高)
(D)内镜下射频消融术(radio frequency ablation, RFA)可用于治疗局限于黏膜固有层以内的食管鳞癌。因病灶过长、近环周等原因难以整块切除或患者不耐受内镜切除术时可考虑内镜下RFA(弱推荐,证据分级:中)
(E)对于病变浸润深度达到黏膜下层(>200 μm)的T1b期食管癌患者,有淋巴结或血管侵犯,肿瘤低分化(≥G3),应行食管切除术,拒绝手术或手术不耐受者可行同步放化疗(强推荐,证据分级:中)
食管腺癌和鳞癌均可行内镜下切除。在进行内镜治疗前,对食管癌患者进行广泛而准确的分期诊断是至关重要的。肿瘤浸润深度、肿瘤边缘的识别和淋巴结转移的评估是决定内镜治疗的可行性和选择治疗方式的关键。多种内镜检查技术如染色内镜、NBI、共聚焦内镜、光谱学、放大内镜、超声内镜和其他先进的内镜成像技术可以检测食管癌的范围和深度。
Lugol氏液染色内镜是识别早期食管癌病变的最有效的染色内镜,Lugol氏液染色内镜在区分高级别上皮内瘤变和早期食管鳞癌与低级别上皮内瘤变和非癌性病变方面的准确率为73.8%~93.4%。因此,推荐采用Lugol氏液染色内镜在内镜切除前评估早期食管癌的边界。图像增强内镜检查是一个快速的过程,与Lugol氏液染色内镜检查不同,它不会引起食管癌病变周围的炎症。在一项包含90例高级别上皮内瘤变和早期食管癌患者的研究中,NBI图像增强内镜的准确率(92%)明显高于白光内镜(67.8%,P<0.05),与Lugol氏液染色内镜(93.4%,P>0.05)相似。因此,推荐采用Lugol氏液染色内镜或图像增强内镜在内镜切除前确定早期食管癌的边界。对于早期食管癌,超声内镜可以准确判断原发灶的浸润程度(T期)和有无淋巴结转移(N期)。多项系统评价和Meta分析结果表明,超声内镜鉴别早期食管癌黏膜浸润和黏膜下浸润的ROC曲线下面积为0.93~0.98。因此,推荐采用超声内镜在内镜治疗前评估早期食管癌的分期。尽管有研究显示,NBI放大内镜对于食管癌浸润程度的判断(65.3%)并不优于传统内镜(71.4%,P=0.375)。然而,一项大规模回顾性研究显示,NBI放大内镜对早期食管癌上皮/固有层浸润的阳性预测值为93%,对黏膜下肌层/浅层浸润的阳性预测值为65%,对黏膜下深层浸润的阳性预测值为77%,表明NBI放大内镜在内镜治疗前确定早期食管癌的浸润深度是有效的。因此,推荐采用NBI放大内镜在内镜治疗前评估早期食管癌的浸润深度。综上所述,并根据韩国早期胃肠道癌内镜切除术临床实践指南,推荐早期食管癌内镜治疗前通过内镜检查评估病变范围、分期以及浸润深度。
根据《中国早期食管癌筛查及内镜诊治专家共识意见(2014年,北京)》和《日本食管癌实践指南(2017版)》,食管癌内镜下切除的绝对适应证为病变局限于上皮层和黏膜固有层的T1a期食管癌,淋巴结转移风险低;内镜下切除的相对适应证为病变延伸至黏膜肌层或轻微浸润黏膜下层(黏膜下浸润深度<200 μm),范围>3/4环周、切除后狭窄风险大的病变,但应向患者充分告知术后狭窄等风险;浸润深度(>200 μm)达到黏膜下层(T1b)的病变与转移有关,在这种情况下,即使它们被归类为浅表性癌,也应该以与晚期癌相同的方式进行治疗。
早期食管癌的内镜切除技术主要包括EMR、ESD等,EMR是指内镜下将黏膜病灶整块或分块切除,用于胃肠道表浅性癌诊断和治疗的方法。EMR操作简便,创伤小。回顾性队列研究表明,EMR是一种安全有效治疗早期食管癌的方法(完全缓解率91%~98.8%)。ESD是在进行黏膜下注射后使用特殊电刀逐渐分离黏膜层与固有肌层之间的组织,将病变黏膜和黏膜下层完整剥离的方法。回顾性队列研究显示,ESD治疗早期食管鳞癌的整体切除率为98%~100%,根治切除率为71%,复发率为2.9%;ESD治疗食管腺癌的整体切除率为97%,根治切除率为78%。病变大小是选择ESD或EMR的主要标准。对于可以整块切除的长径<2 cm的病变,EMR可以安全切除,并允许对浸润深度和分化程度进行充分的组织学检查;对长径>2 cm的病变,EMR无法获得整块病变组织,就可能导致术后病理的评估有偏差,从而使食管癌复发率升高。相比之下,ESD拥有较高的整块切除率和完全切除率。一项纳入22篇队列研究共2 752例患者的系统评价和Meta分析显示,与EMR比较,ESD的整体切除率(OR=36.32,95%CI:20.64~63.91;P<0.000 1)和根治切除率(OR=9.74,95%CI:4.83~19.62;P<0.000 1)更高,复发率更低(OR=0.10,95%CI:0.06~0.15;P<0.000 1),然而分层分析结果显示,只有当病灶长径>20 mm时,ESD才在整块切除、根治性切除和局部复发率方面表现出更好的效果。多项系统评价与Meta分析和回顾性队列研究均得出ESD优于EMR的结果。根据ESGE和韩国早期胃肠道癌内镜切除术临床实践指南,对于早期食管癌,ESD是首选治疗方式;当病灶长径≤10 mm时,如果能整块切除,也可以考虑EMR。
内镜下非切除治疗包括RFA、氩离子凝固术(argon plasma coagulation, APC)、光动力治疗(photo dynamic therapy, PDT)、冷冻治疗等。RFA在多发、病变较长或累及食管全周的早期食管癌及其癌前病变的治疗中具有明显优势。回顾性队列研究显示,EMR联合RFA在根除早期食管腺癌内镜切除术后残留病变具有良好的疗效。一项纳入1 384例患者的回顾性队列研究显示,EMR后RFA治疗Barrett食管的完全根除率为94%,仅有3%出现复发。一项纳入6篇前瞻性和14篇回顾性队列研究的系统评价和Meta分析显示,接受EMR联合RFA的患者有较高的Barrett食管根除率(93.4%),而狭窄发生率为10.2%,出血发生率为1.1%,穿孔发生率为0.2%;接受EMR的患者也表现出较高的Barrett食管根除率(94.9%),但不良事件发生率较高(狭窄发生率为33.5%,出血发生率为7.5%,穿孔发生率为1.3%,P<0.01)。此外,多种消融方法对早期食管腺癌具有较好的根除残留病变效果。一项回顾性分析结果显示,冷冻治疗对早期食管癌的完全缓解率为66.2%。一项随机对照试验结果显示,APC具有和RFA相似的疗效和安全性(OR=0.7,95%CI:0.2~2.6),且成本更低。根据ESGE指南,在内镜下切除含有任何程度的异型增生或肿瘤的可见异常后,最好使用RFA争取完全根除所有残留的病变。
内镜下RFA可用于治疗局限于黏膜固有层以内的鳞癌,目前有研究报道了RFA在早期食管鳞癌中的治疗效果,特别是在病灶过长、近环周的早期食管鳞癌。一项前瞻性病例系列报道显示,在对7例超长病变(Lugol氏液染色内镜显示未染色区病变占食管周长的50%以上,平均长度>10 cm)的早期扁平型食管鳞癌进行RFA治疗中,有6例在6个月后完全缓解,1例因反复静脉曲张出血和随访期间效果不佳而不适合再次消融,无患者表现出肿瘤进展;随访7~24个月,平均随访时间为10.5个月,无局部复发。一项回顾性研究结果显示,对33例病变累及食管周径 ≥3/4周的早期食管鳞癌和癌前病变的患者进行RFA治疗,首次治疗缓解率为69.37%(23/33),随访12个月后,缓解率为93.9%(31/33),所有患者均无出血、穿孔,6例术后出现狭窄。此外,也有多项研究报道了可以保守使用RFA治疗早期食管鳞癌。尽管如此,RFA治疗早期食管鳞癌也存在一些不良后果,有研究报道RFA治疗后食管狭窄的风险较大(21%)。在一项英国多中心队列研究中,联合RFA和EMR或ESD治疗早期食管鳞癌的完全缓解率为50%,然而有30%的患者在1年内进展为浸润性癌。准确的疾病分期对于RFA治疗的成功至关重要,然而,即使再仔细的内镜检查,也可能遗漏有深层组织侵犯的病变,因此,进行RFA治疗时应保守考虑。综上,内镜下RFA可用于治疗局限于黏膜固有层以内的鳞癌,因病灶过长、近环周等原因难以整块切除或患者不耐受内镜切除术时可考虑应用。
与原位癌(Tis)和黏膜内癌(T1a)病变比较,所有浸润到黏膜下层的T1b肿瘤都有很高的淋巴结受累率。一项对7 645例食管癌患者的系统回顾研究显示,T1a病变的淋巴结阳性率仅为0~8%,而黏膜下癌(T1b)病变的淋巴结阳性率为27%~54%。侵犯黏膜下层的肿瘤发生淋巴结转移的可能性显著增加,因此应该行食管切除术。多项研究结果显示,食管切除术与内镜下切除治疗早期食管癌的总生存期和预后无明显差别。此外,一项纳入7篇队列研究共870例患者的系统评价和Meta分析结果显示,内镜治疗和手术治疗术后患者1、3、5年生存率、肿瘤缓解率、肿瘤相关或手术相关死亡率差异无统计学意义,随访期间内两组患者的累积死亡率分别为11.4%和8.7%;但与手术治疗组比较,内镜治疗组复发率更高(RR=9.85,95%CI:2.78~34.81)。因此,对黏膜下浸润的T1b期食管癌患者,食管切除手术的预后更好。一项系统评价显示,食管癌淋巴结转移的预测因子依次为肿瘤3级分化、黏膜下层深层(>200 μm)浸润、淋巴血管和微血管浸润,如果出现这些特征中的任何一种,应该考虑进行食管切除术,而不是内镜切除治疗。
对于不能或不愿意接受手术的食管癌患者,放化疗联合效果优于单纯放疗。一项回顾性研究结果显示,接受放化疗治疗食管癌患者的存活率明显优于单独放疗的患者(HR=1.699,95%CI:1.466~1.968,P=0.000)。此外,日本的一项前瞻性Ⅱ期临床研究(JCOG9708)结果显示,在临床分期Ⅰ期的患者中,放化疗(60 Gy,分30次完成,顺铂+氟尿嘧啶)具有良好的疗效,完全缓解率为87.5%,4年生存率为80.5%,4年无复发生存率为68.1%,无严重不良反应事件。以上研究表明,接受放化疗的食管癌患者生存时间明显长于单独接受放疗的患者,且放化疗组的有效率较高。根据2017版日本食管癌实践指南,推荐对不适合手术的患者采用放化疗,而非单纯放疗。临床问题 17
食管癌前病变早期治疗方法
(A)病理学显示食管鳞状上皮低级别上皮内瘤变,但内镜下有高级别病变表现或合并病理学升级危险因素者可行内镜下切除,未行切除者应3~6个月内复查内镜并重新活检;因病灶过长、近环周等原因难以整块切除或患者不耐受内镜切除术时可考虑应用RFA(强推荐,证据分级:中)
(B)病理学显示鳞状上皮高级别上皮内瘤变且经内镜或影像学评估无黏膜下浸润和淋巴结转移者,推荐内镜下整块切除;因病灶过长、近环周等原因难以整块切除或患者不耐受内镜切除术时可考虑应用RFA(弱推荐,证据分级:中)
(C)Barrett食管伴黏膜低级别异型增生(low-grade dysplasia, LGD)的患者推荐内镜下射频消融治疗,未行治疗者每6~12个月随访1次;Barrett食管伴HGD,首选内镜下切除后行RFA(强推荐,证据分级:高)
食管鳞状上皮低级别上皮内瘤变绝大部分(70%~90%)会出现病理逆转(即转变为炎症、鳞状上皮增生或胃黏膜异位或病变完全消失)或病理等级不变;存在炎症背景的低级别上皮内瘤变患者可因黏膜溃疡、炎性损伤后反应性修复增生在短期内显示病理异常结果,但此类病变经药物治疗后复查多数可复原。对201处低级别上皮内瘤变的随访研究结果显示,58.2%的研究对象(其中原病变长径≤1 cm者占60.7%)病变发生病理逆转(包括24.9%的病变完全消失);28.9%的研究对象病变病理结局无变化,仍为低级别上皮内瘤变;12.9%(其中病变长径>1 cm者占73.1%)进展为高级别上皮内瘤变或浸润性癌。此外,流行病学研究显示,食管鳞状上皮低级别上皮内瘤变患者癌变风险较一般人群显著增高。来自河南省林州市的76例鳞状上皮低级别上皮内瘤变患者在13.5年的随访中有18例患者进展为食管癌(23.7%),是该地区一般人群风险的2.9倍。因此,根据问题12所述,建议对食管鳞状上皮低级别上皮内瘤变病变长径>1 cm或合并多重食管癌危险因素者进行监测随访。
食管鳞状上皮低级别上皮内瘤变患者在ESD术后可发生病理学升级,有研究显示,25%~44.7%的食管鳞状上皮低级别上皮内瘤变升级为鳞状上皮高级别上皮内瘤变,甚至有7.0%~8.2%升级为早期食管鳞癌。黏膜表面发红、结节样改变及病变纵径≥3 cm是术后病理学升级的危险因素。因此,活检诊断为食管鳞状上皮低级别上皮内瘤变的食管病灶,若伴随病灶黏膜表面发红、结节样改变或纵径≥3 cm也可考虑内镜下诊断及根治性切除。根据我国食管鳞癌诊治专家共识,如果病灶在内镜下表现为碘染色Ⅰ级、粉色征或银色征阳性,或放大内镜下显示B型皮乳头内毛细血管袢、存在明显背景着色或无血管区等高级别病变表现或存在病理学升级危险因素,即使活检病理学显示低级别上皮内瘤变仍应考虑内镜下诊断和根治性切除;如不行内镜下切除,应在3~6个月内复查内镜并重新活检。
RFA可用于食管低级别上皮内瘤变的治疗,主要用于治疗常规ESD及EMR难以切除的平坦型过长、近环周病变,消除内镜切除术后残余病灶或内镜切除高风险病灶(如合并食管静脉曲张等)。一项回顾性研究显示,RFA治疗16例食管低级别上皮内瘤变的患者的病灶消除率达91.30%,患者术后均未出现出血、穿孔等并发症,且全部患者射频治疗处黏膜均愈合,其中37.50%(6/16)的患者内镜下可见红色瘢痕样形成。此外,有研究显示也可应用APC治疗食管低级别上皮内瘤变,一项前瞻性研究采用APC治疗5例食管低级别上皮内瘤变患者,5例患者均达到完全缓解,经12个月随访,无一例出现局部复发、吞咽困难或食管狭窄。一项随机对照试验研究结果显示,APC治疗组患者痊愈,随访6周~3年,无一例出现复发,且患者均未出现发热、穿孔及狭窄等并发症。此外,也有研究报道冷冻疗法可用于治疗食管低级别上皮内瘤变。但这些内镜下非切除治疗的治疗效果仍需要进一步的研究。因此,建议可以考虑使用RFA、APC等方法治疗因病灶过长、近环周等原因难以整块切除或不耐受内镜切除术的食管鳞状上皮低级别上皮内瘤变患者。
与食管鳞状上皮低级别上皮内瘤变不同,高级别上皮内瘤变逆转或消退的可能性很小,是国内较为公认的早期食管癌和癌前病变内镜下切除的绝对适应证之一。因此,高级别上皮内瘤变的处理方式与早期食管鳞癌类似,在内镜检查评估病变范围、分期、浸润深度后,行内镜下整块切除,首选ESD。
一项纳入96例患者(中度异型增生45例,重度异型增生42例,食管鳞癌9例)的队列研究显示,接受1次或多次RFA治疗后患者1年完全缓解率为84%,其中中度、重度异型增生和早期食管癌患者的完全缓解率分别为98%、81%和67%,术后食管狭窄发生率为21%。台湾的一项队列研究显示,对于常规ESD及EMR难以切除的鳞状上皮超长(>10 cm)或环周(>50%食管周径)病变,1次或多次RFA治疗后85.7%的患者可达完全缓解,随访10个月内局部复发率为0,且大部分患者(71.4%)未发生食管狭窄。与内镜下切除比较,RFA操作难度低、治疗深度确定、术后狭窄发生率低,但其主要局限性在于治疗深度限于黏膜层,且不能获得整块病灶样本进行准确的病理学分期。对于病灶过长、近环周以及不能耐受内镜下切除或者其他原因放弃手术的患者,在充分沟通情况下可考虑RFA。已有初步研究报道其他内镜非切除治疗技术包括PDT和APC治疗等可用于食管浅表鳞癌及癌前病变的治疗,但应用不及RFA成熟,仍有待进一步研究提供更多证据支持。综上所述,并根据我国食管鳞癌诊治专家共识,推荐鳞状上皮高级别上皮内瘤变患者行内镜下切除,因病灶过长、近环周等原因难以整块切除或患者不耐受内镜切除术时可考虑应用RFA。
Barrett食管伴LGD和HGD是食管腺癌的癌前病变。我国食管癌的病理类型主要是以鳞癌为主,但是随着胃食管反流病的增加,我国Barrett食管和食管腺癌的发病率也在增加。LGD一直被认为是一种低风险病变,其进展机会很低。一项纳入24篇队列研究的系统评价和Meta分析结果显示,Barrett食管伴LGD患者仅有0.54%进展到食管腺癌。RFA是治疗Barrett食管伴LGD的首选治疗方式。一项纳入4项研究共543例Barrett食管伴LGD患者的系统评价和Meta分析显示,与内镜监测比较,接受RFA治疗的Barrett食管伴LGD患者进展为HGD或食管腺癌的概率显著降低(OR=0.17,95%CI:0.04~0.65)。此外,一项随机对照试验显示,Barrett食管伴LGD患者的RFA治疗组与内镜监测组的肠化生完全根除率分别为35%和0(P<0.001),3年后,RFA治疗组持续性LGD患病率为34.3%(95%CI:18.6~50.0),而监测组持续性LGD患病率为58.1%(95%CI:40.7~75.4),OR值为0.38(95%CI:0.14~1.02,P=0.05),发现肿瘤进展的比例分别为12.5% 和26.2%(P=0.15)。有多项研究显示,RFA治疗Barrett食管伴LGD可降低进展为腺癌的风险(1.5%~8.9%的风险进展为腺癌)。综上所述,并根据ESGE指南和AGA指南,对于Barrett食管伴LGD患者,推荐内镜下射频消融治疗,不行治疗者每6~12个月随访1次。
从扁平型HGD到食管腺癌的进展率为每年5%~8%,真正的扁平型HGD并不常见,大多数HGD患者内镜检查可见病变。多项回顾性研究显示,EMR联合RFA治疗Barrett食管伴HGD安全有效。一项纳入7篇队列研究共1 950例患者的系统评价和Meta分析显示,使用EMR联合RFA治疗HGD的效果明显优于单独使用RFA的效果[risk difference(RD)=0.35,95%CI:0.15~0.56]。此外,冷冻治疗也可用来治疗Barrett食管伴HGD,已有许多研究结果证实其有效性,可酌情考虑采用冷冻治疗,但仍有待进一步研究提供更多证据支持。综上所述,并根据ESGE指南和AGA指南,Barrett食管伴HGD患者,首选内镜下切除后射频消融治疗。临床问题 18
食管癌和癌前病变患者的治疗后管理
(A)病灶超过食管周径3/4的食管癌和癌前病变行内镜切除术后应积极预防食管狭窄,推荐局部注射类固醇、口服类固醇和球囊扩张(强推荐,证据分级:高)
(B)早期食管鳞癌及癌前病变内镜治疗后第1年每3~6个月应复查,包括上消化道内镜及其他相应检查,若无明显异常,第2年开始可每年进行1次复查(弱推荐,证据分级:低)
(C)建议在内镜切除或消融治疗Barrett食管相关LGD、HGD或早期腺癌后定期进行内镜随访(强推荐,证据分级:高)
狭窄是食管早期癌及癌前病变内镜切除术后最常见的不良事件。ESD可导致手术部位周围形成疤痕,继而导致食管狭窄。一项纳入13篇回顾性研究和2篇前瞻性队列研究的系统评价与Meta分析结果显示,食管鳞癌ESD术后狭窄总体发生率为11.6%。一项回顾性研究显示,周径大(OR=1.58,P<0.001)和手术时间长(OR=1.02,P=0.007)是ESD术后狭窄的危险因素。内镜治疗食管癌时,病变周长超过食管周长3/4的患者术后狭窄的发生率较高(70.1%~100%)。内镜下局部注射类固醇及口服类固醇、内镜下球囊扩张术是目前报道较多的食管狭窄预防措施。在一项随机对照试验中,口服类固醇可显著降低食管狭窄发生率(服用类固醇的患者为17.6%,未服用类固醇的患者为68.7%),术后需要球囊扩张的频率也显著降低[中位数分别为4.6(2~10)和8.1(1~18);P<0.01]。一项回顾性队列研究结果显示,与未注射类固醇组比较,34例ESD术后接受黏膜下曲安奈德注射的患者食管狭窄发生率显著降低(分别为14.7%和51.5%,P<0.01),术后需要球囊扩张的频率也显著降低(平均数分别为0.2和3.3,P<0.01)。一项回顾性研究显示,内镜球囊治疗食管狭窄有效率为92.9%。另一项回顾性研究显示,与未接受预防性球囊扩张组比较,29例接受预防性球囊扩张的食管癌患者食管狭窄发生率显著降低(分别为59%和92%,P=0.04),这些患者接受了内镜病变切除,涉及食管周长>3/4,并在术后1周内开始接受预防性球囊扩张。综上,并根据2017年日本食管癌实践指南和韩国早期胃肠道癌内镜切除术临床实践指南,病灶超过食管周径3/4的食管癌和癌前病变行内镜切除术后应积极预防食管狭窄,推荐局部注射类固醇、口服类固醇和球囊扩张。
早期食管鳞癌及癌前病变内镜治疗后需警惕局部复发、异时性食管鳞癌或上皮内瘤变和第二原发肿瘤等,因此内镜复查随访至关重要。异时性食管癌指内镜治疗后远离原病灶瘢痕部位新检出的食管癌,食管鳞癌患者异时性食管鳞癌或癌前病变发生率可达10%~15%,可发病于任何时间,并且,食管鳞癌患者第二原发肿瘤(胃癌、头颈部鳞癌和肺癌)发病风险增加。一项回顾性队列研究显示,早期食管鳞癌食管切除术后第二原发肿瘤的发病率为3.84%(95%CI:2.98%~4.95%),常见的第二原发肿瘤是头颈癌、肺癌和胃癌。一项纳入13篇回顾性和2篇前瞻性队列研究的系统评价和Meta分析显示,早期食管鳞癌ESD术后局部复发率为11.6%,大部分复发均在术后1年以内,需要长期随访。因此,根据我国早期食管癌筛查专家共识,推荐早期食管鳞癌及癌前病变内镜治疗后第1年每3~6个月应复查上消化道内镜,若无明显异常,第2年开始可每年进行1次复查,同时应警惕异时性多原发食管鳞癌和第二原发癌(如头颈部鳞癌、胃癌等)。
Barrett食管在消融和切除治疗后可能会复发。一项回顾性队列研究显示,内镜下治疗Barrett食管伴HGD的复发率为8%,早期腺癌检出率为9.5%。多项回顾性队列研究结果表明,RFA治疗后Barrett食管复发风险为11%~24%。任何Barrett食管在2年内的累积复发风险为19%,在接下来8.6年内的复发风险为49%。严格的内镜监测被认为是必要的。一项纳入2项病例对照研究和6项队列研究的Meta分析显示,与未监测的食管癌患者相比,内镜下监测的食管癌患者死亡率显著降低29%(HR=0.71, 95%CI:0.66~0.77)。一项纳入12篇回顾性队列研究、7篇前瞻性研究以及2篇随机对照试验的系统评价和Meta分析结果显示,食管肠上皮化生第1年的检出率明显高于之后几年(RR=1.80,95%CI:1.29~2.49),异型增生第1年检出率显著高于后几年(RR=1.92,95%CI:1.32~2.80),HGD或早期食管腺癌第1年检出率最高(RR=1.58,95%CI:0.94~2.65)。美国一项队列研究结果显示,LGD患者年复发率为1.98%(95%CI:1.34%~2.93%),HGD患者年复发率为5.93%(95%CI:4.77%~7.36%),建议LDG患者在食管肠上皮化生完全根除后1年和3年进行内镜检查;HGD或早期腺癌的患者在食管肠上皮化生根除后0.25年、0.5年和1年进行内镜检查,然后每年进行1次内镜检查。目前,英国胃肠病协会指南和中国早期食管癌筛查及内镜诊治专家共识意见(2014年,北京)均建议用高分辨率内镜监测;对于Barrett食管<3 cm且不伴有肠上皮化生或异型增生(上皮内瘤变)者,经重复4个象限内镜下黏膜活检证实无肠上皮化生,建议退出监测;Barrett食管<3 cm伴有肠上皮化生者,建议每3~5年行1次内镜检查;对于Barrett食管≥3 cm者,建议每2~3年行1次内镜检查。(七)实施相关情况临床问题 19
开展食管癌筛查医师应具备的能力
食管癌筛查内镜医师应清楚了解食管的解剖学特征,具备一般内镜检查能力,开展内镜诊疗工作不少于5年,取得主治医师及以上专业技术职务任职资格;每位内镜医师至少有300例食管内镜诊疗操作的个人经验;内镜医师满足培训标准,可以进行食管癌内镜筛查(强推荐,证据分级:低)
对于内镜下病变的评估,内镜检查医师需要掌握食管的解剖学特征和基本的内镜技术,才能对黏膜和病变进行准确的观察和判断。因此,在进行内镜诊断培训之前,内镜医师必须熟练掌握标准内镜检查技术。一项研究表明,超过90%接受培训的人员在执行了200次上消化道内镜检查后能够达到95%的完成率(即在没有物理帮助的情况下将内镜通过到十二指肠)。国家卫生健康委员会2019年《消化内镜诊疗技术临床应用管理规范》建议,开展内镜诊疗技术的医师需满足:(1)执业范围为与开展消化内镜诊疗工作相适应的临床专业;(2)有5年以上临床工作经验,目前从事消化系统疾病诊疗工作,累计参与完成消化内镜诊疗病例不少于200例;(3)经过消化内镜诊疗技术相关系统培训并考核合格,具有开展消化内镜诊疗技术的能力。此外,欧洲内镜学会建议,在开始上消化道光学诊断之前,每位内镜医师至少有300例上消化道内镜的个人经验,并满足上消化道内镜的欧洲内镜学会质量标准。因此根据国家卫生健康委员会和欧洲内镜学会建议,食管筛查内镜医师应开展内镜诊疗工作不少于5年,取得主治医师及以上专业技术职务任职资格,每位内镜医师应至少有300例食管内镜诊疗操作的个人经验。
经验丰富的医师更能准确地对食管癌病变进行诊断和评估,其诊断具有较高的灵敏度。一项研究显示,在对食管癌病变的评估和诊断中,经验丰富的内镜医师组的灵敏度(100%,25/25)显著高于经验较少的内镜医师组(53%,9/17;P<0.001);经验丰富的内镜医师组NBI阳性预测值((45%,25/55)高于经验不足的内镜医师组(35%,9/26),但差异无统计学意义(P=0.50);在经验较少的内镜医师组中,前半部分患者NBI的灵敏度为43%,后半部分患者NBI的灵敏度增加到60%。内镜筛查早期Barrett食管相关肿瘤是一项挑战,研究者开发了一个基于网络的Barrett食管相关肿瘤教学培训工具,该教学培训工具制作了Barrett食管相关肿瘤及Barrett食管的内镜检查过程中的高清数字视频,供内镜医师培训学习,该研究显示,培训学习后Barrett食管相关肿瘤的中位检出率增加了30%(P<0.001)。因此,丰富的经验是诊断灵敏度提高的重要原因,医师在进行较多检查后能显著提高诊断的灵敏度。内镜医师在进行食管癌内镜下光学诊断前,应通过现场培训课程、自我学习等方式进行内镜诊断培训。目前尚缺乏相关研究确定熟练掌握诊断能力所需的内镜下光学诊断评估例数。根据国家卫生健康委员会建议,医师应当接受至少6个月的系统培训并考核合格,在指导医师指导下,参与完成培训基地按照四级手术管理的消化内镜诊疗操作不少于50例,满足培训标准,方可进行食管癌内镜诊断。临床问题 20
食管癌筛查质量控制
推荐将食管癌早期诊断率、染色内镜使用率作为食管癌筛查质量控制指标(强推荐,证据分级:低)
食管癌诊断时的临床分期是食管癌预后的最主要决定因素,增加早期食管癌比例是食管癌筛查的直接目标。早期食管癌内镜下改变不明显,其诊断需要内镜医师仔细观察。因此,推荐将食管癌早期诊断率(单位时间内上消化道内镜检查发现早期食管癌患者数占同期上消化道内镜检查发现食管癌患者总数的比例)作为食管癌筛查质量控制指标之一。如问题13所述,早期食管癌及癌前病变在白光内镜下具有一定漏诊率,首选Lugol氏液染色内镜或NBI内镜。因此,推荐将染色内镜使用率(单位时间内,食管癌筛查上消化道内镜中使用Lugol氏液染色或光学染色内镜的例数占同期食管癌筛查上消化道内镜总例数的比例)作为食管癌筛查质量控制指标之一。

原文链接:http://www.xxwk.net/archives/2630