来源公众号:食管癌前沿
摘要:
CROSS研究完成了一项强有力的随机试验,值得高度赞扬,该试验已经建立了CROSS策略(新辅助放化疗+手术),作为潜在可切除的食管癌患者的一种标准治疗。然而,10年的随访结果相当令人失望,在所有接受CROSS策略治疗的患者中,只有38%治愈,而单独接受手术的患者约为25%。另一个标准的治疗策略,围手术期化疗也产生了类似的令人失望的结果。尽管我们中的许多人都困惑,该为我们的患者选择哪种治疗。但我们得出结论,这两种策略都只产生很小的获益,我们应该有更好的治疗方案。现在可能是很好的时机:反思如何发展新的和理性的策略,而不是去传播历史经验性的方法。(JThoracCardiovascSurg2022;-:1-4)
注:原文作者并非是要否认新辅助放化疗的价值。他们在文中表达了对目前新辅助放化疗或围术期化疗长期效果的不满意(失望),他认为距离治愈食管癌还很遥远。所以千万不能由于满足于目前的治疗策略,而固步不前。
食管癌和食管胃结合部癌的最佳新辅助治疗方案仍然难以实现,但自2012年CROSS试验研究结果发表在《新英格兰杂志》上以来,极大地影响了食管癌标准诱导治疗的实践模式。研究小组总结10年的结果,新辅助放化疗组绝对的治愈率(生存率)只有38%,单独手术组治愈率25%。远处转移是死亡的主要原因。尽管完全病理反应率(pCR)为29%(腺癌23%,鳞癌49%),但最终结果仍然是令人失望的。入组患者化疗耐受性良好(术前完成率为91%),但在治疗微转移性疾病方面明显不足。Sewastjanow和同事被邀请评论CROSS的10年总结,并将其置于最现代的可切除食管或食管胃结合部癌诱导策略的背景中。自从CROSS和更有效的诱导化疗(FLOT,FOLFOX方案)在“CROSS”之前实施以来,新辅助治疗的前景有了很大的发展。“手术仍然是这种疾病最佳治疗的基石,手术技术的标准化在临床试验中是至关重要的”。循环肿瘤DNA分析用于检测新辅助治疗后的微小残留疾病是一种很有前途的方法,可能会影响未来手术的使用方式。最后,观察到免疫检查点抑制(CheckMate577)辅助治疗切除食管癌的生存改善,加强了食管癌新辅助免疫治疗的探索,开辟了一个除了CROSS策略之外的新时代。
CROSS时代
我们祝贺CROSS研究小组报告了该研究的10年随访。在研究中,366例患者(可切除,癌症长度<8cm,体重减轻<10%,年龄<75岁)患者被随机分配到术前放化疗或单独手术。与单纯手术相比,术前放化疗队列的总生存率(OS)有所改善。在这个随访期间,术前放化疗组的绝对治愈率(生存率)为38%,而单纯手术组的绝对治愈率约为25%。虽然之前一直有研究放化疗+手术的策略,很长一段时间以来的许多试验有多个缺点导致没有得到确定结论,直到CROSS研究才得到了相对很好的结果。
CROSS OR Don’t CROSS?
局限性食管癌(EC)的另一种标准方法是围手术期化疗。最近,5-氟尿嘧啶、亚叶酸、奥沙利铂和多西紫杉醇(FLOT)方案获得了一些欢迎。本研究采用FLOT化疗与表阿霉素和顺铂加上一种氟嘧啶进行了比较。该研究仅限于几个德国中心,716名患者被随机分配,这是一项成就。在中位随访时间少于3年时,FLOT的中位OS(主要终点)为50个月,表阿霉素、顺铂、5-氟尿嘧啶/表阿霉素、顺铂、卡培他滨的中位OS为35个月(风险比,0.77;95%的置信区间,0。63-0.94;P=.012)。FLOT导致3级或4级感染、中性粒细胞减少、腹泻和神经病变。只有不到50%的患者能完成规定的术后化疗,且病理反应较差。治愈率(预计在5年)似乎小于40%,尽管研究患者中含大约50%的胃癌,我们知道局部胃癌患者比胃食管交界处或更高的胸腔食管癌往往有更高的治愈率。因此,对于最新的围手术期化疗的热情来说,采用CROSS仍然是一种选择。然而,目前局部晚期食管癌的治疗选择是基于实践偏好。外科手术仍然是实现高治愈率的核心。
问题是我们被问到,这两种策略中哪一种更优?
目前正在努力回答这个问题。目前,已经启动了2项主要研究(ESOPECNCT02509286,随机438例患者;NeoAEGISNCT0172645,随机377例患者),来自Neo-Aegis的早期数据显示,两种策略的3年估计治愈率相似,约为56%。NExT试验(JCOG1109)比较了3组:(1)术前顺铂/氟尿嘧啶,(2)术前顺铂/氟尿嘧啶/多西紫杉醇,(3)顺铂/氟尿嘧啶联合放疗。分别作为术前治疗。日本的这项研究只适当地关注食管鳞状细胞癌(ESCC)。3年随访显示DCF三联化疗优于CF两药化疗,CF新辅助与CF为基础的同步放化疗无差异。所有这些研究都将产生有用的信息,并有希望回答这个问题。此时,只要说明术前放化疗或围手术期化疗的选择是一个人的偏好问题。我们没有发现令人信服的理由支持其中某一个策略,除了CROSS(新辅助放化疗)有较短的治疗时间,强化FLOT与相当大的毒性和低治疗完成率相关。与放化疗相比,一种有效的全身治疗方法可能会更好地控制许多患者的最终转移。使用CROSS策略的一个明显好处是,我们可以实现Checkmate577的积极结果。Checkmate577是一项大型的全球多中心试验,证明了纳武单抗在辅助治疗中的价值。2或3期食管鳞状细胞癌或腺癌患者(AJCC/UICC癌症分期手册,第7版),已完成同步术前放化疗后切除,但没有达到病理完全缓解,随机分为安慰剂或PD-11抑制剂nivolumab,手术后4到16周开始辅助治疗,为期1年。值得注意的是,受试者的选择和随机化只发生在切除术后恢复后,因此排除了不能或没有进行手术的患者,以及接受新辅助化疗和根治剂量放疗但不手术的患者。在2016年至2019年期间评估的1085名患者中,有794名符合条件,并按2:1的比例分配接受nivolumab(532名患者)或安慰剂(262名患者)。中位随访时间为24.4个月(6.2 ~ 44.9)。主要终点无病生存期——接受nivolumab的患者显著延长,为22.4个月(95% CI 16.6-34.0),而接受安慰剂的患者为11.0个月(95% CI 8.3-14.3) (HR 0.69;96.4%可信区间0.56 - -0.86;p = 0.001)。在这个中期报告中,次要研究终点---总生存期未被报道。美国食品和药物管理局已经批准纳武单抗用于辅助治疗。因此,如果我们想利用CheckMate577的阳性结果,那么CROSS策略可以被首选,直到我们可以在接受围手术期化疗的患者的辅助免疫治疗中获得类似的好处。
治疗耐药性
ECs(EAC或ESCC)天生对治疗具有耐药性。这在使用术前放化疗策略的多个试验报告中很明显,但在使用围手术期化疗策略时更为明显。当一个患者进行术前放化疗时,病理完全缓解率约为25%,大多数患者切除的标本中都显示还有癌细胞。然而,在使用围手术期化疗时,病理完全缓解率仅约为5%。据了解,与围手术期化疗相比,较高的pCR率并不转化为生存优势。强调一下,所有的新策略在广泛使用之前都应该在研究中心进行实施和验证。大约15%-20%的EACs有印戒细胞(SRCs),而仅仅是SRCs的存在与EAC患者的不良预后(治疗耐药性)相关。目前还不清楚这些SRCs代表什么。从癌症干细胞(CSCs)或这些细胞中分化出来的细胞实施了独特的耐药性途径(s),这是目前的标准方法无法克服的。在我们小组的一项研究中,关注预后较好的患者的分子谱,SRCs的存在超过了所有其他特征(4号染色体丢失或更高的APBEC酶签名),需要努力进一步表征SRC的分子基础,以发现独特的靶点。此外,特别是在EAC中,通过PET测量的葡萄糖摄取程度所反映的癌症代谢似乎很重要。我们主要关注病变总糖酵解(TLG)和最大值标准摄取值。我们研究了266例EAC患者,发现较高的代谢率(反映为高TLG和最大标准化摄取值)与较大的肿瘤、较高的临床分期和较高的TNM成分相关。所有这些患者都接受了根治性放化疗,只有60例患者“治愈”。“在多变量分析中,低TLG与治愈独立相关。因此,影像学研究结合临床和分子特征可能提供一个机会来开发一个签名,可以帮助为患者选择合适的治疗方法。其他的正电子发射断层扫描策略(CALGB80803)最近已经发表,还需要进一步的发展。许多研究已经证明了在CSCs存在时对治疗(化疗和或放化疗)的耐药性,以及在残余耐药性中CSCs的富集。我们能为单个患者定制方法吗?我们的工具是有限的,但未来似乎是光明的(图1)。虽然技术已经进步,但及时得到全面的分析结果仍然不现实。对这些结果的解释可能令人生畏,但各种DNA平台的局限性是实质性的和不断发展的。多平台分析(包括液体生物标志物/肿瘤抑制基因/免疫成分;图1)对于治疗选择仍然不实用。这一切可能是如何形成的,目前还不清楚,但我们必须努力放弃已经渗透到我们的临床研究策略中的高水平的经验主义。
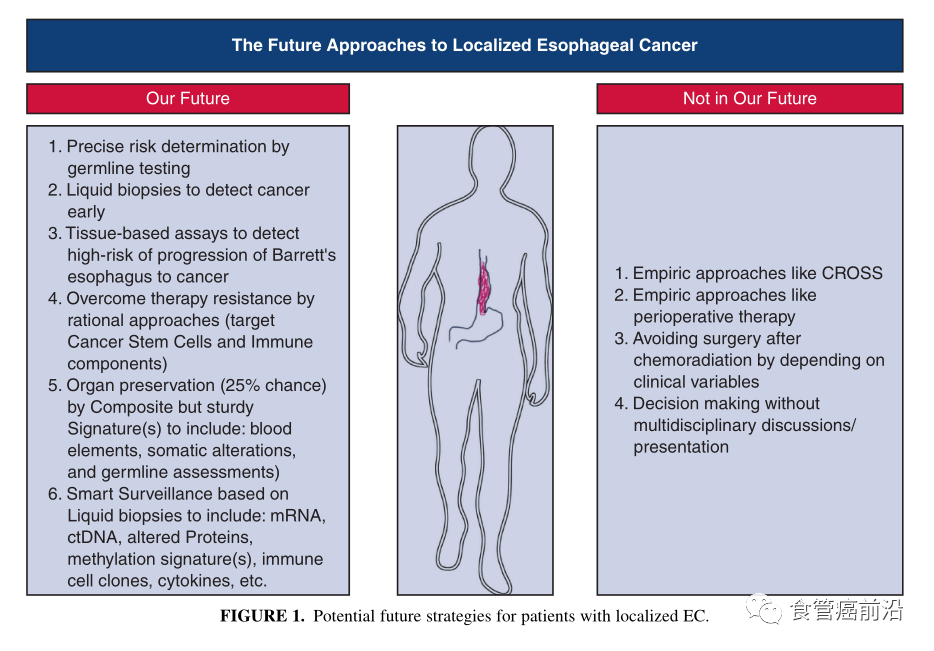
器官保留
其中一个主要的挑战是如何保护EC患者的食管?这种想法由两个问题推动:(1)EC手术正在改变生活质量;(2)有一小部分患者患有非常敏感的癌症,可以通过术前治疗根除。目前,放化疗策略比围手术期化疗策略更有利于器官保存。决定不进行手术是基于临床直觉或多学科专家的决定。据报道,基于临床变量的列线图可以预测病理完全反应,这意味着为什么对患者进行手术以发现手术标本中没有残留的癌症,但这种模型并不可靠,在临床上无法实现。一些生物标志物同放化疗耐药性/反应相关,但是,要建立一个可靠的模型,就需要更详细的数据和合作努力。
让我们共同改掉经验主义的习惯吧
大多数肿瘤学家接受的训练是将患者分组到特定的阶段或阶段范围(例如,EC,可能从II期到III期),然后同样地治疗所有这些患者,而不考虑肿瘤的基因组成或患者的种系数据。这种旧的方法对我们的服务并不好。整个经验性策略引发了许多大型试验,但没有基于各种因素对患者群体进行充分的分割。个体化治疗仍然是一个困难的挑战,因为我们的基础设施没有调整到快速测试。具有SRCs的EAC可以作为一个从或高代谢的EACs开始的模型。在SRC患者中,CROSS策略或围手术期策略的结果一直令人沮丧,但我们一直在持续使用这些治疗方法。这是由于缺乏想法/资源/动机,还是策略疲劳的一个组成部分?我们不确定是哪一个引领了我们的思想。然而,如果我们能在具有SRCs或高代谢EAC的EAC中产生更好的结果,那么其他表型的优势可能会跟随。
结论
食管癌的诊治进展非常缓慢。我们已经达成一致,要进行更准确的基线分期和多学科评估。这些都是受欢迎的进展。大容量的中心和大容量的外科医生帮助降低了死亡率/并发症。然而,与此同时,我们已经成为了经验主义的专家。现在是时候让我们所有人接受新的挑战,为局限期食管癌患者找到新的治疗策略,产生更好的结果,让当代的策略被尘封吧!
中国医学科学院肿瘤医院胸外科 秦建军 李印 翻译整理
原文链接:http://www.xxwk.net/archives/466