上海市医学会胸外科专科分会,上海市医师协会胸外科医师分会,普胸外科临床能力促进与提升专科联盟
同济大学附属上海市肺科医院 胸外科 (上海 200433)
通信作者:陈昶,Email:chenthoracic@163.com
关键词:肺结节;非小细胞肺癌;冰冻切片;专家共识
引用本文:上海市医学会胸外科专科分会,上海市医师协会胸外科医师分会,普胸外科临床能力促进与提升专科联盟. 基于术中快速冰冻切片指导外周型直径≤2 cm肺结节手术决策的胸外科专家共识. 中国胸心血管外科临床杂志, 2022, 29(6): 667-676. doi: 10.7507/1007-4848.202204098
摘要
手术切除是治疗早期非小细胞肺癌的唯一根治性方法,术中冰冻切片(frozen section,FS)诊断肺结节性质具有准确性高、适用性广、并发症少和实时诊断等优势,已成为指导肺结节手术策略的主要手段之一。为此,我们检索了 PubMed、Web of Science 以及中国知网、万方等数据库近30年的相关文献和研究资料,召开了3次会议,采用德尔菲法制定了本专家共识,共达成6条共识内容:(1)术中快速FS诊断良恶性疾病;(2)肺癌类型的诊断:腺癌、鳞癌、其它等;(3)肺腺癌浸润程度诊断;(4)浸润性腺癌的组织学亚型诊断;(5)术中FS和术后石蜡诊断肺腺癌浸润程度不一致的处理策略;(6)术中FS诊断肿瘤沿气腔播散、脏层胸膜侵犯和淋巴管浸润。最终,提出11条推荐意见,以期为术中FS诊断肺结节指导外周型非小细胞肺癌手术决策提供参考,进一步提高早期肺癌个体化精准诊疗水平。
正文
冰冻切片(frozen section,FS)作为术中快速评估肺结节良恶性及组织学类型的有效方法,已成为指导肺结节手术策略的主要手段之一[1]。相比术前CT和穿刺活检,术中快速FS对诊断肺结节性质具有准确性高、适用性广、并发症少和实时诊断等优势[1-2]。术中FS已广泛应用于指导乳腺癌、甲状腺癌、头颈部癌等多个癌种的手术决策[3-5]。肺部肿瘤病理分类及胸外科术式在近10余年内均有较大变化,但国内外尚未形成术中FS诊断肺结节及指导手术决策的专家共识。
随着胸外科对肺结节诊疗向着微创化和精准化发展,外科医生对术中FS诊断提出了更高的要求。根据早期肺癌外科术式的改变和术中FS诊断的精细化程度,肺结节术中FS的发展可划分为三个阶段。FS 1.0时代:1995年国际首个随机对照试验(LCSG821)[6]结果证实肺叶切除是早期恶性肿瘤的标准手术方式,因此胸外科医生对于术中快速FS诊断的需求仅为区分结节良恶性,从而避免所有病变无差别接受肺叶切除。2011年,国际肺癌研究协会(International Association for the Study of Lung Cancer,IASLC)/美国胸科学会(American Thoracic Society,ATS)/欧洲呼吸学会(European Respiratory Society,ERS)联合提出肺腺癌病理新分类[7],术中FS诊断迎来2.0时代。新分类将肺腺癌根据浸润程度分为浸润前病变、微浸润腺癌(minimally invasive adenocarcinoma,MIA)和浸润性腺癌,其中浸润前病变包括不典型腺瘤样增生(atypical adenomatous hyperplasia,AAH)和原位腺癌(adenocarcinoma in situ,AIS)。肺腺癌新分类可以进一步区分患者预后,大量研究[8-10]证实亚肺叶切除术治疗浸润前病变和MIA可取得接近100%的5年无复发生存率。因此FS 2.0时代聚焦于术中FS诊断肺腺癌浸润程度,在保证肿瘤根治性切除的同时开展损伤更小的亚肺叶切除。随着研究的逐步深入,多个研究[11-14]发现亚肺叶切除在部分早期浸润性腺癌可取得与肺叶切除相似的预后,亚肺叶切除的适宜群体也在不断扩充。日本JCOG0802/WJOG4607L研究[15]结果发现,肺段切除治疗外周型直径≤2 cm非小细胞肺癌的术后5年总生存率优于肺叶切除,但术后局部复发率显著高于肺叶切除(10.5% vs. 5.4%,P=0.0018)。既往研究[12, 16-20]发现病理高危亚型(微乳头、实性、复杂腺体)、脏层胸膜侵犯(visceral pleural invasion,VPI)、肿瘤沿气腔播散(spread through air space,STAS)和淋巴管浸润(lymphovascular invasion,LVI)等高危病理特征是亚肺叶切除术后复发危险因素。因此,FS 3.0时代即要求术中FS识别腺癌组织学亚型、VPI、STAS、LVI等亚肺叶切除病理高危因素,从而选择亚肺叶切除的相对安全群体。
因此,术中FS在肺结节快速诊断和实时手术决策中扮演重要角色,临床应用前景广阔,但国内外尚未形成术中FS诊断≤2 cm肺结节和指导其手术决策的专家共识。因此,国内多位胸外科及病理科专家基于已发表研究结果,通过充分会议讨论,形成国内首个术中快速FS诊断外周型、直径≤2 cm的单发肺结节并指导手术决策的专家共识。
1 方法与证据
我们检索PubMed、Web of Science以及中国知网、万方等数据库近30年的相关文献和研究资料,结合国际现行非小细胞肺癌诊疗及病理诊断相关指南。召开线上及线下执笔专家讨论会3次:上海市医学会胸外科专科分会专家讨论会 1 次,上海市医师协会胸外科医师分会专家讨论会1次,普胸外科临床能力促进与提升专科联盟讨论会1次。采用德尔菲法修订并最终定稿,达成6条共识,提出11条推荐意见。手术均采用国产胸腔镜完成。
本共识使用的推荐强度包括4级:Ⅰ级、ⅡA级、ⅡB级、Ⅲ级。Ⅰ级:基于严谨的系统评价/Meta分析、大型随机对照临床试验,证据充分,专家组一致同意;ⅡA级:基于质量一般的系统评价/Meta分析、小型随机对照研究、大型回顾性研究、病例对照研究,有较好的证据,专家组达成共识;ⅡB级:基于质量一般的系统评价/Meta分析、小型随机对照研究、大型回顾性研究、病例对照研究,专家组基本达成共识,争议小;Ⅲ级:基于非对照性临床研究、病例报告、专家观点,专家组提出相关建议,但存在一定分歧。
2 共识内容
2.1 共识一:术中快速冰冻诊断良恶性疾病
肺部肿瘤包含乳头状瘤、腺瘤在内的多种良性肿瘤以及腺癌、鳞癌、大细胞癌、涎腺型肿瘤、神经内分泌肿瘤等恶性肿瘤[21]。对病变的良恶性质给予定性诊断,始终是术中FS指导外科手术方式最重要的价值之一。早期肺恶性肿瘤的标准手术方式是肺叶切除术[6],而良性病变可接受亚肺叶切除,因此判断病变的良恶性质会直接决定胸外科医生的术式选择。
肺部病变的良恶性性质鉴别在肿瘤异型性较大时并不困难,但当肿瘤异型性较小时需注意与增生性、良性肿瘤相鉴别,避免将恶性肿瘤误诊为良性病变,如:非黏液性腺癌中的贴壁、腺泡、乳头状结构需与支气管化生、肺泡上皮反应性增生、AAH、肺泡性腺瘤、细支气管腺瘤、黏液腺腺瘤、乳头状腺瘤、硬化性肺细胞瘤等相鉴别;黏液腺癌需与黏液腺腺瘤、纤毛黏液结节性乳头状肿瘤相鉴别;胶样癌需与黏液性囊腺瘤相鉴别;分化较好的鳞癌需与鳞状上皮不典型增生、鳞状上皮乳头状瘤等相鉴别;腺鳞癌需与肺混合性鳞状细胞和腺性乳头状瘤、支气管涎腺乳头状瘤等相鉴别。反之,上述良性病变亦应在术中FS注意甄别,避免过度诊断为恶性肿瘤,造成不必要的扩大手术切除范围。此外,由于术中FS存在冷冻造成的组织细胞变形、取材局限,并不能完全代表病变全貌。部分病例形态本身诊断疑难,需要辅以术后石蜡或免疫组织化学方能明确诊断,病理医生需与胸外科医生术中及时沟通,可以用“符合”、“考虑”、“倾向”、“不除外”等诊断术语在术中FS诊断报告中给予一定诊断方向。此时,还应当告知胸外科医生,非明确性的术中FS诊断存在错误的可能,有待于术后石蜡或免疫组织化学进一步明确诊断。对于术中FS诊断不明确的病例,胸外科医生可综合FS诊断报告、病变影像学表现、患者意愿,决定手术方式。
推荐:(1)术中快速FS需对病变的良恶性进行诊断,对于良恶性质难以界定的病例,病理医生应尽可能给出一定的诊断方向。此时需要病理医生与胸外科医生充分沟通,综合术中FS诊断、影像学表现和患者个人情况或家属意愿,共同制定合适的手术方式(推荐级别:ⅡA级)。
(2)对于术中FS诊断为良性病变的患者,推荐选择亚肺叶切除,无需清扫淋巴结。病变位于肺外周三分之一,推荐楔形切除;位于单个肺段内,推荐肺段切除;若病变位于多个肺段之间或支气管根部,无法行亚肺叶切除时,则推荐肺叶切除。FS诊断为恶性肿瘤,则根据肿瘤类型、分期等因素,决定手术方式(推荐级别:ⅡA级) 。
2.2 共识二:肺癌类型的诊断:腺癌、鳞癌、其它等
2021版世界卫生组织(World Health Organization,WHO)胸部肿瘤分类将肺上皮性恶性肿瘤分为腺癌、鳞癌、大细胞癌、腺鳞癌、肉瘤样癌、肺部NUT癌、胸部SMARCA4缺失的未分化肿瘤、涎腺型肿瘤以及神经内分泌肿瘤等[22-23]。因肺腺癌不同浸润程度与预后和手术方式选择显著相关,因此术中FS诊断为腺癌时应进一步区分肺腺癌浸润程度。对于肺部腺癌外的其它恶性肿瘤,因肺叶切除仍是标准手术方式,术中FS诊断与手术方式选择无明显关联,且部分恶性肿瘤如非角化型鳞癌,术中FS无法从形态学上将其与实性腺癌、神经内分泌癌及其它低分化癌相鉴别,故在术中FS诊断中无需进一步区分。
此外,因肺部具有双重血供特点,是其它癌种转移的好发器官。研究[24-26]表明对于肺部转移性肿瘤手术方式的选择应该根据转移瘤的大小、数目、部位等决定,胸腔镜下亚肺叶切除仍然是主要术式,病理医生还需在术中FS对于转移性癌和原发肺癌进行鉴别诊断[27]。当患者具有明确恶性肿瘤病史或在其它脏器发现占位时,胸外科医生在术前或术中应明确告知病理医生,尽可能在术前向原单位借阅相关病理切片进行形态学对照。当患者缺乏其它部位癌种病史或无法提供原单位病理切片对照时,需根据病理形态学表现尽可能地对原发和转移进行甄别。部分肺部起源癌种和其它部位癌种存在一定形态学差异,尤其当肿瘤中包含有明确原位起源成分时(如贴壁型腺癌、原位鳞癌),可直接诊断为原发性肺癌。但部分肺癌和其它部位癌种形态学存在高度相似性(如肺肠型腺癌和转移性肠癌,筛状腺癌和乳腺癌,肺原发鳞癌、涎腺肿瘤和其它部位鳞癌、涎腺肿瘤,淋巴上皮癌和鼻咽部鳞癌等),当存在明确相应部位癌种病史,且无其它原发性肺癌证据时,通常在术中结合病史倾向诊断为转移癌,但应要求患者在术后提供原手术切片供术后明确诊断。当患者未提供相应癌种病史时可同临床医生进行充分沟通,传达肿瘤不除外为转移性可能的信息,提示临床对患者家属追问相关病史,或在术后对相应部位进行更为充分的检查,防止原发性肿瘤较为隐匿,导致漏诊。
推荐:(1)不同浸润程度肺腺癌具有预后差异,当肿瘤术中诊断为肺腺癌时,术中FS应尽可能明确诊断肺腺癌浸润程度,非腺癌则无需进一步明确区分病理类型。肺腺癌根据浸润程度和分期等决定手术方式,非腺癌则推荐行标准肺叶切除+系统性淋巴结清扫(推荐级别:ⅡA级)。
(2)转移癌同原发性肺癌术式选择存在显著差异,当患者具有明确恶性肿瘤病史或在其它脏器发现占位时,应在术中甄别原发或转移性癌,在有条件获得原肿瘤切片的情况下进行形态学对照。转移癌推荐行亚肺叶切除,病变位于肺外周三分之一,推荐楔形切除;位于单个肺段内,推荐肺段切除;若病变位于多个肺段之间或支气管根部,无法行亚肺叶切除时,则推荐肺叶切除,根据术中探查结果决定淋巴结采样或清扫(推荐级别:ⅡB级)。
2.3 共识三:肺腺癌浸润程度诊断
2011 年IASLC/ATS/ERS联合对肺腺癌进行重新分类,将肺腺癌分为浸润前病变(AAH和AIS)、MIA和浸润性腺癌[7]。2021版WHO分类将AAH与AIS重新定义为腺体前驱病变[21, 28],不再属于肺腺癌范畴,而MIA仍然在肺腺癌子目录下。大量回顾性研究[8, 29-32]证实术中FS诊断为AAH、AIS、MIA患者接受亚肺叶切除,可以保留更多的肺功能,且术后5年无复发生存率接近100%。因此,应在术中FS明确诊断肺腺癌浸润程度,从而避免所有患者无差别接受肺叶切除。
既往研究[1, 30, 33-34]发现,术中FS诊断肺腺癌浸润程度的准确率为84.4%~92.0%,因AAH/AIS/MIA预后极好,将其合并诊断时,FS诊断准确率可提高至96%。由于肿瘤细胞存在异质性,加之冰冻取材的局限性及制片流程的差异等问题,术中FS诊断早期肺腺癌浸润程度存在一定的困难。Su等[33]和Zhu等[34]均发现术中FS诊断直径>1 cm的肿瘤为AIS/MIA时,因冰冻取材受限,其术后病理易升级为浸润性腺癌。因此对于直径>1 cm的肿瘤,应谨慎诊断为AIS或MIA,病理医生可综合影像学表现、病灶的大体检查(质地、颜色等),评估浸润程度[35],必要时增加冰冻取材,避免术中低估诊断。术中FS对于MIA与浸润性腺癌的鉴别尤为重要,根据中华医学会病理学分会胸部疾病学组先前达成的诊断共识:如肿瘤呈贴壁生长为主,有明确间质浸润,浸润灶不能明确是否超过5 mm,或者病灶较大,无论是从CT影像学还是FS切片中都无法明确浸润灶是否超过5 mm的,可采用“至少MIA”,“浸润性腺癌不除外”等术语进行描述[35]。如遇镜下见多灶浸润,需将每个浸润灶占肿瘤总体积的百分比之和乘以肿瘤的最大径,计算肿瘤的浸润范围[36-37]。
推荐:(1)肺腺癌不同浸润程度对患者预后和术式指导有重要意义,应在术中FS诊断肺腺癌浸润程度。对于直径>1 cm的肿瘤应谨慎诊断为AIS或MIA,可综合影像学表现和标本大体检查,必要时增加取材数量,对于形态介于灰区的病例可给予倾向性诊断意见(推荐级别:ⅡA级)。
(2)对于术中FS明确诊断或倾向诊断为AAH、AIS、MIA的患者,推荐行亚肺叶切除,病变位于肺外周三分之一,推荐楔形切除;位于单个肺段内,推荐肺段切除;若病变位于多个肺段之间或支气管根部,无法行亚肺叶切除时,则推荐肺叶切除(推荐级别:ⅡA级)。
2.4 共识四:浸润性腺癌的组织学亚型诊断
2022年,JCOG0802/WJOG4607L研究[15]证实肺段切除相较肺叶切除治疗外周型直径≤2 cm的非小细胞肺癌,局部复发率显著高于肺叶切除(10.5% vs. 5.4%, P=0.0018 )。多个研究[38-41]均已证实腺癌组织学分类可显著区分患者预后和预测复发,其中贴壁为主型腺癌预后最佳,微乳头、实性为主型预后最差,因此术中FS诊断肺腺癌组织学亚型对选择亚肺叶切除相对安全群体至关重要。研究[10, 42-43]发现对于贴壁为主型的直径≤2 cm 的浸润性腺癌,亚肺叶切除治疗早期肺癌在保证淋巴结采样和切缘充足的情况下,其预后不差于肺叶切除。Nitadori等[16]发现微乳头亚型占比≥5%的浸润性腺癌,亚肺叶切除预后显著差于肺叶切除。国内Su等[44]同样证实微乳头亚型占比>5%时,肺段切除预后显著劣于肺叶切除[16, 44]。实性亚型同样被证实是亚肺叶切除治疗早期肺癌的不良预后因素[45]。2020年,IASLC在原有腺癌新分类基础上加入了复杂腺体概念,并将其与微乳头和实性亚型共同定义为高级别病理亚型[46-47],根据主要亚型和高级别亚型占比,提出腺癌新分级[48]。既往研究[49-50]均已表明复杂腺体、微乳头和实性亚型与早期肺腺癌不良预后、淋巴结转移等恶性病理学特征相关,尽管复杂腺体在亚肺叶切除中的预后价值尚未明确,术中FS诊断腺癌高级别病理亚型对于实时手术决策和预测患者预后仍具有重要意义。此外,充足的切缘距离对于亚肺叶切除至关重要,根据美国国立综合癌症网络指南定义,切缘距离应≥2 cm或≥肿瘤最大直径[51]。术中需要进一步镜下评估切缘有无肿瘤细胞,楔形切除通常取垂直肿瘤最近的肺切缘组织,肺段切除通常取支气管切缘组织,术中镜下评估切缘处有无肿瘤细胞。对于切缘阳性的亚肺叶切除患者,应更改手术方式为肺叶切除。
目前术中FS诊断肺腺癌亚型仍存在一定的挑战[52]。Yeh等[53]发现术中FS与术后石蜡诊断主要病理亚型的一致率为68%,三位病理科医生的观察者间一致性为64%;FS诊断实性为主型腺癌的敏感性和特异性分别为79%和94%, FS诊断微乳头为主型肺腺癌特异性高达99%,但敏感性仅为21%。当仅考虑有无微乳头亚型时,FS诊断敏感性仍仅为37%。Treji Bittar等[54]和Su等[44]同样发现FS诊断微乳头敏感性显著低于其它病理亚型,而腺泡和实性亚型诊断准确率较高,且冰冻取材和制片质量是术中FS与术后石蜡诊断不一致的主要原因。多个研究[55-58]发现丝状微乳头同经典微乳头具有相似的临床病理学特征和预后意义,将丝状微乳头加入微乳头定义,从而扩充了微乳头的病理形态图谱。Su等[44]发现术中FS通过识别丝状微乳头,可将微乳头的诊断敏感性由58.8%提高至74.2%,极大提高了微乳头的诊断敏感性。基于此,同济大学附属上海市肺科医院陈昶教授正在进行一项国内多中心Ⅲ期临床试验,通过术中FS筛选微乳头和实性亚型占比≤5%的浸润性腺癌,比较肺段切除术和肺叶切除术的远期预后(NCT 04937283),该研究将为术中FS诊断指导肺结节手术决策提供更高级别证据支持[59]。
推荐:(1)术中FS诊断腺癌时应尽可能明确是否存在高级别病理亚型(微乳头、实性、复杂腺体),FS诊断微乳头的敏感性较低,通过识别丝状微乳头可以提高微乳头的诊断敏感性(推荐级别:ⅡB级)。
(2)对于术中FS诊断不含有高级别病理亚型(微乳头、实性和复杂腺体总占比≤5%)的浸润性腺癌,在保证切缘足够的情况下,贴壁亚型为主的浸润性腺癌推荐行亚肺叶切除术+系统性淋巴结采样,腺泡或乳头为主型的浸润性腺癌,推荐行亚肺叶切除术+系统性淋巴结清扫/采样。病变位于肺外周三分之一,推荐楔形切除;位于单个肺段内,推荐肺段切除;若病变位于多个肺段之间或支气管根部,无法行亚肺叶切除时,则推荐肺叶切除。对于FS诊断高级别病理亚型占比 >5% 的浸润性腺癌,推荐行肺叶切除+系统性淋巴结清扫(推荐级别:ⅡA级)。
2.5 共识五:术中冰冻切片和术后石蜡诊断肺腺癌浸润程度不一致的处理策略
术中FS由于取材受限和制片等原因,存在术中FS与术后石蜡诊断肺腺癌浸润程度不一致的情况。对于术中浸润程度被高估的患者,其手术切除范围足以满足术后石蜡诊断,故此类错误术后无需处理。由于FS诊断的自身局限性,绝大部分错误诊断为低估肺腺癌浸润程度。肺腺癌浸润程度与患者预后和手术方式选择相关,既往研究报道术中FS诊断肺腺癌浸润程度的总体准确率为84.4%~92.0%。因AAH/AIS/MIA患者接受任何手术方式,其术后无复发生存率均接近100%,当AAH/AIS/MIA合并为一组诊断时,FS诊断准确率高达96%[1, 30, 33-34],而术中FS诊断为AAH/AIS/MIA患者通常接受亚肺叶切除。
既往研究[1, 30, 33]发现术中FS诊断为AAH/AIS/MIA接受亚肺叶切除后,术后石蜡病理升级为浸润性腺癌的比例为3.1%~6.3%,而术后升级为浸润性腺癌接受二次扩大范围切除的比例为7.9%(5/63),接受术后辅助治疗的比例为11.1%(7/63)[33]。术中FS诊断低估为AAH/AIS/MIA接受亚肺叶切除的患者,术后即使升级为浸润性腺癌,其预后仍较好,故术中FS低估诊断为AAH/AIS/MIA接受亚肺叶切除后,术后一般无需接受补充治疗[30]。
推荐:(1)对于术中FS诊断为AAH/AIS/MIA接受亚肺叶切除的患者,即使术后病理升级为浸润性腺癌,其预后较好,无需接受补充性扩大切除范围或辅助治疗(推荐级别:ⅡB级)。
2.6 共识六:术中冰冻切片诊断肿瘤沿气腔播散、脏层胸膜侵犯和淋巴管浸润
根据现有研究[17, 20, 60-61],除肺腺癌高级别病理亚型外,亚肺叶切除复发的病理高危因素还包括VPI、STAS、LVI,随着亚肺叶切除应用的增加,若能通过术中FS对上述病理高危复发因素进行明确诊断,对于选择相对安全的亚肺叶群体具有重要意义。VPI诊断标准为肿瘤细胞突破胸膜弹力纤维层,即便在术后石蜡诊断中,VPI的明确诊断仍依赖弹力纤维染色。然而弹力纤维染色作为特殊染色,耗时较长,因此弹力纤维染色难以在术中FS开展。既往文献[62]报道术中FS诊断VPI的准确性、敏感性和特异性为75%、47.4%和97.3%,在荧光显微镜下,通过弹力纤维自荧光效应,可将VPI术中FS诊断准确性、敏感性和特异性提升至95.6%、86.8%和100%。
对于术中FS诊断STAS,两项研究[63-64]均证实术中FS诊断STAS的敏感性仅为44%~54%,而特异性高达80%~91%,多因素逻辑回归分析发现人工伪影是FS错误诊断STAS的唯一相关因素,在FS诊断中需进一步甄别人工伪影和真正的STAS[63]。根据既往研究[65]报道,LVI的诊断同样需要辅助弹力纤维染色,目前尚未报道术中FS诊断LVI的相关研究,有研究[66]发现即便在不借助特殊染色,常规苏木精和伊红(H&E)染色发现的LVI,仍然与患者亚肺叶切除不良预后显著相关。因此当术中FS中见明确LVI时,应给予临床医生必要提示。
此外,术中FS诊断的时效性尤为重要,在考虑诊断准确性的同时不应忽略诊断的时效性。由于术中FS诊断VPI、STAS、LVI存在一定困难,当术中FS诊断明确出现其它高级别病理亚型时(微乳头、实性、复杂腺体),无需进一步诊断有无以上病理高危因素。而对于不含有高级别病理亚型的浸润性腺癌考虑行亚肺叶切除时,当临床具有相关需求时,对于具备诊断条件的单位应尽可能对VPI、STAS、LVI进行术中诊断。
推荐:(1)VPI、STAS、LVI是亚肺叶切除的预后不良因素,在条件允许的情况下可使用荧光显微镜帮助提高VPI术中诊断准确率,术中诊断STAS应同人工伪影相鉴别。术中FS诊断提示上述高危因素时,推荐行肺叶切除+系统性淋巴结清扫(推荐级别:ⅡB级)。
(2)当术中FS诊断明确出现其它高危病理亚型时(微乳头、实性、复杂腺体),无需进一步诊断有无VPI、STAS、LVI;而对于不含有高危病理亚型的浸润性腺癌考虑行亚肺叶切除时,有条件时应尽可能对VPI、STAS、LVI进行术中诊断(推荐级别:ⅡB级)。
3 总结与展望
术中FS诊断指导≤2 cm肺结节手术方式的总体思路见图1。随着科学技术的发展进步,微创化和精准化概念已深入到胸外科手术领域。术中FS可为胸外科医生提供丰富的实时诊断信息,辅助制定最佳手术决策,具有广阔的临床应用前景。术中FS经历了3个阶段的发展,虽然总体已经具有较高诊断准确性,但部分病理指标诊断准确率仍有待提高。基于术中FS指导≤2 cm肺结节手术方式的前瞻性、大样本临床研究将为术中FS临床价值提供更多和更高级别证据支持,对于早期肺癌精准化手术决策具有重要意义,将推动早期肺癌的个体化诊疗迈上新的台阶。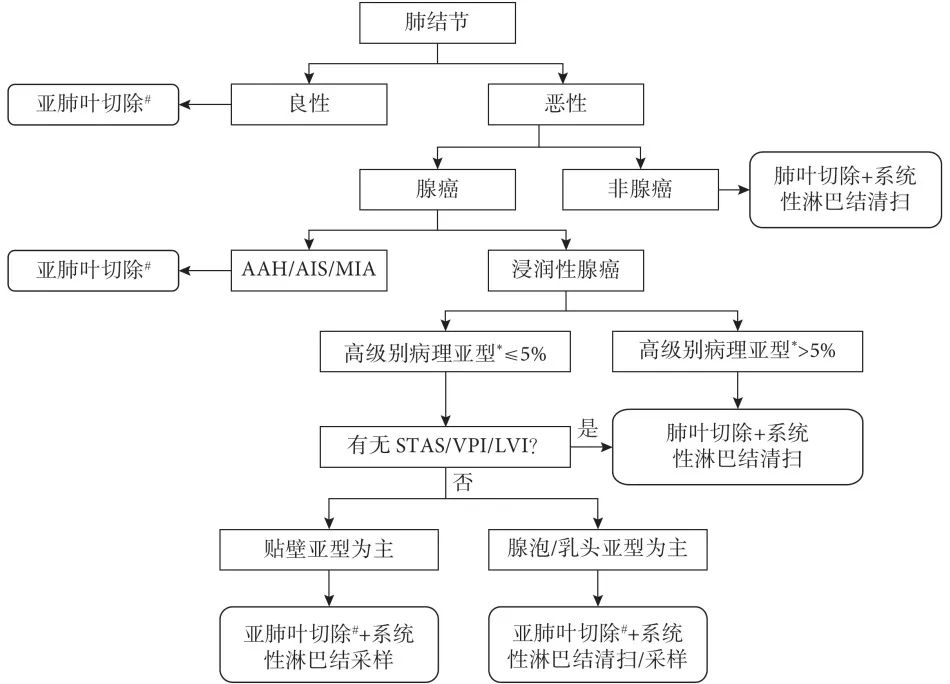
图1 术中冰冻切片指导肺小结节手术切除策略
AAH:不典型腺瘤样增生;AIS:原位腺癌;MIA:微浸润腺癌;VPI:脏层胸膜侵犯;STAS:肿瘤沿气腔播散;LVI:淋巴管浸润;*:高级别病理亚型包括微乳头、实性和复杂腺体;#:亚肺叶切除根据结节所在位置决定具体术式,结节位于肺外周三分之一,推荐楔形切除;位于单个肺段内,推荐肺段切除;位于多个肺段之间或支气管根部,推荐肺叶切除
利益冲突:无。
参考文献略。
特邀顾问:高文(华东医院)、费苛(华东疗养院)、姜格宁(同济大学附属上海市肺科医院)、徐志飞(海军军医大学第二附属医院)、赵珩(上海市胸科医院)
执笔:徐龙(同济大学附属上海市肺科医院)、苏杭(同济大学附属上海市肺科医院)、谢惠康(同济大学附属上海市肺科医院)、谢晓枫(同济大学附属上海市肺科医院)、赵胜男(同济大学附属上海市肺科医院)
讨论和审稿专家(按姓名拼音排序):陈昶(同济大学附属上海市肺科医院)、陈椿(福建医科大学附属协和医院)、陈和忠(海军军医大学第一附属医院)、陈建乐(南通大学附属医院)、陈乾坤(同济大学附属上海市肺科医院)、陈晓峰(复旦大学附属华山医院)、池浩(上海中医药大学附属曙光医院)、董新伟(南阳市中心医院)、董正伟(同济大学附属上海市肺科医院)、董志毅(同济大学附属上海市肺科医院)、段亮(同济大学附属上海市肺科医院)、范江(上海市第一人民医院)、范军强(浙江大学医学院附属第二医院)、方文涛(上海市胸科医院)、高树庚(中国医学科学院肿瘤医院)、葛棣(复旦大学附属中山医院)、顾晔(同济大学附属上海市肺科医院)、郭剑波(临海市第一人民医院)、郭俊红(同济大学附属上海市肺科医院)、韩彪(兰州大学第一附属医院)、何文新(同济大学附属上海市肺科医院)、侯立坤(同济大学附属上海市肺科医院)、胡坚(浙江大学医学院附属第一医院)、胡余敏(临海市第一人民医院)、黄焰(同济大学附属上海市肺科医院)、蒋东(苏州大学附属第一医院)、金锋(山东省公共卫生临床中心)、李鹤成(上海交通大学医学院附属瑞金医院)、李辉(首都医科大学附属北京朝阳医院)、李钦传(上海市东方医院)、励新健(宁波市第一医院)、邵丰(南京市胸科医院)、沈琦斌(湖州市中心医院)、沈晓咏(华东医院)、孙健(盐城市第一人民医院)、谭黎杰(复旦大学附属中山医院)、唐华(海军军医大学第二附属医院)、田辉(山东大学齐鲁医院)、王海峰(同济大学附属上海市肺科医院)、王明松(上海交通大学医学院附属第九人民医院)、武春燕(同济大学附属上海市肺科医院)、谢冬(同济大学附属上海市肺科医院)、解明然(中国科学技术大学附属第一医院)、徐宁(安徽省胸科医院)、杨明磊(中国科学院大学宁波华美医院)、张昊(徐州医科大学附属医院)、张雷(同济大学附属上海市肺科医院)、张莉萍(同济大学附属上海市肺科医院)、张鹏(同济大学附属上海市肺科医院)、张雪冬(南通市第六人民医院)、赵德平(同济大学附属上海市肺科医院)、赵国芳(中国科学院大学宁波华美医院)、赵晓菁(上海交通大学医学院附属仁济医院)、郑大为(宁波市医疗中心李惠利医院)、周晓(同济大学附属上海市肺科医院)、周逸鸣(同济大学附属上海市肺科医院)、周永新(上海市同济医院)、朱余明(同济大学附属上海市肺科医院)、祝子逸(浙江大学医学院附属邵逸夫医院)
作者介绍

陈昶:教授、博士生导师、主任医师。享国务院特殊津贴、入选国家百千万人才工程、上海领军人才、上海市优秀学科带头人。
现任职务及专业学术任职 行政职务:上海市肺科医院党委书记、上海肺移植工程技术研究中心主任、同济大学胸外科临床研究中心主任
学术任职 ●中华医学会胸心血管外科分会青年医师委员会副主任委员(第九届) ●上海医学会胸外科分会副主任委员 ●上海市医师协会胸外科医师分会副会长 ●中国医促会胸部肿瘤分会副主任委员 ●上海市医学会器官移植分会委员 ●上海医药行业协会规范化诊治专业委员会委员 ●海峡两岸医学交流会胸外科分会副主任委员 ●美国胸心外科学会国际会员(AATS Membership) ●国际肺癌研究协会会员 (IALSC Membership) ●美国胸外科医师协会会员 (STS Membership) ●美国外科学会会员(ACS Membership) ●英国皇家外科医学院会员(RCS Membership)
科研项目及成果 主持国家自然科学基金重大培育、上海市科委等课题10余项。近5年以通讯作者发表 SCI 论文 132 篇,单篇最高 44 分,包括J Clin Oncol, MOL Cancer, J Thorac Oncol, JAMA SURGERY等著名国际期刊。获专利22项,软件著作权2项。科研成果荣获省部级奖励8项,包括教育部科技进步奖二等奖、上海市科技进步一等奖等。编写胸部肿瘤外科专著7部,包括英文论著2部,参与制定专家共识4项,共同创办英文期刊Current Challenges in Thoracic Surgery。
来源:中国胸心血管外科临床杂志
原文链接:http://www.xxwk.net/archives/2339