Topalian et al., Science 367, eaax0182 (2020) 31 January 2020
免疫检查点抑制剂治疗通常被认为可以在肿瘤微环境中缓解肿瘤细胞介导的免疫逃逸,因此TME中CD8+TiLs的浸润和功能状态被广泛研究以期更好的解释CPI应答或不应答的潜在机制,同时抑制性检查点PD-L1也在非肿瘤巨噬细胞和常规树突状细胞(cDCs)上表达。在一项发表于Cancer Cell(IF 26)的小鼠肿瘤模型中发现,肿瘤引流淋巴结(TDLNs)富含肿瘤特异性PD-1+T细胞,并且其与与PD-L1+ cDCs的Crosstalk对有效的肿瘤免疫应答起到关键作用。对非转移性黑素瘤患者队列进行分析发现TDLNs中大量的PD-1/pd-l1相互作用与早期远处疾病复发有关,这种相关性与肿瘤区域的PD-1/pd-l1相互作用则无关。通过靶向TDLN的耗竭T细胞,增强抗肿瘤T细胞免疫,从而改善肿瘤控制。这些发现指出了TDLNs中PD-L1的表达在控制全身抗肿瘤免疫方面的关键作用,可能可以帮助识别能够从免疫检查点抑制剂治疗中获益的复发风险高危人群。
Dammeijer et al., The PD-1/PD-L1-Checkpoint Restrains T cell Immunity in Tumor-Draining Lymph Nodes, Cancer Cell (2020)
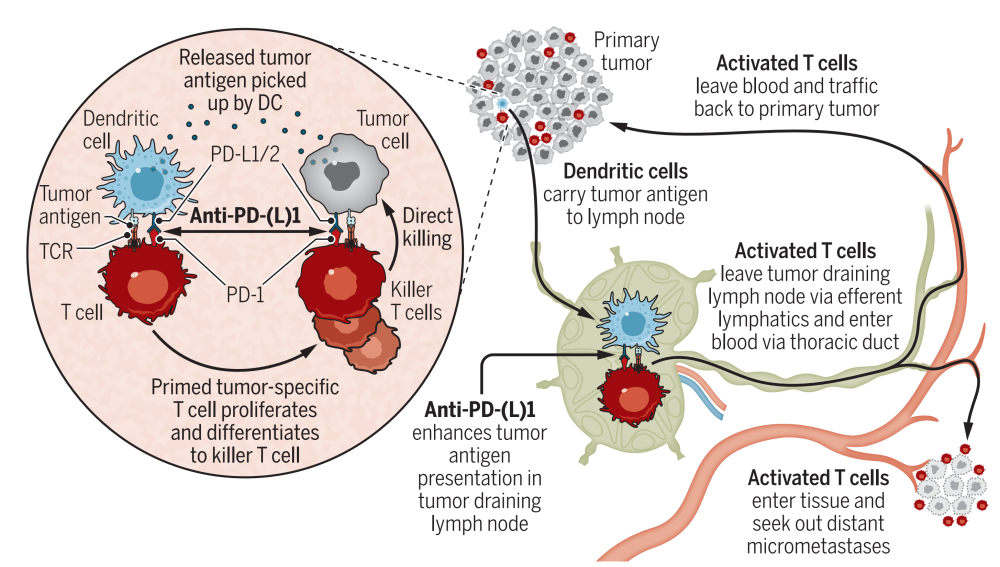
肿瘤引流淋巴结在肿瘤免疫中扮演“作战指挥部”的角色显然并不是这一项研究首次提出的。既往研究已经阐述了肿瘤抗原被DC细胞带回到TDLN中,被呈递给淋巴结中的T细胞,以此开始一系列的系统免疫应答级联反应。验证方法包括包括肿瘤荧光标记,基因改造肿瘤细胞以表达可被同源T细胞TCR识别的抗原肽,利用流式细胞术和单细胞rna测序分析肿瘤和TDLN中的DC亚群,以及DC-KO小鼠等。DCs携带肿瘤抗原“迁徙”回TDLNs也已经被研究证实,同时证实肿瘤浸润T细胞的扩增活化是继发于TDLN中的活化T细胞(reinvigorate) 派遣到肿瘤区域,同时,肿瘤区域的原住民residualT细胞仅有一小部分具有识别肿瘤抗原肽的能力,多数都是吃瓜群众(bystander)。相较于越来越豪华的数万数量级单细胞测序,空间转录组,质谱流式甚至CRISPR等等“金包肉”的转化研究,Cancer Cell的这篇所用的方法可以算是比较经济适用型了,既然讲述的是一个老故事,为什么能发cancer cell?或可能得益于他比较严谨的论证逻辑。
H. Salmon et al., Expansion and activation of CD103(+) dendritic cell progenitors at the tumor site enhances tumor responses to therapeutic PD-L1 and BRAF inhibition. Immunity 44, 924–938 (2016). doi: 10.1016/j.immuni.2016.03.012; pmid: 27096321 41. J. Liu et al., Batf3+ DCs and type I IFN are critical for the efficacy of neoadjuvant cancer immunotherapy. OncoImmunology 8, e1546068 (2018). doi: 10.1080/ 2162402X.2018.1546068; pmid: 30713806
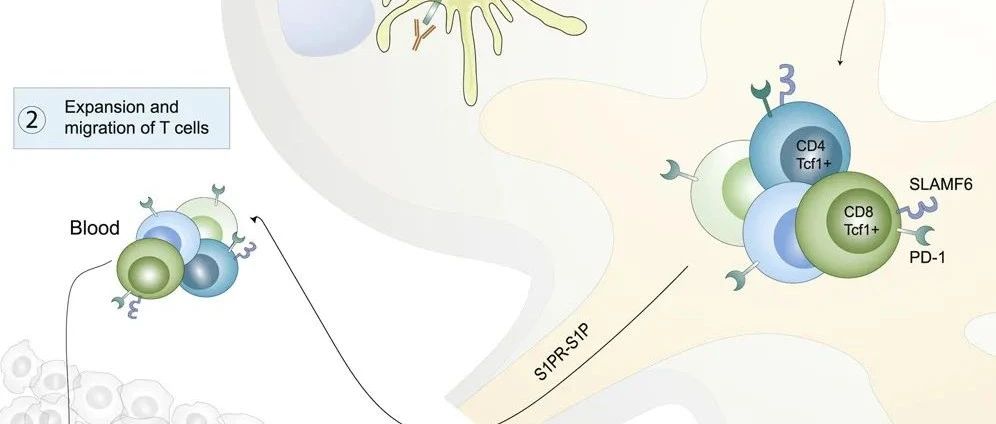
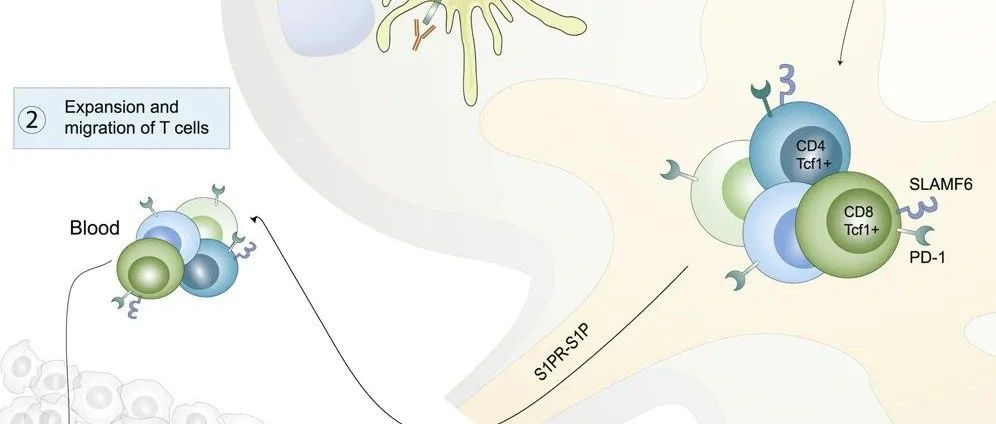
step1 :肿瘤引流淋巴结富集了大量的PD-1+肿瘤特异性T细胞。
Proliferation (Ki-67) and PD-1-positivity were determined on ovalbumin (OVA) (257–264)-tetramer+ CD8+ T cells in non-TDLNs, TDLNs, and tumor. Furthermore, PD-1-expression (MFI) was assessed on (PD-1+) OVA(257–264)-tetramer+ CD8+ T cells.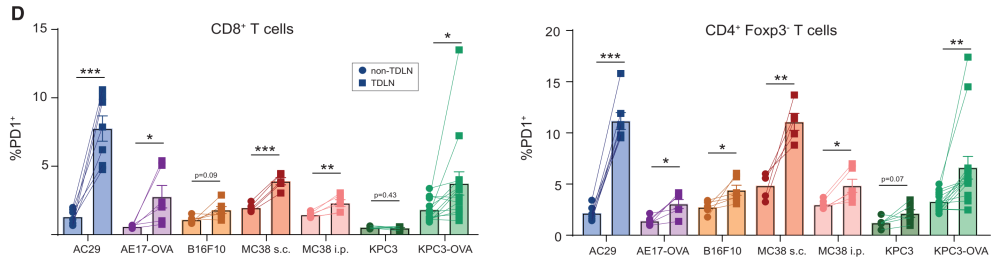
Comparison of frequencies of PD-1+ CD8+ (left) and CD4+ Foxp3-T helper (Th) cells (right) between TDLNs (circles) and non-TDLNs (squares) in different solid tumor models (different colors) transfected with/without OVA, or injected orthotopically (i.p.) or subcutaneously (s.c.) in CBA/J (AC29) or C57BL/6 mice (n = 6–7 mice/group, n = 14 in case of KPC3-OVA).
step 2:肿瘤引流淋巴结含有大量高表达PD-L1的髓系细胞包括迁徙性DCs
根据CD11c和MHC-II的表达差异,DCs可细分为迁移亚群和驻地亚群,基于这个差异,该研究在TDLNS中发现大量具有迁徙特性的DC细胞。并且高表达PD-L1,接近肿瘤内的表达水平。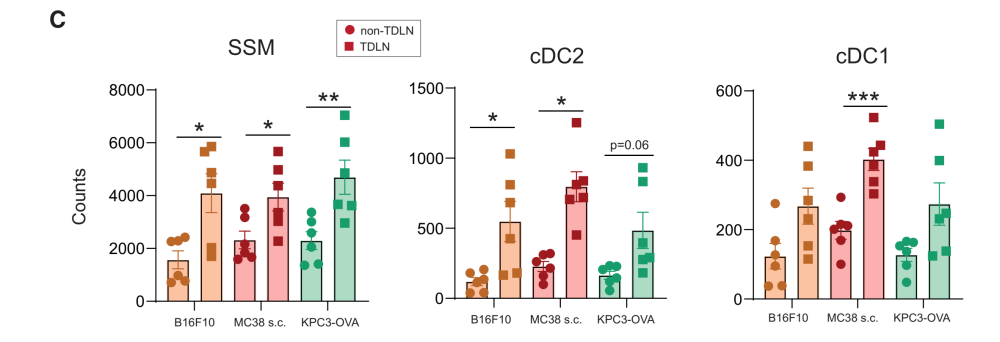
step3:在小鼠模型中进行低剂量胸膜内PD-L1抗体 anti-rat IgG2a antibody的注射,能够选择性靶向TDLNs
通过胸膜内路径给予ICB抗体,这个位置直接流向纵隔LNs,纵隔LNs是腹腔内肿瘤的TDLNs,过量的抗体通过胸导管继续进入血液。有意思的是,在无瘤小鼠中,通过胸膜腔途径注射的抗体似乎比通过静脉更容易被TDLN背膜下的包括巨噬细胞和树突细胞在内的细胞亚群结合,但是在荷瘤小鼠中,两种途径效能相似。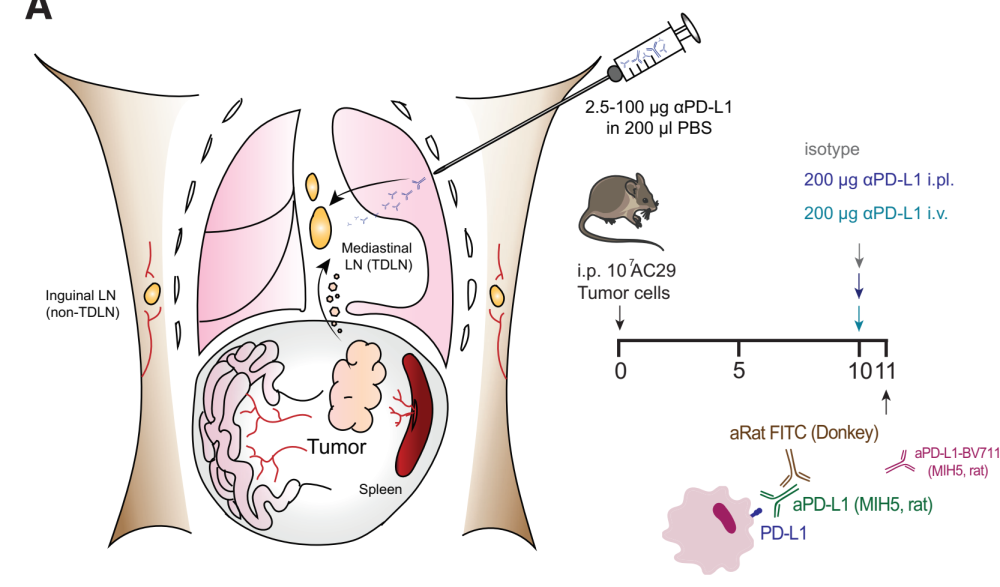
step 4 and 5 :这种靶向作用能够引发可观的抗肿瘤免疫效应和有效控制肿瘤
系统靶向PD-L1和局部靶向TDLN可降低肿瘤负荷并提高生存率(图5B和S5B)。考虑到低剂量时并不是所有的PD-L1分子在TDLN中都被阻断,这些治疗效果相当强(图S4B)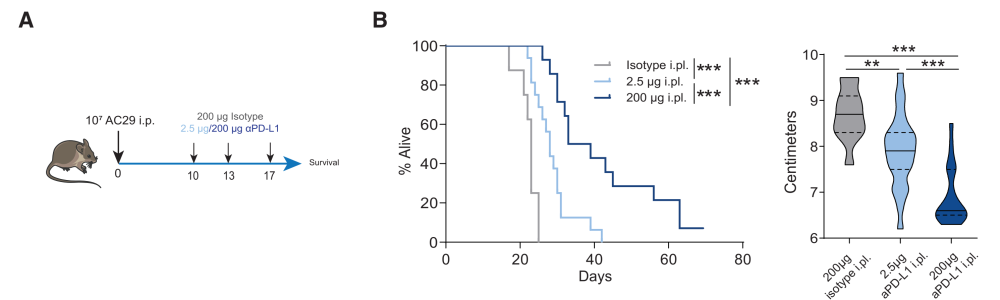
用FTY720阻断淋巴细胞从淋巴结外流则可以阻断这种抗肿瘤效应。在肿瘤中,FTY720抑制了抗pd - l1的治疗效果,阻止了CD4+Th-和CD8+ TILs内流,但保留了表现出PD-1表达增加的T细胞
step 6:通过精细的体外T细胞刺激试验,用TME中的抗原肽阻断或不阻断PD-L1的情况下刺激CD8+TILS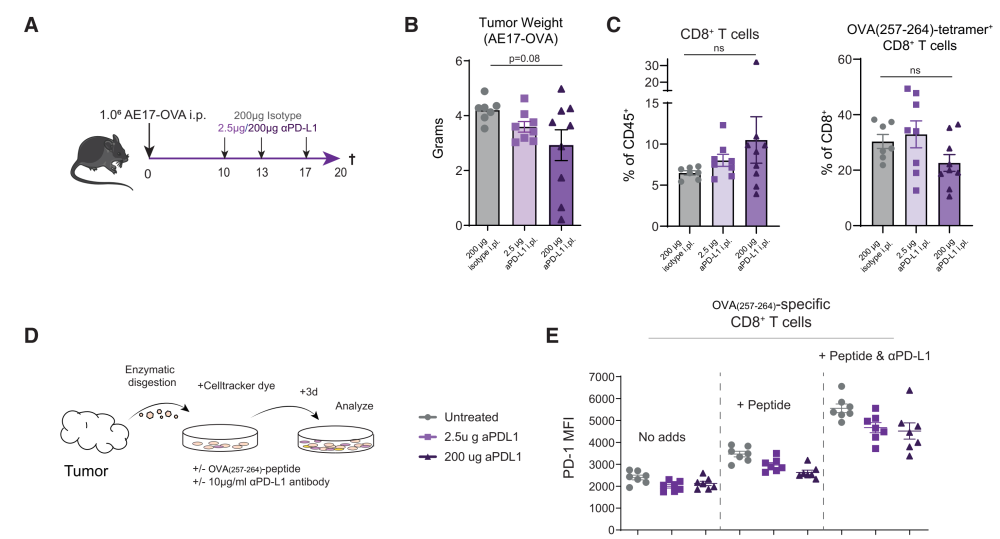
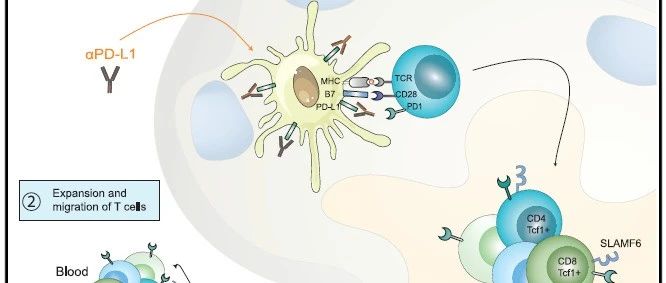
step 7:证实阻断PD-L1介导的肿瘤特异性T细胞的活化(re-invigoration)主要依赖于表达PD-L1的cDC2,而非巨噬细胞。
使用多色共聚焦显微镜观察抗pd - l1表达的cDC2s与CD8+ T细胞的共定位。在TDLNs中,CD8+T细胞没有与SSMs和MSMs共位点,但经常发现PD-L1阳性的DC和CD8+T细胞成簇聚集(免疫突触相互作用)。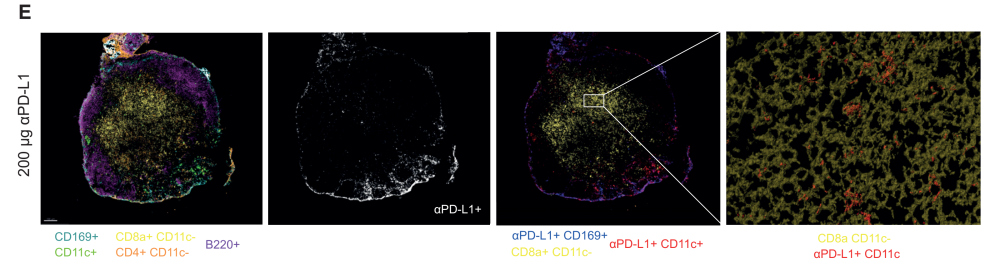
无巧不成书,2020年有两项颇具影响的研究证实DCs上表达的PD-L1 与B7.1的相互作用,参与调节T细胞介导的免疫应答。
2020年3月一项发表在《Science Translational Medicine》上的研究提示,DC细胞上表达的PD-L1与B7.1/CD80的in cis结合与T细胞上的CD28-DC B7.1的结合形成相互竞争(免疫检查点的占座游戏,Checkpoint musical chairs),并且由于DCs上的PD-L1表达量要远高于B7.1,导致后者被这种 IN CIS interaction”劫持羁留“。阻断PD-L1后,将B7.1释放出来,启动其与CD28的结合,或可增强T细胞的活化(priming)。该研究尚未回答的一个问题是,T细胞上表达的CTLA4与CD80(B7.1)/CD86的亲和力要远高于CD28,如何保障释放的B7.1更多的与CD28结合,而不是再次被CTLA-4劫持。It's a classical romantic film, imagine you and me (四角关系)among B7.1,PD-L1,CD28,CTLA-4, competition and oconspiracy. Maud Mayoux, et al. Dendritic cells dictate responses to PD-L1 blockade cancer immunotherapy. Science Translational Medicine. 2020.
无独有偶,2020年6月来自Genentech Ira Mellman团队的一项发表在《Nature Cancer》上的研究提示,DCs表达的PD-L1,与B7.1发生in cis相互作用,用B7.1抗体阻断这一相互作用(释放PD-L1),导致与PD-1的相互作用加强,肿瘤增殖增强,而抑制PD-L1则可逆转这一过程。
研究同时还发现,尽管巨噬细胞是表达PD-L1的主要细胞,但DC上的PD-L1表达对T细胞介导的肿瘤免疫起关键作用。研究没有回答的一个问题是,接受免疫检查点抑制剂治疗后,DC介导调控T细胞的活化过程是发生在肿瘤内,还是发生在引流淋巴结或瘤旁的第三级淋巴器官(最近的研究提示那是DC细胞动员活化T细胞的主要场所)。另外此项研究也并没有否认免疫检查点抑制剂治疗直接作用与T细胞,介导其再活化,而是强调,该过程由表达PD-L1的DC充分参与。Oh, S.A., Wu, D., Cheung, J. et al. PD-L1 expression by dendritic cells is a key regulator of T-cell immunity in cancer. Nat Cancer (2020).
时至今日,这个悬而未决的问题似乎在今天分享的这篇研究中得到了证实,至此,这部由 肿瘤引流淋巴结,肿瘤特异性T细胞,具有迁徙特性的DC细胞参与的T细胞动员活化迁徙至肿瘤区域进行肿瘤攻击的大戏具有了相对清晰的轮廓。
step 8:对黑色素瘤队列的回顾性分析证实,TDLN中的PD-1/PD-L1的相互作用而非肿瘤,与黑色素瘤病人的预后更相关。
该研究数据证实确立了TDLNs在抗pd - l1 ICBs(通常认为主要作用于TME的检查点)后产生原发性抗肿瘤免疫应答中的作用(Ribas和Wolchok, 2018)。这些数据可以解释肿瘤PD-L1阴性的部分患者仍可能对抗pd -1阻断发生应答反应。尽管多种机制可能决定对ICB治疗的反应,但通过阻断PD-1/PD-L1的相互作用减轻TDLN的免疫抑制可以促进全身抗肿瘤T细胞免疫,从而有效控制远处的肿瘤。该研究数据揭示了PD-L1阳性cDCs在TDLN中的关键作用,但没有否定这种抑制配体参与TME的DC功能调控。
原文链接:http://www.xxwk.net/archives/3074