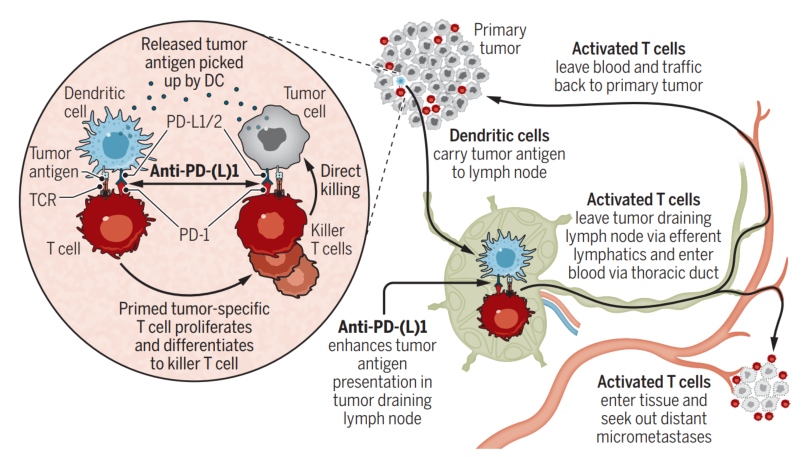
研究背景 ❀
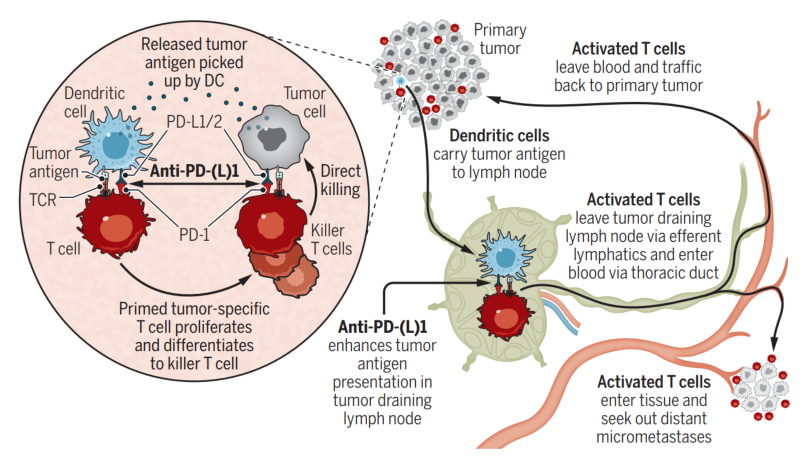
- 尽管传统放疗 (RT) 仅被认为是一种局部治疗,但它偶尔会导致放射野之外的肿瘤控制,称为远隔效应。远隔效应是通过刺激抗肿瘤免疫反应产生的,尤其是 CD8 + T 细胞。因此,RT 可以被认为是一种免疫疗法或原位疫苗接种,从而产生全身效应。它增加肿瘤细胞上主要组织相容性复合物 (MHC)-I 的表达和 PD-L1,同时通过环状 GMP-AMP 合酶 (cGAS) 和干扰素基因刺激物 (STING) 通路促进 I 型干扰素 (IFN) 信号传导在抗原呈递细胞中。虽然肿瘤能够启动和激活 T 细胞,但淋巴结 (LN) 是产生免疫反应的经典部位。肿瘤引流LN具有丰富的肿瘤引流,是肿瘤抗原负荷高的部位。它们也是树突状细胞介导的抗肿瘤 T 细胞刺激的重要位点,这是用 αPD-L1 激活 T 细胞的关键步骤,还评估了手术或肿瘤引流 LN 定向放疗对淋巴结破坏对肿瘤照射后局部肿瘤生长的影响。Takeshima 等人证明,LN (Aly/Aly) 基因缺陷小鼠或手术消融 LN 的小鼠局部肿瘤控制降低。最近,研究表明,对引流肿瘤的 LN 进行立体定向照射会导致局部控制降低和肿瘤免疫浸润减少。这些数据和观察结果表明,引流肿瘤的 LN 也可能在远隔反应中起重要作用。基于这些初步观察,我们研究了破坏肿瘤引流 LN 对远隔效应的影响。
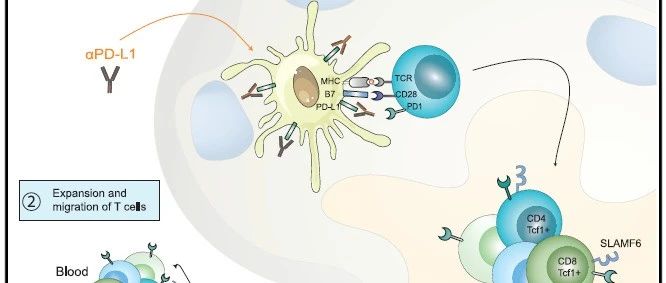
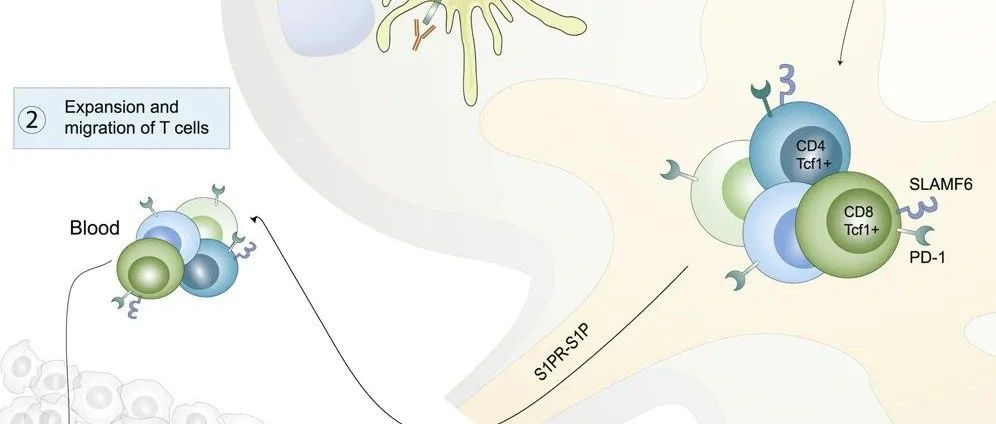
- 此外,进行了对T 细胞耗竭进行了详细研究,PD-1/PD-L1相互作用的中断被证明可以使CD8 + T细胞恢复活力。已经表明,用 αPD-L1 治疗耗尽的 CD8 + PD-1 + T 细胞后,增殖爆发是由不同的 T 细胞亚群提供的。这种 T 细胞亚群具有独特的干细胞样表型。αPD-L1 疗法刺激该亚群的自我更新和增殖,然后分化为能够杀死细胞的终末分化效应物。在远隔效应的背景下,了解放疗对干细胞样 CD8 + T 细胞和终末分化效应的影响可能有助于增强αPD-1/L1的抗肿瘤免疫应答和提高应答率。
❀ 技术路线 ❀
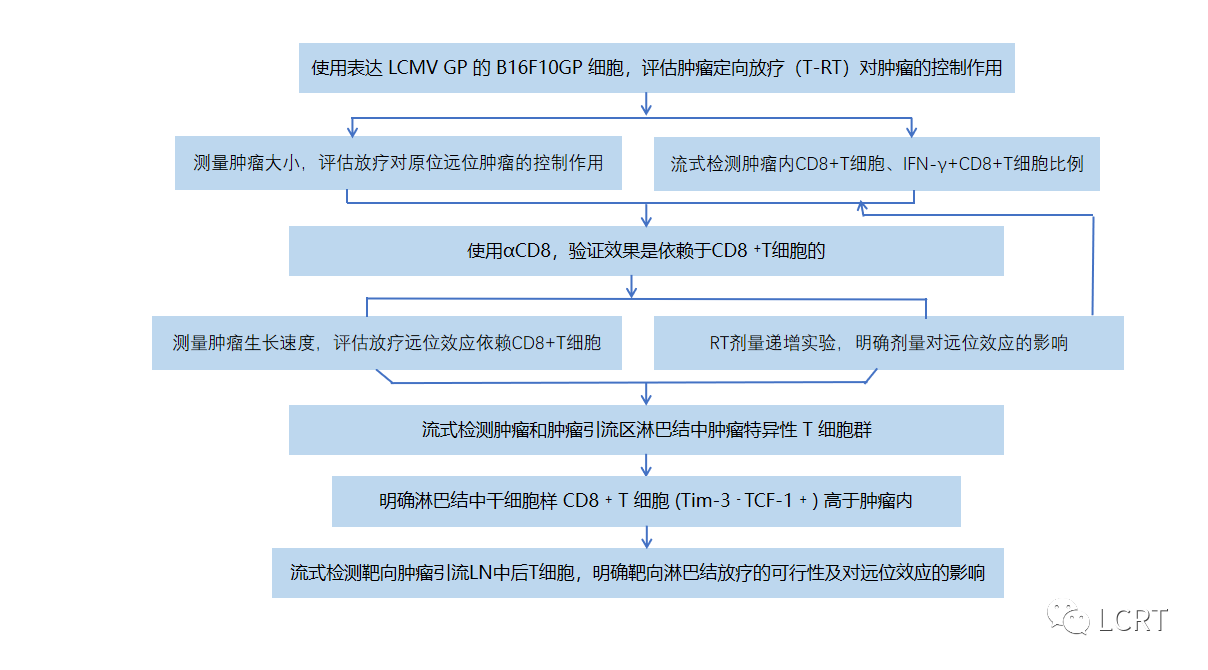
❀ 研究结果❀
肿瘤定向放疗诱导远隔效应
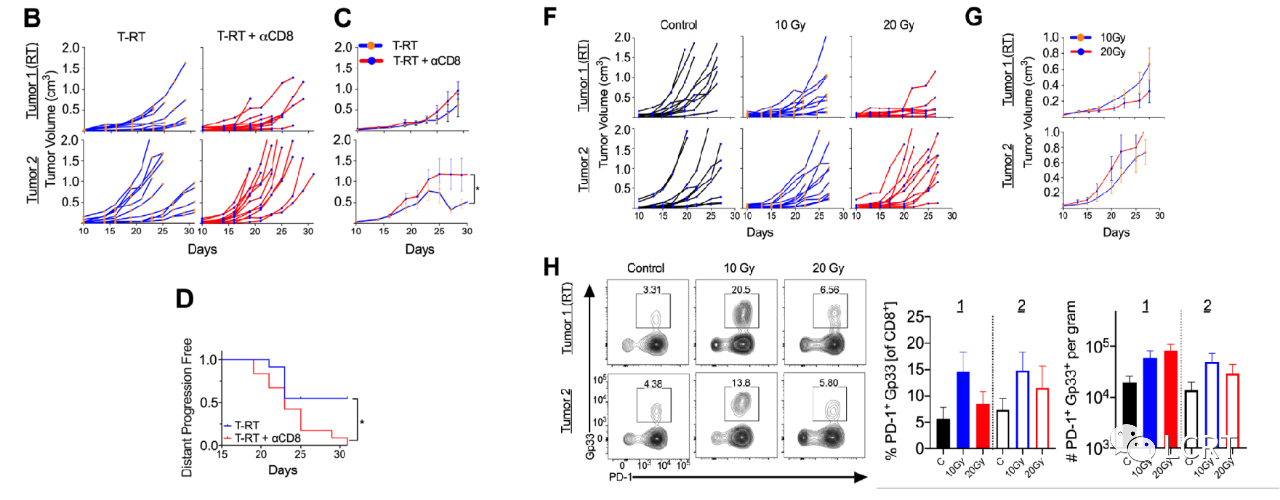
- 为了评估单独的肿瘤定向放疗 (T-RT) 是否可以改善远处肿瘤控制,我们将同源 B16F10GP 肿瘤细胞植入免疫活性小鼠的双侧侧翼。使用表达 LCMV GP 的 B16F10GP 细胞系使我们能够识别和追踪各种器官中具有 MHC-I 四聚体的肿瘤特异性 T 细胞。在接受 T-RT 治疗的小鼠中,肿瘤接受 10 Gy x 1F 的 放疗并用0.5cm圆物块以保适当的表面剂量(图1A)。
- 在T-RT之后,我们观察到受照部位(肿瘤1)(图1B,C上)肿瘤生长放缓,未受照部位(肿瘤2)(图1B,C下)出现可重复的外视效应。为了描述和量化创伤中的T细胞反应,我们评估了肿瘤特异性(Gp33 +) CD8 + T细胞。在未辐照的肿瘤(肿瘤2)中,每克肿瘤特异性CD8 + T细胞数量增加,而在辐照的肿瘤(肿瘤1)中有增加的趋势(图1D)。在肿瘤1中也观察到肿瘤特异性CD8 + T细胞的增殖增加(图1D,右)。在T- RT后,IFN-γ + CD8 + T细胞在肿瘤1和肿瘤2出现的频率均增加,且肿瘤1数量增加,肿瘤2有IFN-γ + CD8 + T细胞出现的趋势(图1E,左,中)。在肿瘤2中,多功能CD8 + T细胞的频率也增加了(图1E,右),这代表了一个较少耗竭的T细胞亚群。

在体外肽再刺激 5 小时后
- 为了证实观察到的效果是依赖于CD8 +T细胞的,我们在肿瘤照射前清除了CD8 +T细胞,并检测了清楚效果(图A,E)。
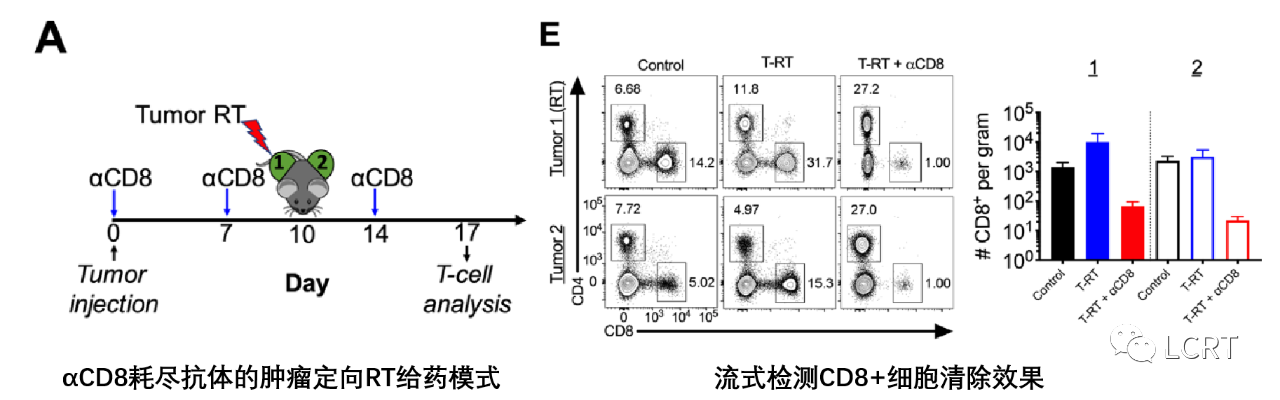
- 这显著降低了远位效应。为了确定这种远位反应是否依赖于强抗原(Gp33),我们对B16F10亲本进行了相同的实验,并观察了肿瘤照射改善的局部控制。然后,我们进行了从0、10 和 20 Gy的剂量递增实验,以评估增加剂量是否会增加B16F10GP肿瘤的远位效应的大小。我们发现10和20Gy都有相似的局部控制和远位控制。我们还发现,在10 Gy和20 Gy组中,每克肿瘤特异性CD8 + T细胞有增加的类似趋势,而在10 Gy组中,T细胞频率有增加的趋势。
在肿瘤和肿瘤引流LN中发现干性CD8 + T细胞
- 更详细地表征肿瘤和肿瘤引流 LN 中的肿瘤特异性 T 细胞群。我们发现肿瘤中大多数(> 85%)的 Gp33 + T 细胞是终末分化的效应子(图3A)。鉴于干细胞样 CD8 + T 细胞 (Tim-3 - TCF-1 + ) 在响应 αPD-L1 中的重要性, 我们接下来评估了肿瘤中的干细胞样 CD8 + T 细胞群。在对肿瘤特异性 CD8 + T 细胞进行门控后,我们发现肿瘤中具有干细胞样表型的 CD8 + T 细胞虽然频率较低,因此,我们接下来评估了引流肿瘤的 LN。在 LN 中,我们发现了具有中等 PD-1 表达水平的肿瘤特异性 CD8 + T 细胞(图3A,左下角)。在对肿瘤特异性 CD8 + T 细胞进行门控后,我们发现这些细胞中有 >75% 具有干细胞样表型(图3A,底部中间)。我们证实,肿瘤和 LN 中终末分化的效应细胞中的 GzmB 表达远高于干细胞样 CD8 + T 细胞,如之前所示(图3A,右)。最后,我们量化了 LN 和肿瘤中干细胞样 CD8 + T 细胞与终末分化效应细胞之间的频率差异(图3B)。这些数据清楚地表明,LN 中干细胞样 CD8 + T 细胞的频率明显高于肿瘤。在亲本 B16F10 细胞系中观察到肿瘤和 LN 之间干细胞样 T 细胞频率的类似差异。
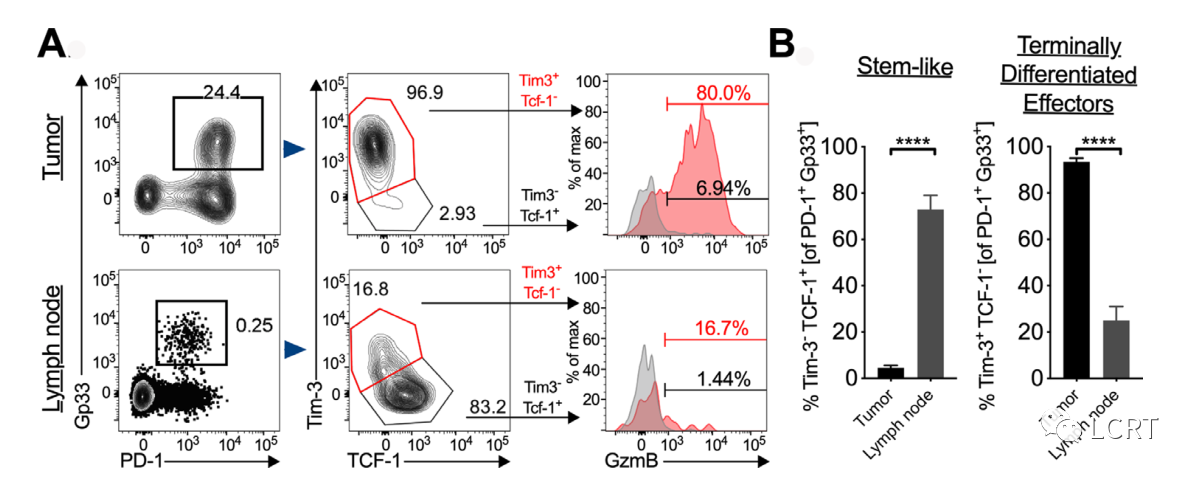
肿瘤RT对肿瘤和淋巴结中T细胞亚群的影响
- 我们评估肿瘤照射对肿瘤和肿瘤引流 淋巴结中 T 细胞亚群的影响。我们发现 T-RT 增加了干细胞样 CD8 + T 细胞的数量,但没有增加它们在肿瘤 1 中的比例,肿瘤 2 和效应细胞的趋势相似。
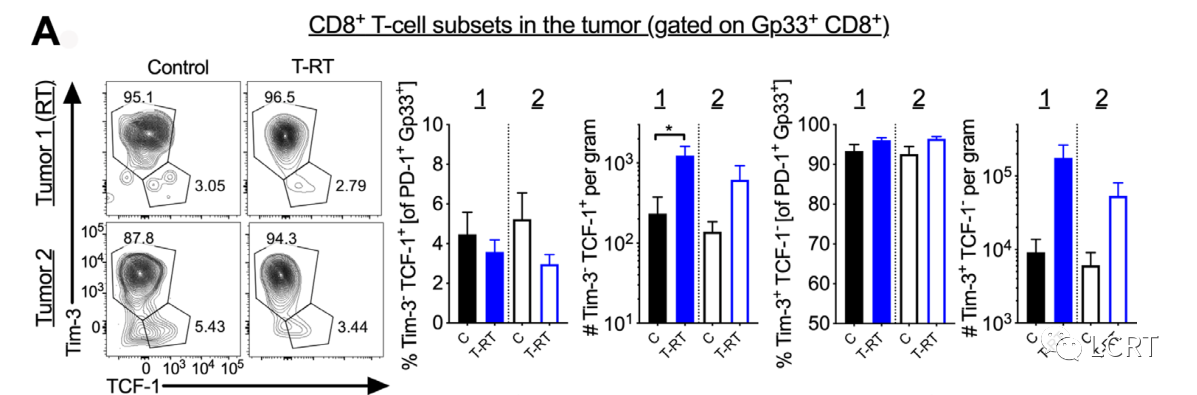
- 在亲本 B16F10 细胞系中,在肿瘤 1 或 2 中进行 T-RT 后没有观察到干细胞样 CD8 + T 细胞的显着增加。我们发现 T-RT 后 7 天 LN 中干性或效应细胞的频率变化没有统计学意义或趋势(图 4B)。

- 然而,我们确实看到增殖肿瘤特异性 CD8 + T- 细胞(图 4C,左和中)、干细胞样 CD8 + T- 细胞(图 4C,右)的频率增加。由于这种增殖反应表明 LN 可能在远隔效应中起作用,我们接下来将注意力集中在 LN 上。
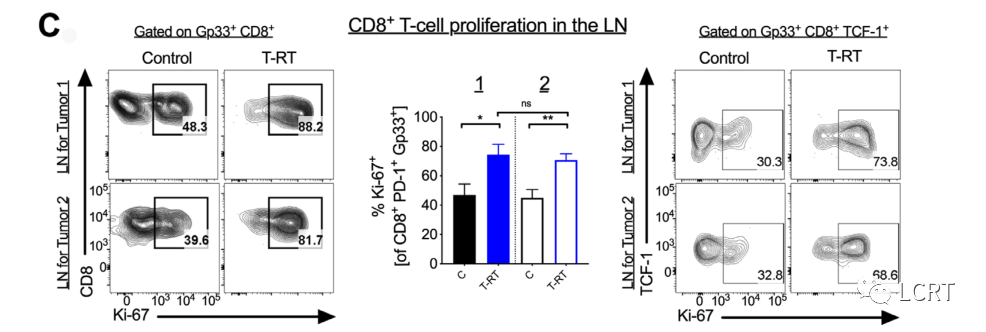
(左)肿瘤引流LN中增殖(Ki-67 +)肿瘤特异性CD8 + T细胞门控PD-1 int Gp33 +的典型流图。中间,辐照侧(1)和未辐照侧(2)LN中Ki-67 +频率的量化。
肿瘤引流LN定向放疗是可行的
- 为了评估引流肿瘤的 LN 在介导远隔效应中的重要性,我们通过靶向放疗 (LN-RT) 耗尽了引流肿瘤的 LN 淋巴细胞。为了首先确认我们能够在解剖学上识别出第一梯队肿瘤引流 LN,我们在侧腹肿瘤接种部位注射了伊文思蓝,并在注射后 5 分钟处死了小鼠。当时,唯一显示染料可见吸收的淋巴结是同侧腹股沟淋巴结 。为了确认这个节点可以用千伏 X 射线准确定位,我们获得了对比显微 CT(图5B)并根据计划的视野大小和腹股沟淋巴结的深度进行了剂量学计算。

- 然后通过在LN部位和肿瘤部位植入剂量计来确定指定的剂量传递,在适当的屏蔽下显示最小的散射到肿瘤(未显示)。为了进一步证实,我们在第一次RT分离后36小时处死小鼠(图5C),并进行Annexin- V和7- AAD染色(图5D),评估了靶向淋巴结的淋巴细胞死亡情况。我们观察到照射后淋巴结细胞死亡增加(图5D)。
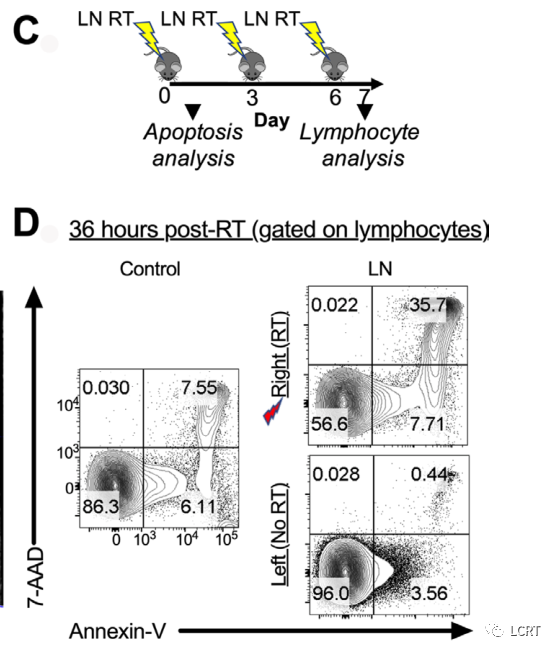
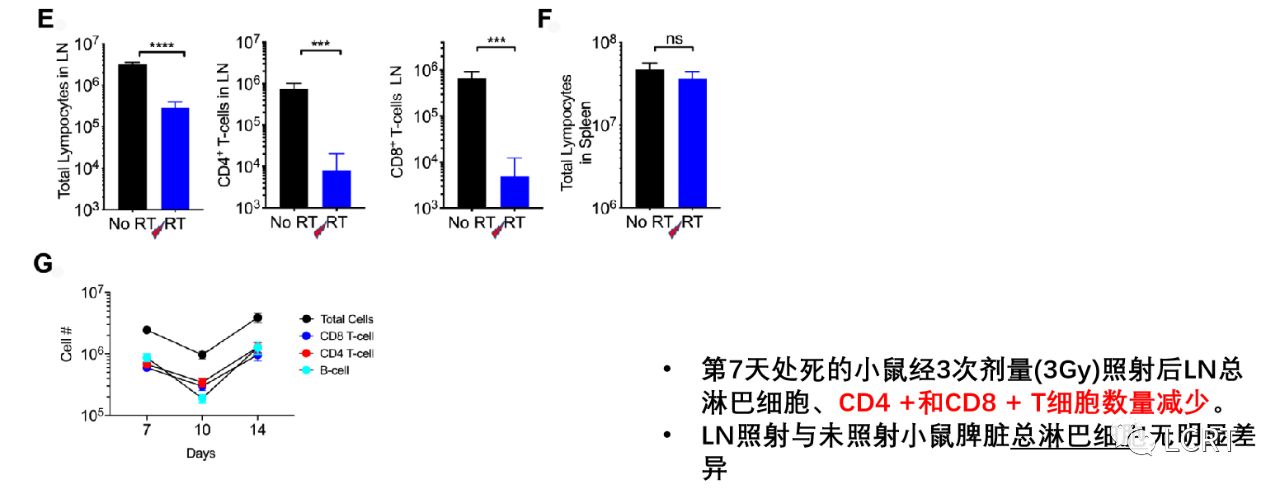
- 为了确认从靶向肿瘤引流LN中确实有T细胞耗尽,小鼠在第7天被处死,CT评估位置为3 Gy x 3F。10 Gy x 1F显示放疗后第7天辐照LN中的淋巴细胞未耗尽后,选择分级LN- RT。在规定放射野中的腹股沟LN显示CD4 +和CD8 + T细胞数量一致的双对数下降(图5E)。未观察到脾脏淋巴细胞数量的同时减少(图5F),这表明辐射是专门针对LN的,并没有引起循环淋巴细胞总数的整体减少。接下来我们进行了一个时间依赖性实验,发现 LN T细胞的最低点是在第一次辐射后的第10天(图5G)。然而,选择第7天, 因为此时LN细胞数量显著减少,这代表T细胞浸润到肿瘤的顶点。
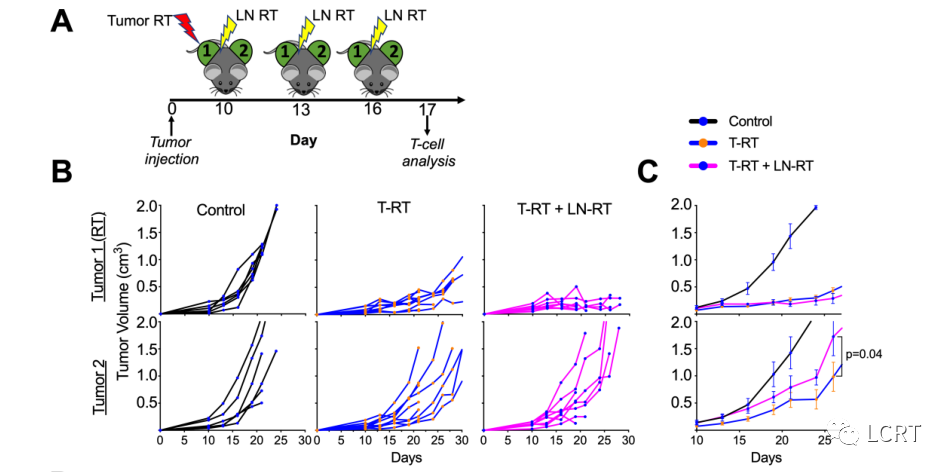
肿瘤引流LN定向放疗降低了远位效应
- 我们评估LN照射对肿瘤生长的影响。我们用分次放疗(3 Gy x 3 F)和单次 10 Gy 剂量照射肿瘤 1 的肿瘤引流淋巴结(图6)。为了进行T细胞分析,在最后一次LN照射后的第1天处死小鼠(图6A)。照射 LN 和肿瘤(T-RT+LN RT)没有显着损害局部肿瘤控制(图6B,C 顶部),但是,远隔效应降低(图6B,C 底部)。
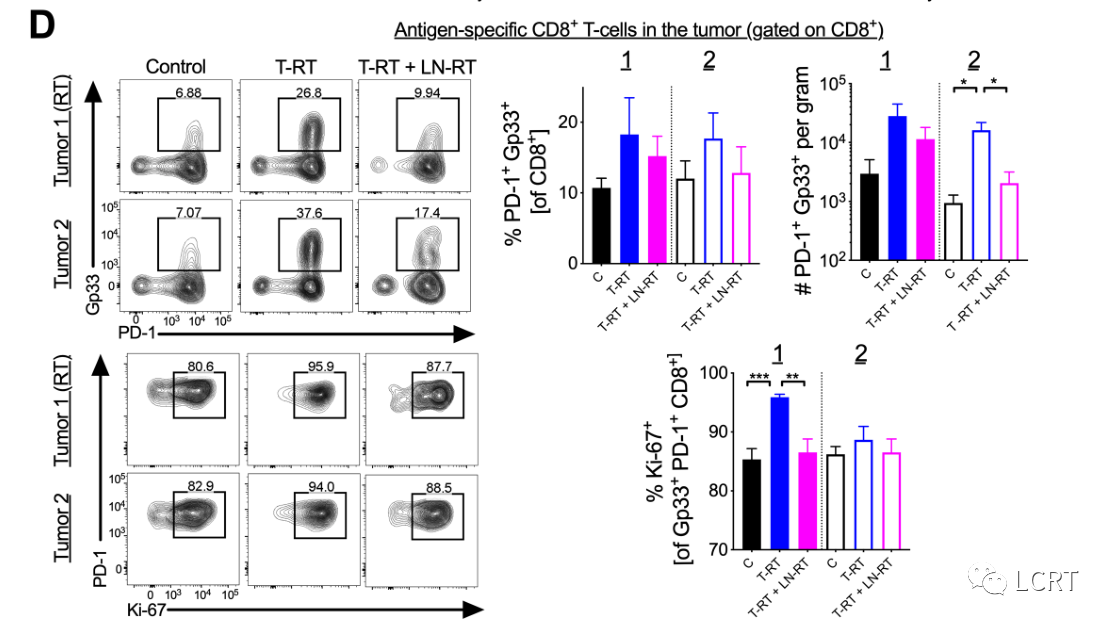
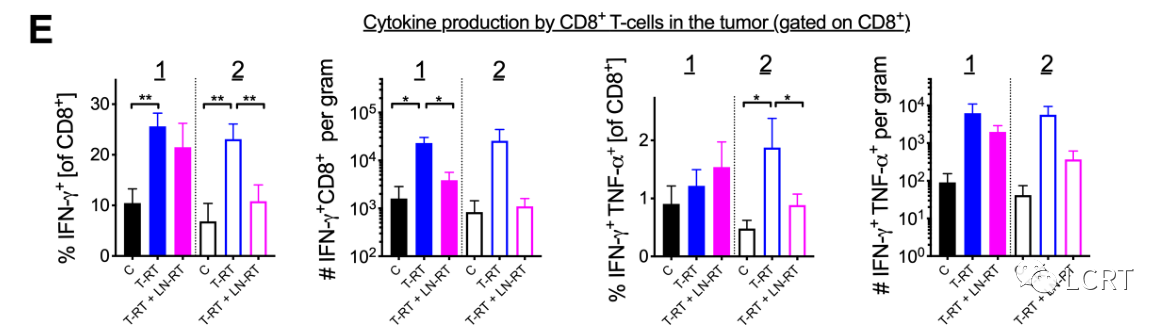
- 在T- RT+LN RT组中,肿瘤2(未放疗肿瘤)中肿瘤特异性CD8 + T细胞的增加明显降低(图6D,右)。LN定向RT也降低了放疗肿瘤中肿瘤特异性CD8 + T细胞增殖的频率(肿瘤1)(图6D,下)。与T- RT组相比,T- RT+LN RT组肿瘤2中IFN-γ + CD8 + T细胞和IFN-γ + TNF-α + CD8 + T细胞的频率均降低。
- 与T- RT组相比,T- RT+LN RT组肿瘤2中IFN-γ + CD8 + T细胞和IFN-γ + TNF-α + CD8 + T细胞的频率均降低。
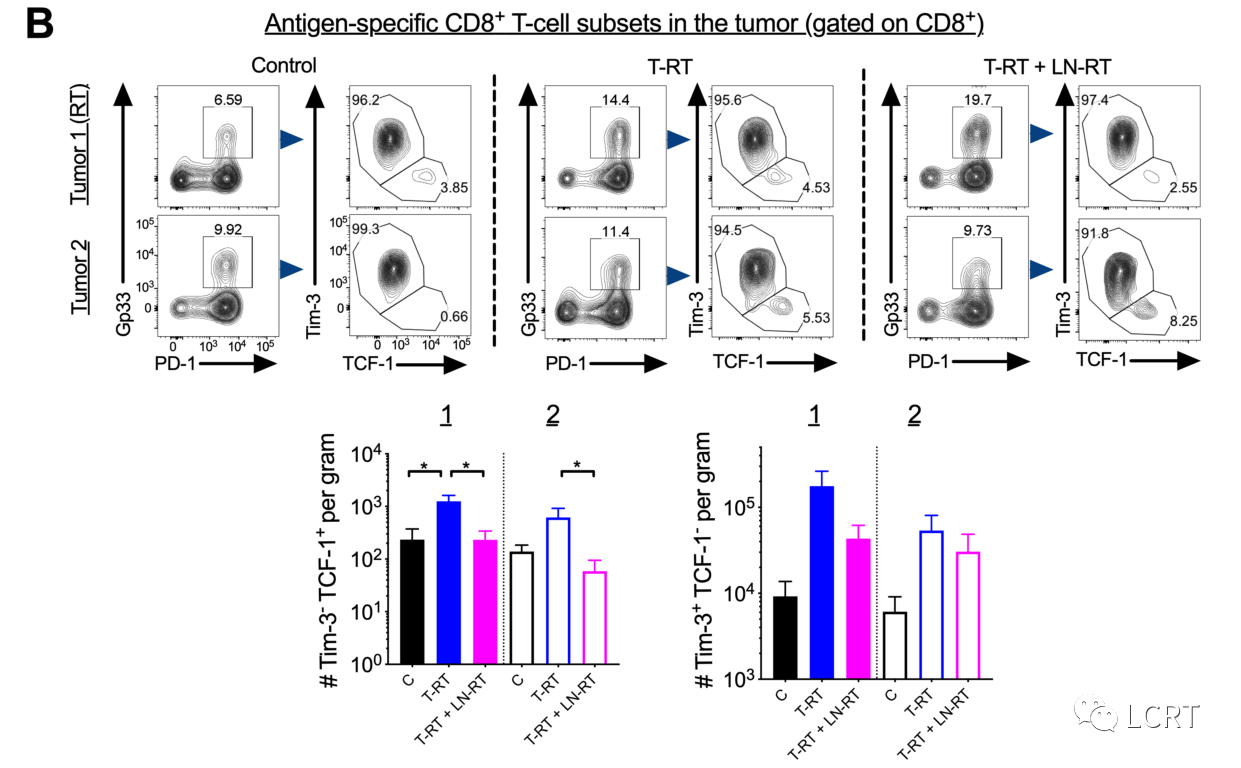
肿瘤引流LN RT减少肿瘤中干细胞样CD8 + T细胞的数量
- 评估了LN定向RT是否降低了LN中干细胞样CD8 + T细胞的数量。我们发现在放疗组(肿瘤1侧)和未放疗组(肿瘤2侧)LN(图7A,左)中,T- RT+LN显著降低。

- 与未放疗的LN相比,照射组的下降幅度更大。接下来,我们观察了肿瘤,发现在T- RT+LN RT组的肿瘤1和肿瘤2中,相对于T- RT组,干细胞样CD8 + T细胞数量减少(图7B,左)。在肿瘤1中,终末分化效应细胞也有类似的减少趋势,但在肿瘤2中则没有(图7B,右)。在肿瘤1和肿瘤2中,T- RT或T- RT+LN RT的肿瘤浸润调节性T细胞的频率均无显著差异。
❀ 研究结论❀
放疗 (RT) 已被证明可刺激受照射肿瘤以及未受照射的远处部位(远隔效应)中的抗肿瘤免疫反应。先前的研究已经证明了肿瘤引流淋巴结 (LN) 在介导抗程序性死亡-1 (PD-1)/程序性死亡配体-1 (PD-L1) 刺激的抗肿瘤免疫反应中的作用。在这里,我们调查了 LN 在介导单独的 RT 刺激远隔反应方面是否也很重要。使用皮下改良的 B16F10 胁腹肿瘤模型双侧注射。我们的 B16F10 细胞系具有插入的病毒糖蛋白,有助于识别肿瘤特异性 T 细胞。放疗仅针对一侧侧腹肿瘤或一侧侧腹肿瘤和引流肿瘤的淋巴结。我们通过流式细胞术评估了肿瘤、淋巴结 和T 细胞以及测量了肿瘤大小。结果表明局部肿瘤照射改善了远处肿瘤控制(远隔效应)。CD8 + T- 细胞的消耗显着降低了这种异位反应。PD-1/L1 阻断后 T 细胞增殖爆发由干细胞样 CD8 + T 细胞亚群提供,然后分化为终末分化的效应细胞。这些终末分化的效应细胞有可能在 PD-1/PD-L1 阻断后杀死病毒感染或肿瘤细胞。我们在这里发现这些细胞在肿瘤前哨LN 中频率较高,但在肿瘤内频率较低。RT 对该 T 细胞亚群的影响未知。有趣的是,肿瘤照射刺激了 LN 中的总 CD8 + 和干细胞样 CD8 + T 细胞增殖。当 LN 和肿瘤随后被 RT 靶向时,远隔效应降低,我们发现在两种辐射中,肿瘤特异性 CD8 + T- 细胞和干细胞样 CD8 + T- 细胞的总数随之减少。这些相关结果表明,肿瘤前哨 LN 通过充当干细胞样 CD8 + T 细胞库、干细胞样 T 细胞扩增位点以及它们可以在肿瘤中增殖的位点,它可能是远隔效应的重要介质。
❀ 研究点评 ❀
优点:
- 研究设计简单清晰
- 研究结果对结合原发肿瘤、淋巴结放射和免疫治疗以改善局部控制的抗癌方案具有重要的临床意义,特别是对于远处疾病失败风险高的患者。数据显示,以肿瘤为目标的放射引流LN实际上可能对控制远处疾病有害。
缺点:
- 未能明确肿瘤内的干性 CD8 + 和肿瘤引流 LN 是否都能够产生终末分化的效应细胞,以及两者之间终末分化的效应细胞是否可能不同。
- 需要进一步实验明确肿瘤驻留干细胞样 CD8 + T 细胞是否可能会更加耗竭并产生效应。
- 对其他T细胞亚型的影响未涉及。
❀ 参考文献 ❀
Buchwald ZS, Nasti TH, Lee J, Eberhardt CS, Wieland A, Im SJ, Lawson D, Curran W, Ahmed R, Khan MK. Tumor-draining lymph node is important for a robust abscopal effect stimulated by radiotherapy. J Immunother Cancer. 2020 Oct;8(2):e000867. doi: 10.1136/jitc-2020-000867.
原文链接:http://www.xxwk.net/archives/3049