肿瘤引流淋巴结(tumor-draining lymph node, tdLN)是肿瘤细胞转移的门户,也是适应性免疫应答发生的始发部位。虽然引流淋巴结中富集有大量树突状细胞(DCs)和淋巴细胞,但持续过量的肿瘤分泌物刺激及调节性 T 细胞(TRegs)积累,引发免疫耐受,抑制了DCs成熟及效应T细胞活化扩增,无法产生有效的抗肿瘤作用,导致肿瘤细胞逃逸并转移。因此,逆转肿瘤引流淋巴结的局部免疫抑制,增强肿瘤抗原特异性的效应 T 细胞活化扩增,重塑抗肿瘤免疫微环境,是改善肿瘤免疫治疗效果亟待解决的科学问题。
针对这一问题,中国海洋大学孔明教授团队采用纳米复合自溶微针设计,以透明质酸(HA)自溶微针为基质,负载纳米传递体,传递体表面装配甘油单硬脂酸(GMS)修饰的透明质酸(T-HA-GMS),表面连接 CD40蛋白抗体(αCD40),内部包载免疫佐剂PolyI:C、相关抗原,结合αPD1复合给药,构建肿瘤引流淋巴结靶向疫苗。复合疫苗能够自发调控疫苗输送和特异性免疫应答,逆转肿瘤引流淋巴结免疫抑制,增强抗肿瘤效应。
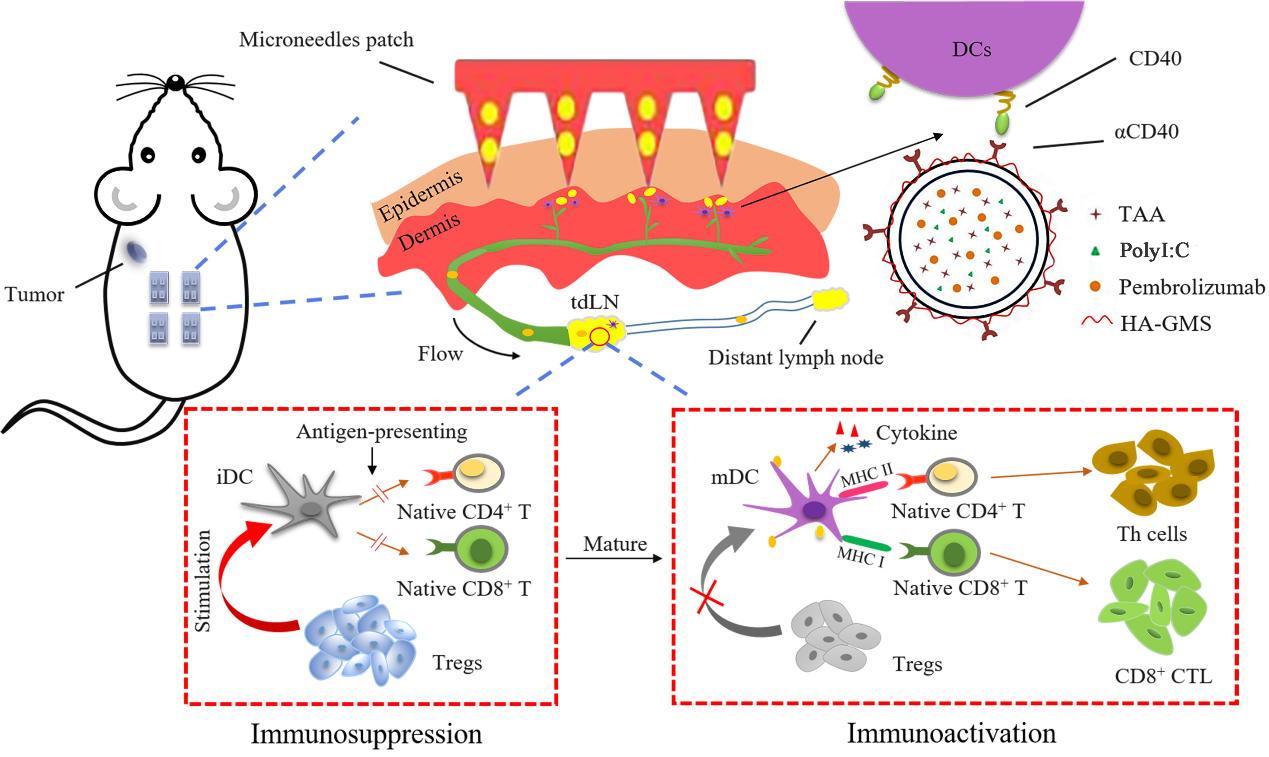
图1. 功能化传递体通过微针经皮给药靶向tdLNs并诱导免疫应答示意图
该团队利用黑色素瘤(B16F10)荷瘤小鼠模型通过激光共聚焦扫描显微镜定性观察和细胞流式计数定量统计表明,复合传递体能明显提高DCs细胞摄取量,促进细胞因子的表达,减少TRegs在tdLNs中累积,增加了效应T淋巴细胞的肿瘤浸润。

图2. 复合传递体在器官中分布以及特异性抗体、细胞因子表达
团队通过表面αCD40靶向设计实现了复合传递体淋巴靶向作用,并且避免了药物在心脏、肝脏、脾脏以及肾脏中的首过效应,促进IFN-γ和 IL-2 的表达,更重要的是复合传递体能明显的激起Th1型细胞免疫偏向。
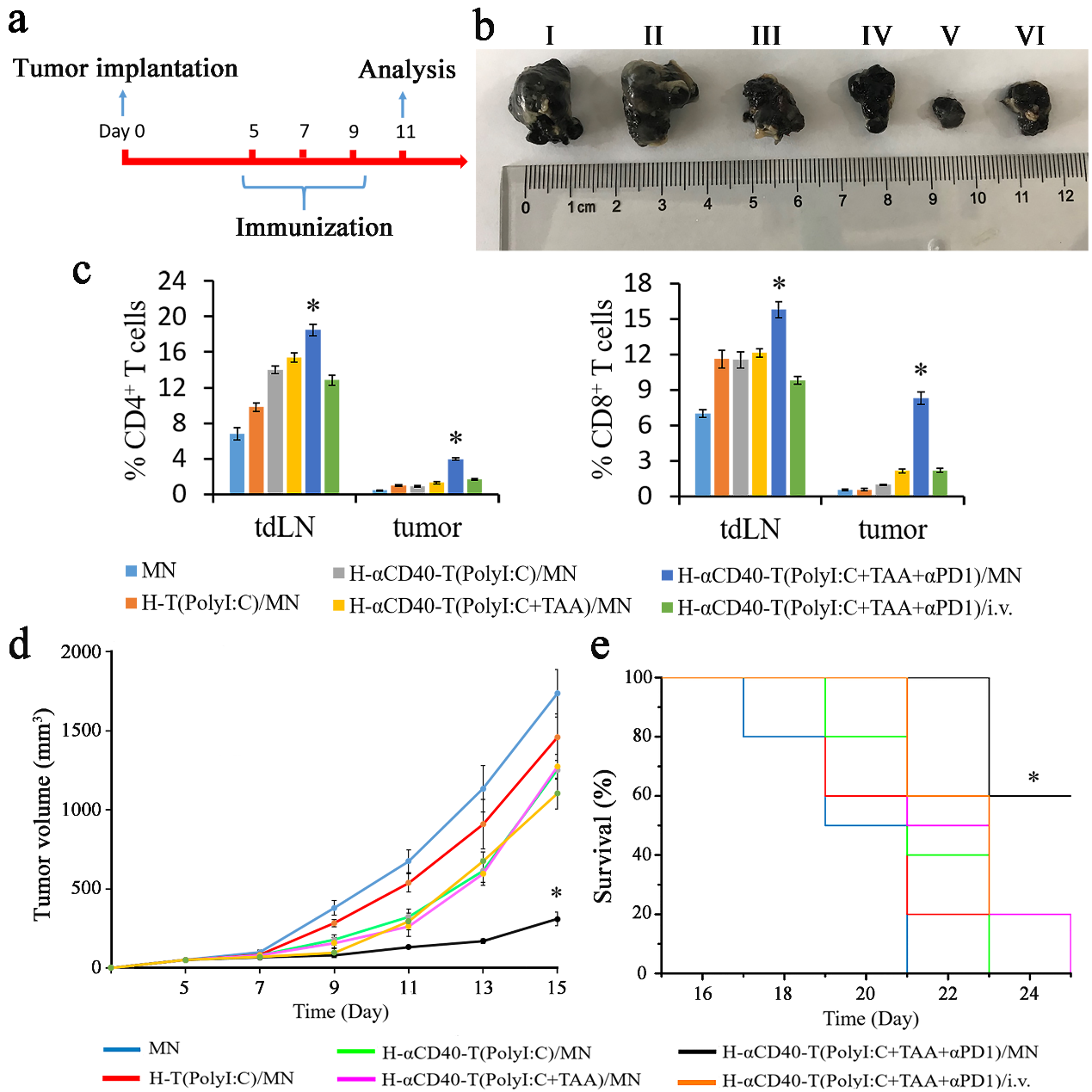
图3. 纳米复合微针疫苗联合αPD1治疗延长荷瘤小鼠生存时间。
该团队实现了传递体淋巴结靶向输送、树突状细胞识别摄取及成熟、胞内定位、抗原交叉呈递、效应 T 细胞活化扩增及浸润肿瘤,逆转肿瘤引流淋巴结免疫抑制。在肿瘤免疫的研究和临床应用方面提供了新思路。
原文链接:http://www.xxwk.net/archives/3122