背景
在几种恶性肿瘤中出现了新辅助治疗后的主动监测。在主动监测期间,会进行频繁的评估以检测残留病灶,并且仅对那些已证实或高度怀疑残留病灶且无远处转移的患者保留手术。新辅助放化疗 (nCRT) 后,近三分之一的食管癌患者达到病理完全缓解 (pCR)。在 nCRT 后达到 pCR 的患者和患有亚临床播散性疾病的患者都可以从主动监测策略中受益。
概括
食管切除术仍然是食管癌患者治疗的基石。通过根治性放化疗 (dCRT) 进行的非手术治疗目前仅适用于不适合食管切除术的患者。由于与 nCRT (41.4 Gy) 后的手术相比,dCRT (50-60 Gy) 后的挽救性食管切除术导致并发症、发病率和死亡率增加,因此后者在主动监测的情况下似乎更可取。临床反应评估可以在 nCRT 后以 90% 的灵敏度检测到实质性(即肿瘤消退等级 [TRG] 3-4)肿瘤,从而最大限度地降低发生不可切除复发的风险。目前稀缺的回顾性文献表明,nCRT 后的主动监测可能不会危及总体生存率,并且可以安全地进行延期手术。
关键信息
在将主动监测方法视为标准治疗之前,应等待 III 期随机试验的结果。关键词:食管癌,保留器官治疗,主动监测,新辅助放化疗,食管切除术去:
介绍
一些恶性肿瘤已经出现了保留器官的治疗方法,它避免了由于手术切除导致的器官功能丧失。20 多年前,这种治疗策略被引入头颈癌,尤其是喉癌 [ 1 , 2 ]。据报道,初始器官保留后的抢救手术具有可接受的术后并发症发生率 [ 3 ]。在喉癌取得可喜成果后,针对前列腺癌和直肠癌的类似策略也被报道 [ 4 , 5 , 6 , 7 , 8 , 9]。在监测期间,主要是在包括化疗和放疗在内的新辅助治疗之后,经常进行检查以检测疾病的残留或进展。手术切除只保留给那些在没有远处转移的情况下证实或高度怀疑有残留疾病的患者。据报道,在喉癌、前列腺癌和直肠癌中,主动监测是一种安全策略,不会影响总生存期 (OS)。
在食道癌中,根据 CROSS 方案 [ 10 ],29% 的患者在新辅助放化疗 (nCRT) 后表现出病理完全缓解 (pCR)。关于新辅助治疗后临床完全缓解(cCR)的食管癌患者保留器官治疗的文献很少。一些研究表明 OS 与标准食管切除术相当 [ 11 , 12 , 13]。这些研究的回顾性和少数纳入的患者促使需要对该主题进行进一步的研究。目前,一些挑战限制了在食管癌中广泛使用器官保留策略。本综述旨在概述目前的治疗方案以及对食管癌进行器官保留治疗的可能机会。去:
手术和(新)辅助治疗
食管切除术仍被认为是治愈局部晚期食管癌的关键步骤。第一篇关于 1953 年至 1978 年间食管癌手术结果的评论文章报告了 12% 的平均 5 年生存率和 29% 的医院死亡率 [ 14 , 15 ]。从 1980 年到 1988 年,这 5 年生存率增加到 20%,医院死亡率为 13% [ 16 ]。正如一项荟萃分析所报道的,经胸食管和经食管食管切除术的 OS 均相似,均为 20% [ 17]。然而,一项荷兰试验(HIVEX-study)随机分配了 220 名食管中远端或贲门腺癌患者,经食管入路的 5 年 OS 为 27%,经食管入路的 5 年 OS 为 39%。经胸入路扩大整块淋巴结切除术 [ 18 ]。尽管在过去几十年中更好的患者选择和围手术期护理的改进导致更高的存活率,但无肿瘤切除边缘的患者百分比仍然是一个问题。对于这两种方法,HIVEX 试验报告了 30% 的显微镜下非根治性切除术。
为了减少非根治性切除的数量,已经彻底研究了由化学和/或放射治疗方案组成的新辅助疗法。1996 年发表了第一个比较三联治疗与单独手术的完整、充分有力的随机对照试验 [ 19 ]。这项研究纳入了 113 名食管腺癌患者,报告称在手术中加入 nCRT 后 3 年生存率从 6% 提高到 32%。另一项比较三联疗法与单独手术的试验是 CROSS 试验 [ 10 , 20]。这项荷兰多中心随机对照试验包括 366 名食管癌或交界癌患者。在 nCRT 后,92% 的患者接受了食管根治性切除术,而单纯手术组为 69%。29% 的患者达到 pCR(腺癌为 23%,鳞状细胞癌为 49%)。重要的是,在手术中添加 nCRT 后,5 年 OS 从 33% 提高到 47%。接受 nCRT 的患者未发现术后并发症增加。自 CROSS 试验发表以来,nCRT 后手术已被西方世界大部分地区采用作为局部晚期食管癌的标准治疗方法。
此外,(新)辅助化疗已被证明可有效治疗食管癌。
OEO2 试验是研究食管癌新辅助化疗疗效的最大试验 [ 21 ]。1992 年至 1998 年间,来自 42 个欧洲中心的 802 名局部晚期食管鳞状细胞癌或食管腺癌患者被随机分配接受术前化疗(顺铂和氟尿嘧啶),然后进行手术与单纯手术。在术前化疗组中,无病生存期 (DFS)(风险比 [HR] 0.75;p = 0.0014)和 2 年 OS(HR 0.79;p = 0.004)均较高。长期结果证实了 DFS 和 OS 的改善 [ 22 ]。MAGIC 和 ACCORD-07 试验证实了围手术期化疗对食管癌和胃癌患者的疗效。23、24 ]。_ 令人惊讶的是,RTOG-8911 试验在 1990 年至 1995 年期间将 440 名局部晚期食管鳞状细胞癌或食管腺癌患者随机分组,在术前化疗后手术和单纯手术之间进行,但未能显示 5 年和 9 年 OS 的改善术前化疗后加用顺铂和氟尿嘧啶[ 25 , 26 ]。
与单独手术相比,化疗和放化疗都显示出 OS 的统计学显着改善。通过在手术中添加 nCRT 在 CROSS 试验中观察到的 OS 改善(14%)与 MAGIC 和 ACCORD-07 试验的改善(分别为 13% 和 15%)相当。放化疗可能显示出较少的发病率,并且仅适度降低生活质量 [ 27 , 28 , 29 , 30 ]。迄今为止,尚未发表根据 CROSS 方案比较化疗与 nCRT 的 OS 随机临床试验。目前,有 2 项研究正在解决这个问题;Neo-AEGIS 试验和 ESOPEC 试验 [ 31 , 32 ]。
根据 CROSS 方案接受 nCRT 的患者中有 29% 显示 pCR,而 MAGIC 和 ACCORD-07 试验中分别为 3% 和 0%。在中位随访 84.1 个月后,CROSS 试验中 39% 的患者在新辅助治疗和手术后出现远处进展,在 ACCORD-07 试验中中位随访 68.4 个月后,这一比例为 30%。这表明许多患者在诊断时已经存在微转移。CROSS 后的高 pCR 率和手术后(新)辅助治疗后远处转移的频繁发展都使人面临两难境地已被证实或高度怀疑,在没有远处转移的情况下。通过这种方式,可以推迟甚至避免食管切除术,不仅适用于在 nCRT 后恰好达到生物学完全缓解的患者,而且适用于在主动监测期间发生远处转移的患者,因为远处转移将严重决定这些患者的生存率。去:
根治性放化疗
对于因身体虚弱或严重合并症或位置不利(如颈段食管)或肿瘤分期 (cT4b) 而不适合手术的患者,根治性放化疗是首选的治愈性标准治疗方法 [ 33 ]。确定性非手术治疗主要包括同步放化疗,因为 RTOG 85-01 研究报告了放化疗优于单独放疗 [ 34 , 35 , 36 ]。
已经进行了几项试验来比较可手术患者的手术和非手术治疗。1994 年至 2002 年间,Stahl 等人。[ 37 ] 将 172 名局部晚期鳞状细胞癌患者随机分配给 nCRT,然后进行食管切除术和 dCRT。两组的三年 OS 相似。尽管食管切除术组的局部无进展生存期更好(64.3 vs. 40.7%;HR 2.1,p = 0.003),但治疗相关死亡率更高(12.8 vs. 3.5%;p = 0.03)。贝登等人。[ 38] 将 1993 年至 2000 年间的 259 名局部晚期食管癌患者随机分配给 nCRT,然后进行食管切除术和 dCRT。尽管接受 dCRT 的患者 2 年后局部复发率较高(HR 1.63,p = 0.03),但食管切除术组术后前 3 个月的死亡率较高(HR 1.63,p = 0.002)。应谨慎解释这些结果,因为 nCRT 和手术后的 2 年 OS 仅为 33.6%,而 CROSS 试验中为 67%。此外,Bedenne 等人。[ 38 ] 试验排除了 43% 对 nCRT 无反应的患者。随后的分析显示,接受食管切除术的有反应者和无反应者之间的生存率相似,这似乎很难解释 [ 39]。
尽管患者接受 dCRT 主要是因为他们不符合食管切除术的条件,但有一部分患者在 dCRT 后符合条件,并因残留或复发的疾病而接受食管切除术(所谓的抢救手术)。几项研究报告,与 nCRT 后的手术或单独手术相比,dCRT 后手术的死亡率和发病率更高 [ 40 , 41 , 42 ]]。据报道,这些接受挽救性食管切除术的患者的 5 年 OS 率为 25%,因此较高的并发症、发病率和死亡率被认为是可以接受的。然而,应谨慎考虑抢救性食管切除术的适应症,并且仅适用于选定的患者组。此外,术语“抢救性食管切除术”有时用于 nCRT 后的延迟食管切除术,因此定义似乎不清楚。然而,dCRT (50-60 Gy) 后的抢救手术和 nCRT (41.4 Gy) 后的延期手术应被视为 2 个不同的实体。由于在主动监测的背景下,nCRT 后推迟手术预计对相当多的患者是必要的,并且 dCRT 会显着增加术后不良结果,因此根据 CROSS 方案的 nCRT (41.43、44 ]。_去:
临床反应评估
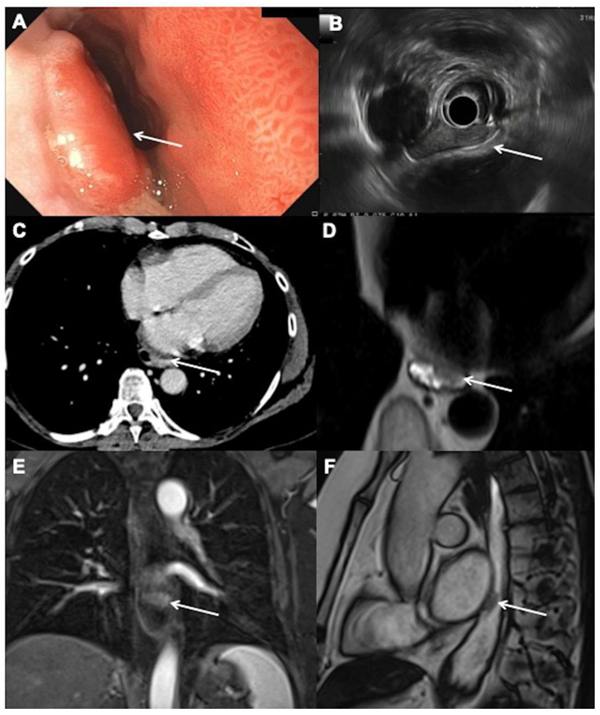
在实施主动监测策略之前,应该解决几个挑战。最重要的是,操作系统不应受到危害。为了防止发生不可切除的复发,应及早发现残留病灶。此类临床反应评估 (CRE),主要包括内窥镜活检、超声内镜 (EUS)、正电子发射断层扫描 ( 18F-氟脱氧葡萄糖 (PET)、CT 和/或 MRI 应确定患者是否被认为是临床完全反应者。准确的 CRE 应该能够检测残留的癌症,同时它仍然可以切除,并且有很高的完全切除肿瘤的机会(根治性切除)。为了证明主动监测策略的合理性并安全地推迟手术,应彻底研究 nCRT 后 CRE 的价值和准确性。
由于 CRE 没有标准协议,因此有关这些评估的研究具有很大的异质性。对于内窥镜活检,3 项前瞻性研究报告了 30-40% 的敏感性和 100% 的特异性 [ 45 , 46 , 47 ]。三项前瞻性研究报告了 EUS 的敏感性和特异性分别为 95% 至 100% 和 0% 至 47% [ 46 , 48 , 49 ]。虽然 nCRT 后的 PET-CT 主要用于检测远处间隔转移,但也评估了 CRE 的价值。两项前瞻性研究报告了 51-60% 的敏感性和 60-67% 的特异性 [ 45 , 50]。一项包括 64 名患者的前瞻性研究评估了任何这些诊断方式(内窥镜活检、PET 和 CT)的组合,并报告了 76% 的敏感性和 82% 的特异性 [ 45 ]。评估诊断方式组合的最新和最大的试验是 preSANO 试验 [ 51]。这项前瞻性多中心试验评估了 CRE 的准确性,旨在确定最佳的诊断方式,以准确揭示 nCRT 后残留的食管癌。2013 年至 2016 年期间纳入了约 207 例食管或食管胃交界处鳞状细胞癌或腺癌患者。本研究的目的是评估 CRE 结果与切除标本中肿瘤消退等级 (TRG) 之间的相关性。该研究的主要终点是在 CRE 期间检测到的 TRG3-4 肿瘤(> 10% 残留肿瘤细胞)的比例。假设 TRG2 肿瘤(1-10% 残留肿瘤细胞)最初可能会被遗漏,因为这些肿瘤将在主动监测期间发展为可检测到的 TRG3-4 残留疾病,并且可以在正确的时间安全切除。
nCRT 完成六周后,患者接受了第一次 CRE (CRE-1),根据 CROSS 方案仅进行内镜活检。如果 CRE-1 结果为阴性,则在 nCRT 完成 12 周后进行第二次 CRE (CRE-2),包括 PET-CT,然后进行内镜活检和 EUS,对所有疑似淋巴结进行 FNA。之后,所有患者都接受了手术。如果在两次反应评估期间均未证实有重要的肿瘤细胞,则将患者视为 cCR,并将这些结果与患者的手术标本进行比较。31% 的 TRG3-4 肿瘤患者使用内窥镜活检和所有疑似淋巴结的 FNA 和 EUS 被认为是 cCR。在引入咬咬活组织检查后,这一比例大幅提高至 10%。人们认为,通过咬合活检,52 ]。此外,在 CRE-1 和 CRE-2 期间用 PET-CT 检测到 10% 的患者出现间期转移。这些结果被认为足以继续进行 SANO 试验(食道癌所需的手术);一项比较主动监测与立即手术的 3 期多中心随机对照试验 [ 53 ]。去:
食管癌的主动监测
尽管关于 nCRT 加主动监测与 nCRT 后立即手术对食管癌患者的结果相比的文献很少,但一些研究已经发表。2012 年,Taketa 等人。[ 11] 回顾性分析了 622 例放化疗和手术后的患者。cCR 被定义为活检中没有重要的肿瘤细胞,并且通过 PET-CT 具有生理范围的摄取。61 名 cCR 患者在 nCRT 和术前内镜活检和 PET-CT 分期后拒绝手术。这些患者的 5 年总生存率和无复发生存率分别为 58.1% 和 35.3%。一年后,拒绝立即手术的患者和接受标准三联疗法的患者之间的结果使用倾向评分匹配进行比较,报告的 3 年 OS 没有差异(分别为 62% 和 56%;p = 0.28)[ 12]。31% 拒绝立即手术的患者最终因为没有远处转移的残留病灶而推迟了切除术,并且所有切除术都是根治性的。卡斯托罗等人。[ 13 ] 回顾性纳入了 77 名新辅助治疗后 cCR 患者,其中 38 人拒绝手术,39 人立即接受手术。倾向得分匹配后,5 年 OS 和 DFS 未报告差异。
目前,荷兰 SANO 和法国 ESOSTRATE 试验正在根据 CROSS 方案在 nCRT 后显示 cCR 的食管鳞状细胞癌或腺癌患者的主动监测与立即手术进行比较 [ 53]。在 SANO 试验中,cCR 被定义为内窥镜检查和多次咬合活检、EUS 和所有疑似淋巴结的 FNA 和 PET-CT,在 nCRT 完成 12 周后均未显示残留疾病或远处转移的迹象. 在达到 cCR 后,根据阶梯楔形设计,即基于机构层面而非个体层面的随机化,患者被随机分配到主动监测或立即切除,因为个体层面保守治疗和手术治疗之间的随机化通常失败由于令人失望的纳入率 [ 54 , 55 ]。去:
未来展望
在食管癌中安全和谨慎地实施保留器官的方法取决于几个基石。首先,需要进一步改进CRE,以避免在主动监测期间发生不可切除的残留疾病的风险。为此,应该分析为什么内窥镜咬合活检仍显示假阴性结果。可能有两个主要原因;或者残留肿瘤的位置是浅表的,但活检没有准确定位,或者残留肿瘤太深,内窥镜活检无法到达肿瘤,正如早期研究中已经提出的那样 [ 56 , 57]。在 CRE 期间对大面积食道进行取样可以克服取样错误的问题,例如 Endosponge®(美敦力,明尼阿波利斯,明尼苏达州,美国)和广域经上皮取样程序 [ 58 , 59 ]。后一种技术使用微创刷活检技术,该技术对与粘膜肌层一样深的层进行采样。到达食管壁更深部分的新型活检器械,如细针活检 (FNB),可以克服残留肿瘤埋在无肿瘤(亚)粘膜层下的问题[ 57、60、61]。FNB被认为是安全的,广泛用于胃肠道。动态对比增强 MRI 在检测 nCRT 后残留疾病方面显示出潜在的益处 [ 62 ]。尽管由于假阳性率高(主要是放射性食管炎),PET-CT 似乎不足以确定患者是否应在 nCRT 后早期接受手术,但使用 PET-CT 对残留病灶进行半定量评估的价值CT 在监测期间可能很有价值,目前是 SANO 试验中监测策略的一部分 [ 51 ]。此外,新的生物标志物可能会揭示外周血中的残留肿瘤 [ 63]。这种生物标志物的一个例子是循环肿瘤 DNA (ctDNA),它从坏死的肿瘤细胞中自由脱落到外周血中。在新一代测序和全外显子组测序的帮助下,可以检测到极少量的含有食管癌特异性突变的 DNA,因此,可以在早期检测残留肿瘤,并作为“液体活检”[ 64 , 65]。尽管 CRE 在揭示残留疾病方面被认为足够准确,但由于原发肿瘤的原位时间延长,理论上延迟检测复发可能导致远处传播率增加。尽管之前的研究表明,接受 nCRT 手术和不手术的患者之间的远距离传播率没有差异,但在主动监测期间必须谨慎监测 [ 12 , 13]。其次,主动监测策略的实施应附带一些附注。尽管主动监测策略具有明显的临床优势,但对于是否所有 cCR 患者都需要主动监测策略存在担忧。这种策略伴随着更频繁的医院就诊和额外的侵入性诊断测试,这可能会导致心理负担。此外,患者可能会感到焦虑,因为肿瘤可能没有得到最佳治疗,并且仍可能需要推迟手术。这些因素可能超过预防手术的优势 [ 66 ]。早期的研究报告了患者和他们的医生之间的决策差异,这强调了共同决策的必要性[67 ]。最近的一项研究表明,在术前阶段,食管癌患者愿意牺牲平均 15% 的 5 年生存率,以将食管切除术的需求从 100% 降低到 35% [ 68 ]。未来的研究应在术后环境中证实这些结果。此外,应确定与立即手术或主动监测偏好明显相关的患者因素,以便更好地告知和建议患者做出决策[ 69 ]。去:
结论
在 nCRT 后,多达三分之一的患者在切除标本中显示 pCR。这引发了对 cCR 患者是否适合主动监测的讨论。目前,主要的挑战是提高肿瘤残留的临床鉴定水平。
稀缺的回顾性文献表明,在 nCRT 后进行主动监测的保留器官的方法可能不会危及 OS,并且可以安全地进行推迟手术。在将主动监测方法视为食管癌患者标准治疗的一部分之前,应等待随机试验的结果,例如 ESOSTRATE 和 SANO 试验。
原文链接:http://www.xxwk.net/archives/499